葡萄园土壤中酿酒酵母的分离鉴定及其发酵葡萄酒香气成分分析
2018-07-24王旭增王一非姚凌云徐志民
冯 涛,王旭增,王一非,孙 敏,姚凌云,徐志民
(1.上海应用技术大学香料香精技术与工程学院,上海 201418;2.路易斯安拉州立大学食品科学系,美国 路易斯安那 巴吞鲁日 70802)
随着人们生活水平的提高,葡萄酒逐渐在我国被普遍接受。同时出于绿色酿造和健康饮用的理念,越来越多的人开始自己在家中酿制葡萄酒,不仅能够享受到绿色酿造的乐趣,还能品尝到天然无添加的葡萄酒。家庭自酿多采用鲜食葡萄作为酿酒原料,酵母菌是生产葡萄酒的主要微生物菌群,是葡萄酒发酵过程中的关键因素,葡萄酒的酿造都是在酵母菌的作用下,采用自然发酵或者纯种发酵,将葡萄原料中的各种潜在成分在酒中充分表现出来[1],因此葡萄酒酵母筛选历来很受重视[2]。
目前的市售酵母中,针对鲜食葡萄发酵的家酿葡萄酒酵母种类较少,鲜食葡萄酿酒酵母菌株主要筛选自葡萄的果皮、土壤或是在葡萄自然发酵过程中筛选。徐建东等[3]从鲜食葡萄龙眼的葡萄皮及种植土壤中筛选出一株低醇酵母菌株F12,谭海刚等[4]从鲜食葡萄红提等的葡萄园土壤中筛选出耐乙醇酵母菌株QY29,葛含静[5]从鲜食葡萄户太八号的醪液中分离出起酵快、发酵稳定的酵母菌株S37,以上筛选出的酵母菌株均具有一定的优势。在多年种植鲜食葡萄的园区中,有多种天然酵母与其相伴而生,经长期的自然选择和进化演变,逐渐形成一批适合鲜食葡萄发酵的天然优势酵母,从中可以筛选出具有优良品质的鲜食葡萄酒酵母[6],这种具有独特风格的酿酒酵母显得非常重要[7]。在葡萄栽培以及酿酒历史悠久的欧洲,尤其是在名酒产地,目前仍然利用优越的天然酵母群进行发酵。我国的各大葡萄酒厂十分重视自己酵母的选育,如山东烟台张裕酿酒公司选育的7318、7448酵母等[8],郭志刚等[9]利用都善红葡萄分离筛选葡萄酒酵母,发酵都善红葡萄酿制成了具有特色的名酒“楼兰古酒”。这些酵母为葡萄酒特色和品牌的形成奠定了基础[10]。
中国的鲜食葡萄产量已连续多年为世界第一,但是鲜食葡萄加工业相对落后,对酿酒上的研究更少[11],除了鲜食葡萄皮薄肉质硬、出汁率低以及含糖量低等因素外,缺乏针对鲜食葡萄发酵的酿酒酵母[12],同样是鲜食葡萄发酵酒的香气和风味欠佳的重要原因之一,所以筛选出一种针对鲜食葡萄酒发酵、产生优良香气的酿酒酵母尤为必要。因此从天然酵母中,筛选出针对鲜食葡萄发酵的家酿葡萄酒酵母是一项十分有意义和有价值的工作。本实验通过从葡萄种植土壤中对鲜食葡萄酿酒酵母的筛选方法和酿造酒的香气分析进行探索,为今后开展这方面的研究工作积累经验和理论支持。
1 材料与方法
1.1 材料与试剂
醉金香葡萄购于上海松江区,采摘于2016年8月份,含糖量16.8%,总酸0.61%,平均粒质量13 g。土壤样品分别由上海奉贤、上海崇明、上海松江、湖北武汉、浙江绍兴、山东菏泽、辽宁铁岭等地葡萄园土壤中采集得到。
安琪葡萄酒酵母 上海市安琪酵母有限公司;帝伯仕葡萄酒酵母 山东烟台帝伯仕自酿机有限公司;GBS酵母DNA试剂盒 南京捷倍思生物基因技术有限公司。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯9.0 g/L,葡萄糖22.0 g/L,琼脂13.0 g/L,按上述配方配好后加热溶解,pH 6.5±0.2,121 ℃灭菌20 min;酵母浸出粉葡萄糖(yeast peptone dextrose,YPD)培养基:酵母膏1%,蛋白胨2%,葡萄糖2%,按上述配方配好后加热溶解,pH 6.5±0.2,121 ℃灭菌20 min。
1.2 仪器与设备
LDZX-KBS高压蒸汽灭菌锅 上海申安医疗器械厂;DHP-9052型电热恒温培养箱 上海益恒实验仪器公司;SPX-150B-Z恒温培养箱 上海博迅有限公司;DHG-9145A恒温干燥箱 上海一恒科技有限公司;GL-21B高速冷冻离心机 上海安亭科学仪器厂;SelectCycler II聚合酶链式反应(polymerase chain reaction,PCR)仪 上海巴玖实业有限公司;7890A/5975C型气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用仪 美国Agilent公司。
1.3 方法
1.3.1 葡萄园土壤中酿酒酵母的分离活化
富集酵母菌[13]:取土壤样品10 g,加入到200 mL无菌水中,在28 ℃的恒温培养箱中200 r/min培养20 min。
酵母菌分离:取上述培养液1 mL进行梯度稀释,分别吸取10-3、10-4和10-5梯度的稀释液200 μL涂布于PDA平板[14],在28 ℃恒温培养箱中培养48 h后挑取菌落染色镜检,筛选酵母菌,经2~3 次划线分离[15],得到酵母纯培养物。
酵母菌活化:将上述酵母纯培养物接种至YPD液体培养基中28 ℃振荡培养24 h,培养物6 000 r/min离心10 min[16],重复两次得到酵母,4 ℃冷藏备用。
1.3.2 26S rDNA鉴定
利用GBS酵母DNA提取试剂盒提取酵母菌的DNA,以DNA基因组为模板,以真菌26S rDNA D1区通用引物NL1(5’-GCATATCAATAAGCGGAGGAAAAG-3’)和NL4(5’-GGTCCGTGTTTCAAGACGG-3’)为引物,进行PCR扩增[17]。
PCR扩增采用50 μL体系:ddH2O 18 μL,10 μmol/L引物NL12 μL,10 μmol/L引物NL42 μL,dNTPs(2.5 mmol/L)1 μL,5 U TaqE酶25 μL,酵母菌DNA模板2 μL。
PCR扩增程序:95 ℃预变性10 min;94 ℃变性1 min;54 ℃退火1 min;72 ℃延伸1.5 min,36 个循环;最后72 ℃延伸5 min。
扩增产物进行琼脂糖凝胶电泳检测,测序并与NCBI数据库进行BLAST同源性序列比对分析[18]。根据同源序列的比对结果,从GenBank数据库下载相应模式菌株,利用MEGA 7.0软件计算菌株进化距离[19],运用NJ(Neighbor-Joining)法构建分离出的生香酵母菌的系统发育树。
1.3.3 葡萄汁发酵
称取1 kg“醉金香”白葡萄,洗净破碎后得到葡萄醪,加入1 L发酵罐内并添加调硫片(200 mg/L)。将发酵罐于20~25 ℃静置,使葡萄皮中的呈香、呈味物质浸渍到葡萄醪,24 h后用比重计(量程1.0~1.1)和温度计分别测其相对密度和温度,并测定其清汁糖度,根据所测糖度补充葡萄糖,将糖度调节至25 °Brix[20]。将酵母分别按照107CFU/mL接入葡萄醪,于28 ℃恒温培养箱中发酵,每组实验重复3 次。每天定时测定葡萄醪的相对密度变化,当酒液的相对密度接近0.997连续2 d保持不变即视为发酵完成,终止发酵[21],将酒液进行澄清,过滤处理后放入低温环境(12 ℃)贮存。发酵结束后,根据GB/T 15038—2006《葡萄酒、果酒通用分析方法》中的基本指标,测定葡萄酒样的基本理化指标(总糖含量、总还原糖含量、乙醇体积分数、总酸含量、总挥发酸含量、总二氧化硫含量)。
1.3.4 感官评定
建立感官评定小组,由12 位经过培训的人员[22](6 男6 女,年龄范围为25~30 岁)组成,培训标准根据ISO13300-2-2006[23]制定,评定方法按照Jackson[24]的感官环境和操作步骤进行,并引用Rutan等[25]的感官分析方法,根据实际情况建立对葡萄酒的呈香感官描述(表1)。评定方法为9 分嗜好法,0~9 分表示风味逐渐增强,其中0 分代表没有被察觉,9 分代表风味强度最大。每种发酵酒感官评定3 次,取平均值。

表1 葡萄酒香气评价[25]Table1 Flavor descriptions of wine
1.3.5 发酵酒中挥发性香气成分的提取检测
固相微萃取[26]:取5 mL发酵酒于15 mL顶空瓶中恒温(55 ℃)水浴,并向顶空瓶中加入20 μL 2-辛醇(600 mg/L),用盖子密封后插入75 μL CAR/PDMS萃取头,保持30 min。
G C条件[27]:H P-I N N O WA X毛细管色谱柱(60 m×0.25 mm,0.25 μm);初始温度40 ℃,保留2 min,以5 ℃/min的速率升至230 ℃,保留15 min;检测器温度250 ℃;载气He,流速1 mL/min,不分流进样。MS条件:四极杆温度150 ℃;离子源温度230 ℃;接口温度250 ℃;电子电离源;电子能量70 eV;质量扫描范围10~450 u。
定性分析:利用全离子扫描质谱图[28],参考NIST11谱图库资料进行分析,并与文献报道的保留指数(retention index,RI)相比较,或与同条件下该物质的标准品的RI和MS图像比较,以确定某物质。定量分析:利用2-辛醇内标法进行定量。计算如式(1)、(2)所示:
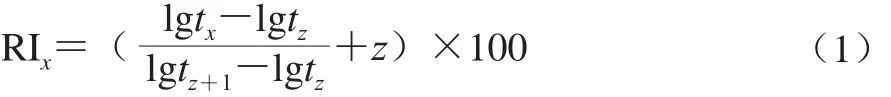
式中:tx为挥发性物质的保留时间/min;tz为与挥发性物质碳原子属相同的正构烷烃的保留时间/min;z为挥发性物质的碳原子数。

式中:wi为挥发性物质含量/(mg/kg);ms为内标物含量/μg;Ai为挥发性物质峰面积;As为内标物的峰面积;m0为发酵酒样品质量/g。
1.4 数据分析
通过测定香气物质的香气活力值(odour active value,OAV)评定发酵酒的关键香气成分。OAV为特定化合物样品气味的重要指标,其数值等于化合物的浓度与水中的嗅觉阈值的比值[29]。
分析OAV大于1的化合物与酵母发酵酒的相关性,采用Unscrambler 9.7进行主成分分析(principal component analysis,PCA),PCA的相关数据进行中心化与标准化(1/Sdev)处理,显著差异水平取P小于0.05[30],模型采用Full Cross-Validation进行校正。
2 结果与分析
2.1 酿酒酵母的分离筛选
从各地的葡萄园土壤样品中经过多次分离纯化,得到16 株菌,其中3 株为霉菌(Mould),3 株为放线菌(Actinomycesbovis),6 株为热带念珠菌(C.tropical),通过对菌株观察和镜检,有4 株初步确定为酵母菌株(图1),以下简称S1、S2、S3、S4。从分离结果可以看出(图1),酵母菌菌落都为圆形,乳白色,其中S2、S3、S4三株菌表面不光滑,S1表面光滑。细胞的生殖方式都为芽殖,S1、S3两株菌具有圆形和椭圆形两种形态,S2、S4只有椭圆形态。
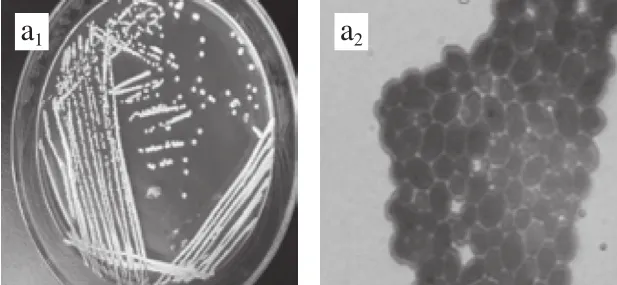
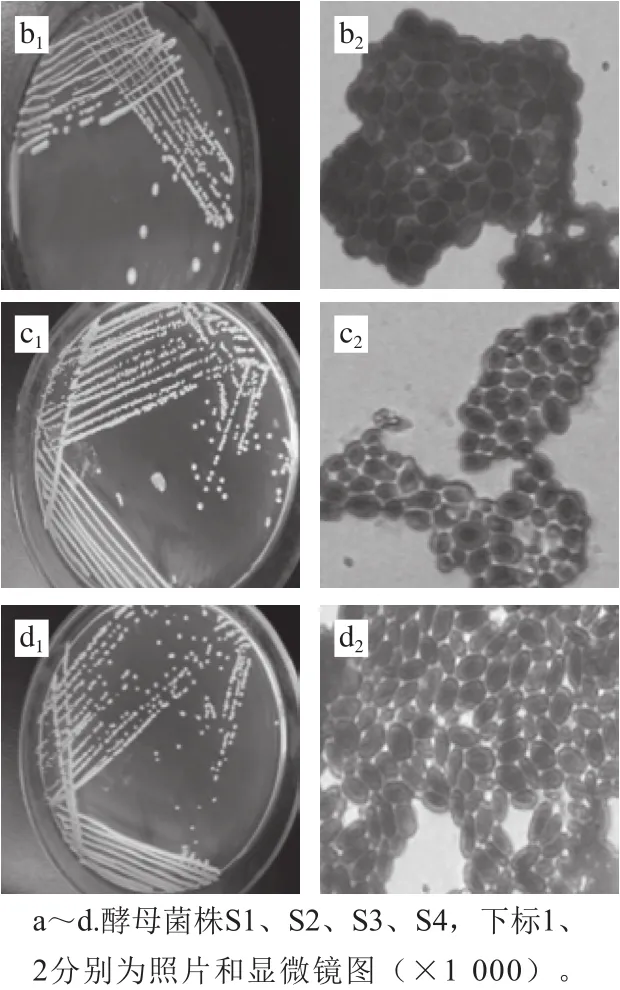
图1 酵母菌株菌落形态及细胞形态Fig.1 Colony and cell morphology of four yeast isolates
2.2 酵母菌属的鉴定结果

图2 S1、S2、S3酵母系统发育树Fig.2 S1, S2, S3 yeast phylogenetic tree
将S1、S2、S3、S4这4 株酵母测序数据在GenBank数据库中进行同源序列搜索匹配(BLAST),建立系统发育树[31]。S1、S2、S3结果如图2所示,菌株S1和酿酒酵母(S. cerevisiae strain S2-39)具有较高的同源性,相似度为99%;菌株S2和酿酒酵母(S. cerevisiae strain NL5)具有较高的同源性,相似度为99%;菌株S3和酿酒酵母(S. cerevisiae strain CTBRL87)具有较高的同源性,相似度为100%。菌株S4结果如图3所示,异常威克汉姆酵母(Wickerhamomyces anomalus culture-collection CBS:262)具有较高的同源性,相似度为100%。结合以上比对结果,将S1、S2、S3三株酵母鉴定为酿酒酵母(S. cerevisiae),将S4鉴定为异常威克汉逊酵母(W. anomalus)。

图3 S4酵母系统发育树Fig.3 Phylogenetic tree of yeast S4
2.3 发酵酒的主要理化指标分析
比较不同的酒样可以看出,不同酵母发酵的葡萄酒各项指标均存在差异(表2),乙醇体积分数从高到底依次为S3>S1>S4>S2>安琪>帝伯仕。残糖量(总糖含量)可以反映酵母对糖的利用能力,在初始糖度相同的情况下,发酵结束后残糖量低,说明酵母对糖的转化利用率高,则发酵能力强[32]。由表2可以看出,总糖含量和总还原糖含量均与乙醇体积分数相对应,表明菌株利用糖类的能力较强,发酵彻底。总酸含量可以判定酵母的产酸能力,酸类物质是酒中的主要呈味物质,其含量对酒的色泽和风味具有一定的影响[33]。6 种酒样总酸含量为S4>S3>S2>安琪>S1>帝伯仕,总挥发酸含量为S1>S4>S2>帝伯仕>S3>安琪,说明菌株产酸水平高于商业酵母。二氧化硫作为抗氧化剂和微生物抑制剂,在葡萄酒发酵过程中发挥着重要的作用[34]。但是过量的二氧化硫会破坏食品中的营养物质,并对人体造成危害[35]。经过检测(表2),发酵酒中总二氧化硫含量均符合GB/T 15038—2006(≤250 mg/L)。
初步估算零层板厚度为250mm,可以作为上部结构嵌固端考虑,因此,上部模型可以将-0.5m定为嵌固端进行结构计算。在确定各主受力构件尺寸之后,可以进行下一步基础设计。
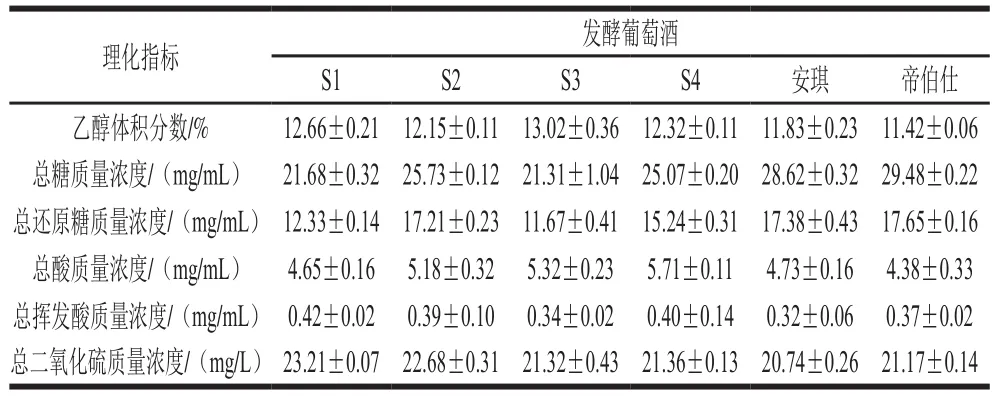
表2 理化指标分析结果Table2 Physical and chemical indicators of wines
2.4 发酵酒挥发性香气成分分析
利用顶空固相微萃取GC-MS联用技术对筛选出的4 种酵母发酵酒进行挥发性成分分析,并用市售安琪酵母和帝伯仕酵母发酵酒作为对比。共检测到45 种共8 大类香气化合物(表3),包括酯类15 种,醇类12 种,萜烯类5 种,醛类5 种,酸类4 种,酮类3 种,酚类2 种。6 种发酵酒中共有的挥发性化合物为:乙酸乙酯、丁酸乙酯、己酸乙酯、辛酸乙酯、乙酸异戊酯、异丁醇、异戊醇、苯乙醇,2,3-丁二醇、2-辛酮等,可鉴定为6 种发酵酒中的主要香气物质,与文彦[36]的研究相符合。

表3 6 种发酵酒的挥发性成分及相对含量Table3 Volatile components and their contents in wines

续表3
由表3可知,S1发酵酒中共检测出33 种挥发性化合物,其中酯类11 种,醇类9 种,酸类4 种,醛类3 种,酮类3 种,烯萜类2 种,酚类1 种,比安琪酵母发酵酒多10 种(十二酸乙酯、十四酸乙酯、十六酸甲酯、十六酸乙酯、苯乙酮、香叶基丙酮、柠檬烯E、β-柏木烯、2-甲基丁醇、2-乙基己醇),比帝伯仕酵母发酵酒多5 种(乙酸异丁酯、十四酸乙酯、十六酸甲酯、壬醛、癸醛)。酯类物质产生于酵母或细菌代谢及葡萄酒陈酿,赋予葡萄酒果香和花香[37],十四酸乙酯具有甜奶油的气味,十六酸乙酯具有水果和香草的气味[38],乙酸异丁酯具有生梨和覆盆子的香气[39]。醛和酮主要是由酸的脱羧和醇的氧化形成[40],香叶基丙酮具有花香和热带水果香的气息[41],壬醛具有瓜香和坚果香,癸醛具有橘皮的香味。
S2发酵酒中共检测出38 种挥发性化合物,为6 种发酵酒中物质种类最多的酒样。其中酯类13种,醇类10 种,酸类4 种,醛类3 种,酮类2 种,烯萜类4 种,酚类2 种,比安琪酵母发酵酒多15种(十二酸乙酯、十四酸乙酯、十六酸甲酯、十六酸乙酯、2-甲基丁醇、2-乙基己醇、壬醛、香叶基丙酮等),比帝伯仕酵母发酵酒多10种(乙酸异丁酯、十四酸乙酯、十六酸甲酯、乙酸苯乙酯、柠檬烯E、β-柏木烯、2,6-二叔丁基对甲酚等)。烯萜类和杂环类物质的含量较低,但对增加葡萄酒风味的丰富性起重要作用[42],柠檬烯E属单萜类化合物,具有类似柠檬的味道[43]。多酚类化合物是葡萄中重要的抗氧化类化合物[44],2,6-二叔丁基对甲酚具有轻度樟脑气味。
相对于商业酵母,S3发酵酒中庚酸乙酯、乙酸异丁酯、乙醇、丙醇、正己醇、乙酸含量明显高于商业酵母,尤其是乙醇含量,居6 种酵母发酵酒之首;S4发酵酒中苯乙醇和乙酸含量明显高于商业酵母,其乙酸含量为6 种发酵酒中最高。
结合以上对比分析可以看出,相对于商业酵母,筛选酵母发酵产生的独有的化合物,尤其是S1和S2发酵酒中,均包括十二酸乙酯、十四酸乙酯、十六酸乙酯、2-甲基丁醇、2-乙基己醇、壬醛、癸醛、柠檬烯E、β-柏木烯等,说明从土壤中筛选的酿酒酵母,发酵鲜食葡萄产生更多以上化合物。
2.5 关键挥发性化合物OAV
仅通过香气物质的种类和相对含量,无法准确鉴定各种化合物对发酵酒香气的贡献大小,因此引入OAV,进一步探究发酵酒中的关键挥发性香气物质。Allen等[45]研究发现OAV大于1的化合物对酒的风味贡献显著,且OAV越大对香气贡献程度越高,但OAV小于1的物质并非对香气不起作用,这些物质往往起协香作用。对GC-MS的检测结果计算OAV,结果如表4所示,共有15 种物质OAV大于1,被认为是发酵酒香气的关键组分,其中8 种物质OAV大于10,5 种物质(丁酸乙酯、己酸乙酯、庚酸乙酯、辛酸乙酯、癸酸乙酯)OAV大于100,2 种物质(丁酸乙酯、癸酸乙酯)OAV大于1 000。这些物质被认为是发酵酒中必不可少的香气物质,且其全部为酯类,说明酯类是发酵葡萄酒中的特征香气物质,与Styger等[46]的研究结果一致。

表4 6 种酵母发酵酒中挥发性物质的OAV(OAV>1)Table4 OAV of volatile substances in six wines (OAV > 1)
2.6 挥发性化合物主成分相关性分析
为进一步明确6 种酵母发酵葡萄汁香气成分的差异,以及香气物质的呈香关系,采用PCA模型对实验结果进行相关性分析。如图4所示,第1象限中,与S1发酵酒香气物质相关的是癸酸乙酯、苯乙醇、辛酸、癸酸,这些物质的香气描述符合花香、玫瑰香、甜水果香等[49],与其在S1发酵酒中OAV较高相对应;第2象限中,对S2发酵酒贡献较大化合物有丁酸乙酯、庚酸乙酯等,这些物质具有葡萄、香蕉、樱桃的果香气味[37],同时在S2发酵酒中具有较高的OAV。以PC1为基准,S1发酵酒明显区别于其他酒样;以PC2为基准,S2明显区别于其他酒样[50],说明S1和S2发酵酒的香气评价最好。S3发酵酒和安琪酵母发酵酒PCA结果接近,同时对两者贡献较大的香气物质有乙酸乙酯(葡萄和樱桃香)、丁酸乙酯(苹果香)、乙酸异戊酯(香蕉香),说明两种发酵酒的果香,尤其是苹果、葡萄以及香蕉的香气比较接近[51]。
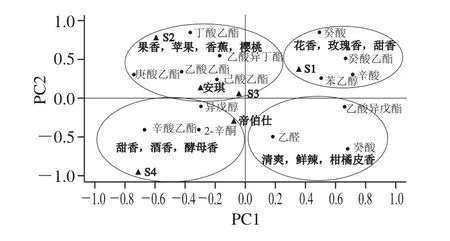
图4 15 种OAV大于1的挥发性化合物对前两个主成分的PCA图Fig.4 PCA of 15 volatile compounds with OAV greater than1 to the fi rst two principal components
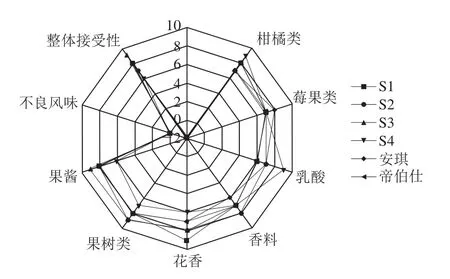
图5 6 种酵母发酵酒香气评价图Fig.5 Radar map of aroma evaluation of6 wines
3 结 论
从上海崇明、浙江绍兴、山东菏泽、武汉4 个地区的葡萄园土壤中成功分离出4 株酵母菌,通过光学显微镜观察对比,并用26S rDNA D1/D2区域序列比对及构建系统发育树分析,结果表明:S1、S2、S3为酿酒酵母,S4
为异常威克汉逊酵母。将4 株酵母对同一种鲜食葡萄醉金香进行发酵,并用市售安琪酵母和帝博仕酵母发酵酒作为对照。对发酵酒的挥发性香气成分使用顶空固相微萃取进行收集,并结合GC-MS联用仪进行分析,共检测到45 种共8 大类香气成分,包括醇类12 种,酯类15 种,烯萜类5 种,醛类5 种,酸类4 种,酮类4 种,酚类2 种。相对于商业酵母发酵酒,S1发酵酒能够产生更高含量的辛酸乙酯、癸酸乙酯、十二酸乙酯,S2发酵酒中癸酸乙酯、苯乙醇、辛酸、癸酸、香叶基丙酮、2,6-二叔丁基对甲酚、4-乙烯基-2-甲氧基苯酚含量较高,S3发酵酒具有高的乙酸乙酯含量和乙醇含量,S4发酵酒具有更高的乙酸含量。本实验探究了筛选酵母和商业酵母在发酵鲜食葡萄醉金香产香方面的差异,为今后筛选鲜食葡萄发酵酵母的方向作出了展望,也为对鲜食葡萄的基因改良提供了方向。
