苦荞芦丁水解酶序列鉴定及在昆虫系统中的表达
2018-07-24崔晓东王转花
杜 程,崔晓东,王转花,2,*
(1.山西大学生物技术研究所,化学生物学与分子工程教育部重点实验室,山西 太原 030006;2.山西大学生命科学学院,山西 太原 030006)
槲皮素是人类膳食中常见的黄酮类化合物之一,属于黄酮化合物中的黄酮醇。研究表明,槲皮素具有多种生物活性,如抗肿瘤、抗炎症、抗病毒、抗自由基以及保护血管等[1]。在植物中,槲皮素大多以其糖苷的形式存在,如芦丁、异槲皮素等。在荞麦,尤其是苦荞麦(Fagopyrum tartaricum L. Gaerth)中含有丰富黄酮类化合物,其含量比普通荞麦(F. esculentum Moench)高10~100 倍[2]。芦丁是荞麦中黄酮类化合物的主要存在形式,具有降低毛细血管脆性、保持及恢复毛细血管正常弹性等功能,可以辅助治疗高血压,糖尿病等疾病[3]。因此荞麦也成为当下最受欢迎的保健食品研发的原材料。
荞麦中存在高活性的芦丁水解酶(rutin-hydrolyzing enzyme,RHE),也叫做芦丁降解酶,该酶可将芦丁脱去芸香糖苷水解为槲皮素,然后在黄酮醇氧化酶等的作用下,被进一步降解[4]。RHE负责这一过程的起始反应,因此RHE调控荞麦中芦丁和槲皮素的含量以及二者的比例。目前,国内外不同的课题组已经从荞麦中提取出RHE,并对其催化性质、底物特异性等进行了一定的研究。Yasuda等[5-6]首次从苦荞籽粒中分离出两种分子质量约为70 kDa的RHE同工酶,其最适pH值都在5.0左右,当以芦丁为底物时,Km分别为0.13 mol/L和0.12 mol/L,后续研究发现体积分数20%的水溶性溶剂如乙醇、二甲基亚砜(dimethyl sulfoxide,DMSO)可提高RHE活性。Baumgertel等[7]从荞麦茎秆中提取出分子质量分别为74.5、85.3 kDa黄酮醇3-O-β-异二糖苷酶(flavonol-3-O-βheterodisaccharide glycosidase,FHG)同工酶,其中FHGI的Km值为0.561 mmol/L(以芦丁为底物),并对其底物的特异性进行研究。徐宝才等[8]研究发现RHE在20%乙醇溶液中活性最高。王改玲[9]从苦荞籽粒中分离出RHE粗品,并证明是一种高活性天然β-糖苷酶,体积分数高于40%的乙醇溶液对其有明显的抑制作用。陈芳霞[10]研究发现RHE在10%~40%的甲醇溶液中活性变化不明显,50%的甲醇溶液使其活性降低。张玉玮等[11]从苦荞籽粒中分离出一种分子质量为66 kDa的RHE,并研究催化体系对酶活的影响,发现50%或更高体积分数的甲醇对RHE具有明显抑制作用,并对其氨基酸序列进行了解析,但并未得到完整的氨基酸序列。唐宇等[12]也从野生金荞麦籽粒中纯化出60 kDa的RHE,最适pH值为5.0,最适温度为40 ℃。本课题组之前从苦荞麦籽粒中纯化RHE,其最适反应体系为醋酸铵缓冲液(20 mmol/L,pH 5.0),20%乙醇溶液溶解底物芦丁可保留RHE活性不被抑制,最适反应温度为40 ℃,其最适的pH值为5.0,与唐宇[12]和Bourbouze[13]等纯化的RHE最适pH值基本一致,铜离子对RHE有显著抑制作用[14-15]。根据前期的文献报道,从不同荞麦品种中或不同的荞麦部位获得的RHE,其性质存在差异(尤其是分子质量),这可能都源于荞麦中的RHE存在多种同工酶[16]。
在食品加工过程中,以荞麦尤其是苦荞麦为原料制备的食品存在一定的苦涩味,严重影响口感,降低了荞麦的利用价值[17]。芦丁被RHE水解产生的槲皮素是其苦涩味产生的主要原因[17]。因此,若将苦荞麦中芦丁水解酶基因(Fagopyrum tartaricum rutin-hydrolyzing enzyme gene,FtRHE)敲除,则有可能获得无苦涩味的荞麦,更加有利于荞麦的利用及推广。尽管国内外在RHE的性质、底物特异性等方面已经做了一定的研究,但是迄今为止还鲜见RHE的DNA序列的报道。目前,昆虫细胞表达异源蛋白是生物化学、生物物理和结构研究中制备复杂植物蛋白和哺乳动物蛋白的主要方法之一[18-19]。该表达系统具有真核表达系统的传统优势,兼具原核表达系统高效表达外源蛋白的能力,同时具备比较完善的翻译后加工修饰等功能[20],因此利用该系统表达的重组蛋白具有良好的可溶性,其生物学活性、免疫原性、结构与功能等与天然蛋白极其相近[21]。本研究在前期工作的基础上,利用基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionization-time of flight mass spectrometry,MALDI-TOF MS)分析RHE的肽指纹图谱(peptide mapping fingerprint,PMF),解析特征肽序列,并结合苦荞麦籽粒转录组数据,得到FtRHE,之后利用序列分析软件,对其结构特征进行预测,并利用昆虫表达系统成功表达了该蛋白,证实获得的基因为RHE基因。本研究将为深入研究RHE的生物学功能以及利用该酶进行黄酮类物质的生物转化提供理论支持,并且也为培育高芦丁含量且无苦涩味的荞麦品种提供了候选基因。
1 材料与方法
1.1 材料与试剂
苦荞籽粒,云荞1号,由云南农业科学院生物技术与种质资源研究所提供,保存于4 ℃冰箱中。
芦丁、槲皮素、DNA Marker S Plus 英国BBI Life Sciences公司;Protein mwMarker、Taq DNA聚合酶、TurboFect转染试剂 美国Thermo公司;pGEM-T-Easy质粒 美国Promega公司;限制性内切酶BamHI、NotI加拿大Fermentas公司;SanPrep柱式质粒DNA小量抽提试剂盒 生工生物工程(上海)股份有限公司;HiPrepTM26/10脱盐柱、HiTrap DEAE FF(5 mL)离子交换柱、SuperdexTMG75 10/300凝胶柱 美国GE公司;SIM SF昆虫细胞培养基 中国Sino Biologica公司;甲醇为色谱纯,其他试剂均为分析纯。
1.2 仪器与设备
AKTATMExplore蛋白纯化系统 美国GE公司;Gene Genius Bio Imaging System 美国Syngene公司;PAC200电泳仪 美国Bio-Rad公司;Mighty Small SE-245型电泳槽 瑞典Amersham Pharmacia Biotech公司;立式高速冷冻离心机 日本三洋公司;酸度计德国WTW公司;3100高效液相色谱(high performance liquid chromatography,HPLC)仪、Supersil ODS2柱 中国大连依利特分析仪器有限公司。
1.3 方法
1.3.1 RHE的制备
天然RHE的制备参照实验室之前建立的方法执行[12-13]。
1.3.2 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)分析
用SDS-PAGE检测经离子交换层析和分子排阻层析分离获得的RHE。12.5%分离胶,4%浓缩胶,低分子质量蛋白为标准,用考马斯亮蓝R-250染色,确定RHE的分子质量及纯度。电泳结果采用Gene Genius Bio Imaging System拍照进行分析。
1.3.3 MALDI-TOF MS鉴定天然RHE
用洁净刀片从SDS-PAGE胶上切下RHE条带,将胶条进一步切碎放入Eppendorf管中,每管加入300 μL 100 mmol/L NH4HCO3-30%乙腈脱色。冷冻干燥后,加入5 μL5 mg/mL测序级胰蛋白酶溶液,37 ℃反应过夜,20 h左右。吸出酶解液,转移至新EP管中,原管加入100 μL 60%硝酸铈铵-0.1%三氟乙酰丙酮,超声15 min,合并前次溶液,冻干。加适量20%乙腈溶液复溶,取1 μL样品,点于样品靶上(384 Opti-TOF 123 mm×81 mm ss ABI),让溶剂自然干燥,取0.5 µL过饱和CHCA基质溶液(溶剂为50%乙腈-0.1%三氟乙酰丙酮)点至对应靶位上并自然干燥,然后在4800 Plus MALDI-TOF MS进行分析。质谱条件激光源为355 nm波长的Nd:YAG激光器,加速电压为2 kV,采用正离子模式和自动获取数据的模式采集数据,PMF质量扫描范围为800~4 000 Da,选择信噪比大于50的母离子进行二级质谱分析,每个样品点上选择8 个母离子,二级质谱激光激发2 500 次,碰撞能量2 kV,碰撞诱导解离关闭。质谱资料提交MASCOT搜索引擎进行分析(http://www.matrixscience.com)。
1.3.4 RHE基因克隆
在建立的荞麦未成熟种子转录组数据库中,利用关键词β-glycosidase进行搜索,找出相关基因序列。结合MALDI-TOF MS鉴定的特征肽,与找出的相关基因翻译的氨基酸序列进行比对,确定用于聚合酶链式反应(polymerase chain reaction,PCR)扩增FtRHE的引物。上游序列为:5’-CAAAACCATGGCTACTTTTACATCA ATGT-3’,下游序列为5’-ACATTAGTCATGCATCCATG ACTGGATCT-3’,扩增条件为:94 ℃、3 min;94 ℃、1 min,57 ℃、30 s,72 ℃、2 min,共计30 个循环;72 ℃延伸10 min。PCR产物经过1%琼脂糖凝胶电泳检测。回收PCR产物连接到pGEM-T-Easy载体,挑取单克隆培养后进行测序。
1.3.5 RHE结构序列分析
在测序结果中,寻找开放阅读框。然后采用NCBI在线比对(BLAST)(http://blast.ncbi.nlm.gov/Blast.cgi),对FtRHE基因编码的蛋白序列及其蛋白数据库进行比对并下载同源性较高的序列;通过Signal P(http://www.cbs.dtu.dk/sercices/SignalP/)进行信号肽预测。应用ClustalW程序(http://www.ebi.ac.uk/clustalw/)进行氨基酸的多重序列比对。
1.3.6 RHE在昆虫系统的表达
以含有FtRHE基因的pGEM-T-FtRHE为模板,引物GGATCCATGTCGTACTACCATCACCATCACCATC ACGATTACGATATCCCAACGACCATGGCTACTTT TACATCAATGTCCTTCA和ACATTAGGCGGCCGCT CATTATGCATCCATGACTGGATCT进行PCR扩增。扩增得到的PCR产物与pGEM-T载体连接后转化大肠杆菌DH5α感受态细胞,经蓝白斑筛选,酶切,测序验证后,保存菌种。将保存的菌种扩大培养后提取质粒,质粒经BamHI和NotI酶切后与同样经BamHI和NotI酶切后的pFastBac Dual载体相连。将重组的pFastBac Dual-FtRHE(测序验证正确)质粒转化感受态DH10Bac,涂板于含卡那霉素(kanamycin,Kana)/庆大霉素(gentamicin,Gen)/四环素(tetracyclines,Tet)的固体培养基,采用蓝白斑筛选法挑取含有重组Bacmid的白色菌落。摇菌扩大培养后,离心收集菌体,采用SanPrep柱式质粒DNA小量抽提试剂盒提取质粒。用Invitrogen Bac-to-Bac杆状病毒表达系统技术手册推荐的引物PUCf正向引物5’-CCCAGTCACGACGTTGTAAAACG-3’和PUCr反向引物5’-AGCGGATAACAATTTCACACAGG-3’对重组的Bacmid进行PCR验证。选取白色菌落再次涂布于新的Tet/Gen/Kana/LB/X-Gal/IPTG平板上继续培养,如此筛选3 代依然为白色菌落的可视为转座完全。将含有重组克隆的菌液离心得到菌体沉淀,采用质粒抽提试剂盒提取杆粒,经PCR验证等确认重组杆粒中含有目的基因FtRHE。
提取杆粒转染昆虫细胞Sf9,生产重组杆状病毒。首先转染Sf9细胞处于对数期(2×106个/mL),且存活率高于95%,每孔中(6 孔板)加入1 mL细胞,在28 ℃过夜培养,使细胞完全贴壁。取8 µL TurboFect转染试剂稀释于100 µL不含抗生素的昆虫培养基中,短暂涡旋混匀。取1 µg杆状病毒DNA稀释于100 µL不含抗生素的培养基中,轻轻混匀。将稀释后的DNA与稀释的TurboFect转染试剂混合,轻轻混匀并在室温下孵育20 min。逐滴加上述DNA-脂质体混合物到已贴壁的细胞中。28 ℃孵育细胞4~5 h后加入600 µL昆虫培养基。28 ℃孵育细胞72 h,直至观察到绿色荧光(pFast Bac Dual载体由本实验室插入一个EGFP荧光基因)。1 000×g离心,去除细胞碎片等,收集上清液,即为第1代病毒P1。用P1病毒,继续感染Sf9细胞,制备P2及P3病毒储液。确定P3病毒滴度后,进一步感染Sf9细胞,大概48~72 h后收集上清液,得到含有重组RHE的蛋白粗品[22]。
1.3.7 重组RHE的纯化
收集P3病毒感染Sf9细胞后的上清液,1 000×g离心去除细胞碎片等,得到重组荞麦RHE粗品。按照每4 mL上清液加200 µL 50% Ni-NTA的比例加入Ni-NTA,200 r/min振荡1 h;静置除去上清液,再加入清洗缓冲液,温柔混匀清洗缓冲液和Ni-NTA,静置弃去上清液,重复上述步骤2次;加入100 µL的洗脱缓冲液,温柔混匀洗脱缓冲液和Ni-NTA,收集上清液,重复上述步骤2 次,合并3 次得到的上清液,得到纯化的重组RHE。收集洗脱峰,SDS-PAGE分析。得到的蛋白经脱盐处理后,冷冻干燥,-80 ℃冰箱保存备用。清洗缓冲液为:20 mmol/L Tris-HCl,0.5 mol/L NaCl,10 mmol/L咪唑,pH 7.6。洗脱缓冲液为:20 mmol/L Tris-HCl,0.5 mol/L NaCl,500 mmol/L咪唑,pH 7.6[23]。
1.3.8 重组RHE活性鉴定
为检测重组RHE是否具有活性,采用其天然底物芦丁,在下述反应体系中进行活性测定:醋酸铵缓冲液(20 mmol/L,pH 5.0)700 µL,加入芦丁溶液200 µL(10 mg/mL,溶于乙醇溶液)和纯化RHE 100 µL(100 µg/mL),空白对照加100 µL水,在37 ℃水浴保温30 min,反应体系颜色加深,有沉淀析出。12 000 r/min离心收集沉淀,甲醇溶解沉淀。将反应后上清液及溶解后沉淀分别通过HPLC分析。HPLC流动相为甲醇-0.4%磷酸(1∶1,V/V),流速1 mL/min,检测波长254 nm[24-25]。采用双倒数作图法测定RHE的Km值。分别在1.6、3.2、4.8、6.4、8.0 mmol/L和9.6 mmol/L的底物浓度条件下(底物溶于80 mmol/L、pH 5.0的醋酸铵缓冲液,20%甲醇)测定天然及重组RHE的活性,每测定设置3 次重复[11]。
1.4 数据处理及图像处理
采用Origin Pro 8.5、Microsoft Office Excel 2003、Photoshop进行数据处理。采用Photoshop对蛋白胶以及核酸胶图进行图像处理。
2 结果与分析
2.1 天然RHE制备
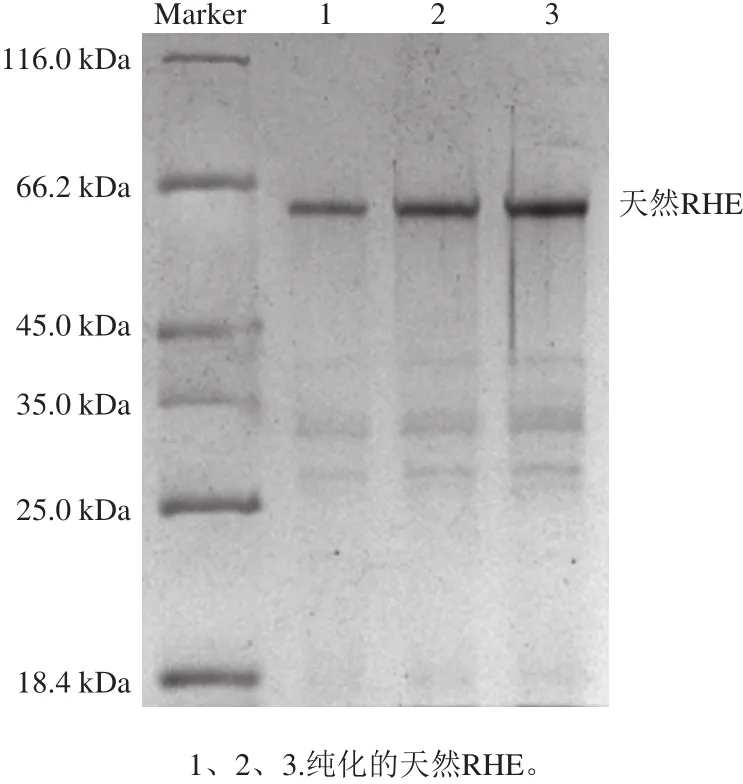
图1 天然RHE的SDS-PAGE分析Fig.1 SDS-PAGE analysis of RHE
RHE在荞麦中存在多种同工酶[16],从不同种质的荞麦得到的RHE在分子质量大小、催化性质等方面也不同。因此,本研究在天然RHE制备、转录组分析、RNA提取、RHE基因克隆等实验,均采用云荞1号苦荞进行实验。按照之前建立的纯化方法,成功纯化了该蛋白,SDS-PAGE分析显示,分子质量约为62 kDa(图1)。纯化的天然RHE与唐宇等[12]从野生金荞麦籽粒中纯化的RHE分子质量相当。经活性测定,纯化的蛋白可以将天然底物芦丁脱去芸香糖苷,转化为槲皮素,转化率达到95%以上。表明纯化的蛋白具有RHE活性,可以用来进行后续的分析鉴定实验。
2.2 RHE的鉴定
纯化的天然RHE,经SDS-PAGE分离后,考马斯亮蓝染色,20%乙醇溶液完全脱色后,切下条带,然后送至生工生物工程(上海)股份有限公司进行MALDI-TOF MS分析,得到其肽指纹图谱。经在线软件MASCOT分析比对,RHE属于一种β-葡萄糖苷酶。PMF质荷比为914.428 6肽段获得的内肽序列为FSISWSR,这一肽段在很多的糖苷酶中均被发现,说明该肽段在糖苷酶中都非常保守。此外,质荷比为2 712.133 1的肽段ALDFMFGWFANPITFGDYPESMR被鉴定与大豆中氰苷水解酶(gi/356557126)的序列一致。质荷比为1 751.715 7的肽段IANGTTGDVADDFYHR被鉴定为与菠萝中β-葡萄糖苷酶(OAY80832.1)序列一致[26]。这些鉴定结果表明,RHE为一种β-葡萄糖苷酶。
2.3 FtRHE基因的克隆
在云荞1号幼嫩种子的转录组数据库中用β-glucosidase搜索得到DNA序列,找到开放阅读框。将DNA序列翻译为氨基酸序列,将翻译得到的氨基酸序列与MALDI-TOF MS鉴定的多肽序列进行比对,确定对应的DNA序列,并以此序列为模版设计引物,扩增FtRHE基因。经PCR扩增,获得了分子质量约为1 600 bp的条带(图2),并将该条带回收,与pGEM-T-Easy载体连接,经测序确定其基因序列。结果显示,该基因开放阅读框由1 539 bp碱基组成,编码512 个氨基酸,预测的分子质量约为57.88 kDa。该基因已在GenBank数据库登录,登录号为2055990。
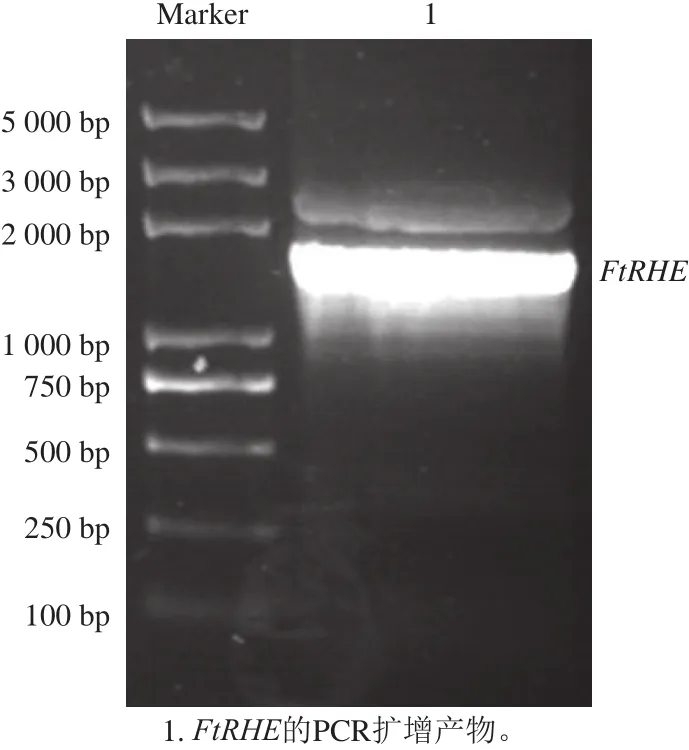
图2 FtRHE基因的PCR扩增电泳图Fig.2 Electrophoresis of PCR amplif i ed products of FtRHE gene
2.4 FtRHE序列分析
利用NCBI的BLASTP程序进行蛋白质保守区预测表明,FtRHE编码的RHE属于Glyco_hydro_1 superfamily成员(糖苷水解酶家族1成员,图3A)。这一结果与肽质量指纹图谱鉴定的结果一致。软件SignalP 4.1预测结果显示,FtRHE基因编码的蛋白N端存在信号肽编码区,1~25位氨基酸的平均信号肽得分为0.811,高于0.45阈值,表明1~25位氨基酸可能为其信号肽(图3B)。同时预测结果也显示29位天冬氨酸和30位苏氨酸的之间的断裂位点得分也较高,也是潜在的信号肽断裂位点(图3B)。信号肽后TLTRNSFPEGFVFGAGS序列文献报道的RHE的N端序列TVSRSSFPDGFLFGL同源性更高[11],因此1~29位氨基酸更有可能为其信号肽。将苦荞麦中的RHE与GenBank中选取的其他物种来源,且功能明确的β-葡萄糖苷酶,用Clustal W对其进行多重序列比对,发现该基因在各物种间的保守性不是特别高,相似性普遍集中在54%~62%之间。如图4所示,不同来源的β-葡萄糖苷酶其信号肽序列保守性都比较差,其他氨基酸序列的保守性相对较高。多肽序列FSISWSR在不同来源的β-葡萄糖苷酶序列都完全一致。经MALDITOF MS鉴定的ALDFMFGWFANPITFGDYPESMR和IANGTTGDVADDFYHR在不同来源的β-葡萄糖苷酶中序列保守性也较高。但是这两个肽段在FtRHE基因编码的氨基酸序列中也不完全一致,可能是荞麦中存在多种同工酶所致。
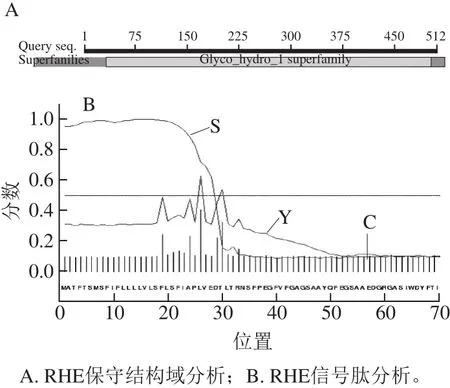
图3 RHE保守结构域及信号肽分析Fig.3 Conservative structure domain and signal peptide analysis of RHE

图4 RHE与其他植物来源β-糖苷酶多重序列比对Fig.4 Multiple sequence alignment analysis of RHE and β-glycosidases from other plants
2.5 FtRHE基因在昆虫系统中的表达
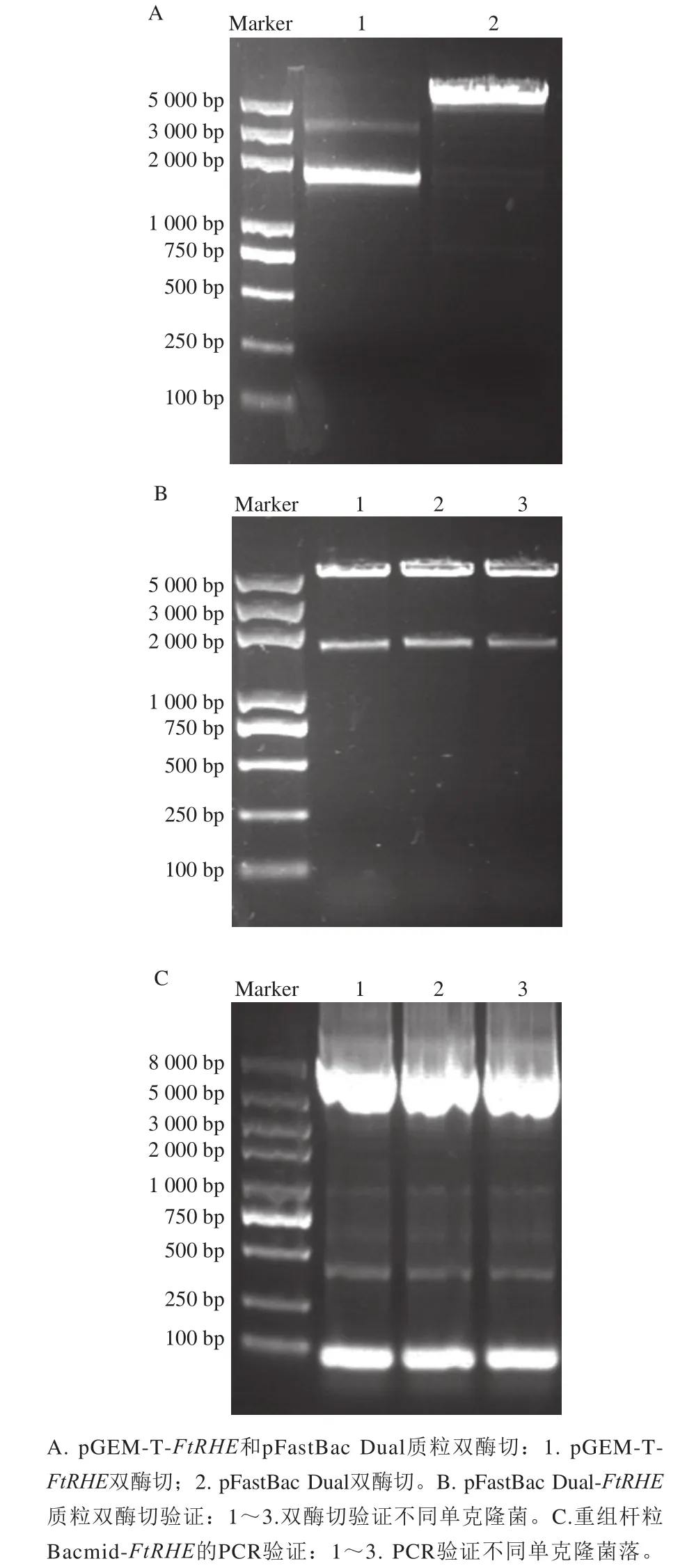
图5 重组杆粒Bacmid-FtRHE构建Fig.5 Construction of recombination bar-Bacmid-FtRHE
为验证获得的FtRHE基因编码的蛋白是否具有RHE活性,构建昆虫表达系统,获得重组RHE。图5A、B为构建的pFastBac Dual-FtRHE酶切验证,将验证正确的质粒转化感受态DH10Bac,转座得到含有FtRHE的Bacmid质粒(图5C),用Invitrogen Bac-to-Bac杆状病毒表达系统推荐的引物PCR验证正确。P3病毒感染培养摇瓶培养的Sf9细胞后,离心收集上清液,获得重组RHE粗品。SDS-PAGE结果显示,重组RHE主要存在于P3代感染细胞后的上清液中,而裂解的Sf9细胞中基本未见重组RHE的表达,说明重组RHE的主要以分泌形式在胞外表达(图6A)。经Ni-NTA纯化后,获得了纯的重组RHE,SDS-PAGE分析结果显示,rRHE的分子质量约为66 kDa(图6B),比其理论值稍大,可能是昆虫表达系统产生的重组RHE与天然RHE一样存在糖基化修饰所致[27-28]。

图6 重组RHE的表达与纯化Fig.6 Expression and purif i cation of recombinant RHE
2.6 重组RHE活性测定结果
按照先前确定的反应体系及反应条件进行重组RHE活性测定。在37 ℃水浴反应30 min后,反应体系颜色加深,有黄色小颗粒物析出。说明重组RHE将芦丁水解产生不溶于稀醇(20%乙醇溶液)的槲皮素。离心收集沉淀,重新溶解于乙醇溶液,进行HPLC分析。从图7A可见,芦丁和槲皮素标准品保留时间分别为7.206 min和17.005 min,而图7B、C中的保留时间表明,重组RHE可以将芦丁特异性地水解为槲皮素。测定重组RHE在不同底物浓度条件下的反应速率,根据Lineweaver-Burk双倒数作图法计算其Km为0.49 mmol/L,同时测定天然RHE的Km为0.74 mmol/L。酶学活性测定结果表明,FtRHE基因编码的蛋白确实具有RHE活性,FtRHE即为苦荞麦中RHE的同源基因之一。
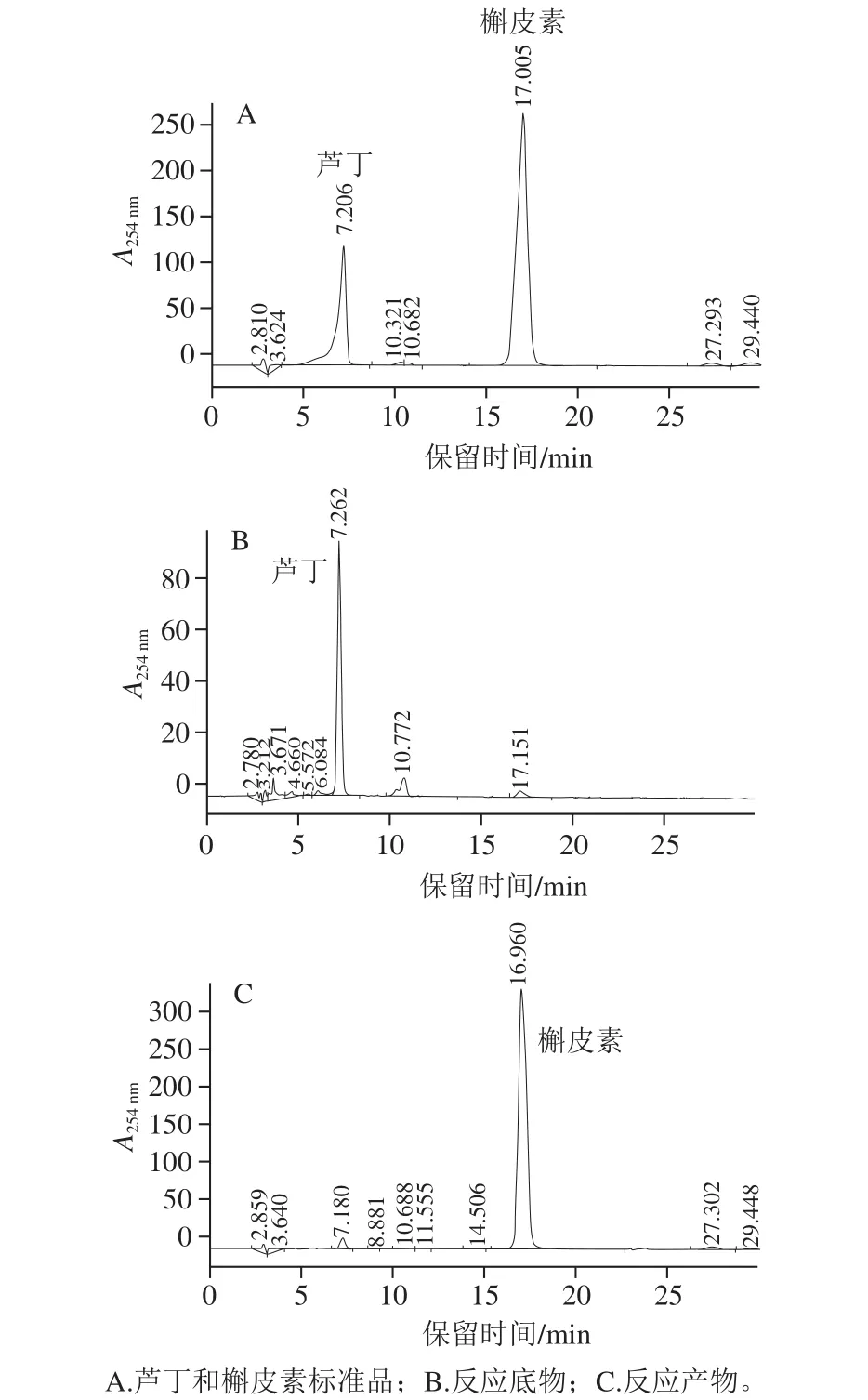
图7 HPLC鉴定RHE水解产物Fig.7 Identif i cation of rutin hydrolysate by HPLC
3 讨 论
以云荞1号苦荞种子为材料,成功获得了苦荞麦中RHE基因FtRHE。FtRHE的开放阅读框由1 539 bp组成,编码512 个氨基酸,属于一种β-葡萄糖苷酶,重组的蛋白可以特异水解芦丁为槲皮素。在之前的研究中也发现,天然RHE不仅仅具有RHE活性,同时还是一种甘露糖结合凝集素,对人O型血红细胞具有特异性凝集作用,因此也曾把RHE命名为苦荞麦凝集素(tartary buckwheat lectin,TBL)[29]。同时TBL具有N-糖苷酶活性,对结直肠癌具细胞具有特异的抑制作用,其机制可能为通过调控microRNA的表达进而抑制细胞增殖[30]。TBL(天然RHE)存在糖基化修饰,根据硫酸-苯酚法,测得TBL含糖量为5.8%,即TBL或天然RHE去除糖链后的分子质量约为58.4 kDa(62 kDa×(1-5.8%)),这一结果与本研究中由FtRHE基因预测的分子质量(57.88 kDa)基本相符。但是研究还不清楚糖基化修饰是否对RHE发挥水解芦丁活性有影响,为得到具有糖基化修饰的重组RHE,本研究采用昆虫表达系统来表达重组RHE,得到了与天然RHE性质相似且具有芦丁水解活性的重组RHE,最终确定获得的FtRHE基因即为荞麦中RHE基因。重组RHE的Km值为0.49 mmol/L,这与已报道的RHE Km都很接近,但分子质量大小差别较大,很可能是由于存在多种RHE的同工酶。如Cui Xiaodong等[14]从Shouyang苦荞种子中纯化得到的70 kDa的RHE的Km值为1.03 mmol/L;Baumgertel等[7]从荞麦茎秆中提取的74.5 kDa的黄酮醇3-O-β-异二糖苷酶,当以芦丁为底物时,Km值0.561 mmol/L;张玉玮等[11]从苦荞籽粒中纯化得到的66 kDa的RHE,其Km为0.27 mmol/L。因此,RHE基因的获得将为高芦丁含量荞麦无苦涩味荞麦的育种提供候选基因。同时,通过基因工程的方法获得重组RHE,也可为酶法水解芦丁制备槲皮素的提供特异性酶。
