SOD 的稳定性及修饰的研究
2018-07-23程杨战虎庞泉
程杨,战虎,庞泉
(1.天津科技大学食品工程与生物技术学院,天津300457;2.天津市食品研究所有限公司,天津301609;3.天津市食品安全检测技术研究院,天津300308)
SOD是超氧化物歧化酶(super oxide dismutase)的英文缩写,又名为肝蛋白,是一种源自生命体的活性物质[1]。SOD属于金属酶范畴,按其结合的金属离子来区分可分为三类:第一类含有铜和锌,称为Cu、Zn-SOD,也是最常见的一种,颜色呈蓝绿色,主要存在于真核生物细胞中。第二类含有锰,故称为Mn-SOD,颜色呈粉红色,主要存在于原核生物和真核生物的线粒体中。第三类含有铁,称为Fe-SOD,颜色呈黄褐色,主要存在于原核生物及某些植物叶绿体中[2]。
由于超氧化物歧化酶广泛存在于各类生物体中,能使生物体内超氧自由基(O2-·)发生歧化反应,成为生物体内O2-·的天然消除剂,可对生物体细胞起到保护作用。因此,SOD在帮助生物体防御O2-·的毒性、抗衰老、消炎甚至预防肿瘤等方面起着重要的生理作用。这使得SOD近年来被广泛应用到日用品,食品,医疗等方面。在我国,关于SOD研究应用的深度和广度已居酶类生化制剂的首位[3-4]。
随着对SOD的深入研究,如今SOD的提取来源也相当丰富,目前比较常见的是从植物中、微生物中、动物源性食品中提取SOD。本研究对木瓜、酵母菌、牛奶中提取到的SOD进行了稳定性考察并对SOD粗提物进行修饰。
1 材料和方法
1.1 材料与主要试剂
新鲜牛奶:天津市海河乳业有限公司;木瓜(湖北常阳产):市售;酵母菌:天津市啤酒厂;三羟甲基氨基甲烷(Tris):美国sigma公司;盐酸:天津市风船化学试剂科技有限公司;无水乙醇、磷酸二氢钾:天津市化学试剂一厂;三氯甲烷、异丙醇、丙酮:天津市北方天医化学试剂厂;月桂酸:天津市永大化学试剂有限公司;氯化亚砜:天津市天新精细化工开发中心;小牛血清蛋白:罗氏制药有限公司;戊二醛:中国医药集团;壳聚糖:南凯博化工产品有限公司;甘氨酸:河北华阳生物科技有限公司;邻苯三酚:天津市津东天正精细化学试剂厂,以上试剂均为分析纯;实验用水为二级实验水。
1.2 设备与主要仪器
GL-20G-Ⅱ型高速冷冻离心机:上海安亭科学仪器厂;TU-1810紫外-可见分光光度计:北京普析通用仪器有限责任公司;PHS-3C型pH计:上海雷磁仪器厂;FW100高速万能粉碎机:天津市泰斯特仪器有限公司;AB265-S型电子分析天平:梅特勒-托利多仪器(上海)有限公司。
1.3 方法
1.3.1 不同原料中SOD的提取工艺
1.3.1.1 牛奶中SOD的提取工艺[5]
新鲜牛奶→加入无水乙醇→一次提取→离心分离→二次提取→离心分离上清液浓缩→冷冻干燥→粗酶液。
1.3.1.2 木瓜中SOD的提取工艺[6]
称取新鲜木瓜→用粉碎机打碎→加入0.1 mol/L pH 7.8的磷酸缓冲液搅拌均匀浸提2 h→离心→向提取液中加入三氯甲烷-氯仿充分混匀→粗酶液。
1.3.1.3 酵母菌中SOD的提取工艺[7]
向酵母泥加入异丙醇浸泡2 h→抽滤出异丙醇→加入50 mmol/L pH 7.0的磷酸钾缓冲液搅拌后静置2 h→离心后除去菌体→用HCl调节pH值→加入丙酮萃取→粗酶液。
1.3.2 SOD酶活力测定方法[8]
A液的配置:pH8.20的0.1 mol/L三羟甲基氨基甲烷(Tris)-盐酸缓冲溶液(内含 1 mmol/L EDTA·2Na)。称取1.211 4 g Tris和37.2 mg EDTA·2Na溶于62.4 mL 0.1 mol/L盐酸溶液中,用蒸馏水定容至100 mL。
B液的配置:4.5 mmol/L邻苯三酚盐酸溶液。称取邻苯三酚(A.R)56.7 mg溶于少量10 mmol/L盐酸溶液,并定容至100 mL。
称取0.089 6 g(精确到0.000 1 g)修饰后的SOD提取物,将其用蒸馏水稀释至10 mL,在离心机中于4 000 r/min离心。取离心后的上清液1.0 mL用蒸馏水定容到250 mL,备用。
在紫外-可见分光光度计上于320 nm下测定空白试剂1 min后的吸光变化值,记做△A320(min-1)。空白试剂的△A320(min-1)应为0.060左右。本试验测得空白试剂的A320为0.0894,1分钟后的A320为0.1502,则空白试剂的△A320(min-1)为0.060 8,满足试验要求,可继续测定样品。
1.3.3 SOD蛋白的修饰方法
为了增强SOD的稳定性,本研究选择3种不同的修饰剂对所提取的3种SOD进行修饰,通过测定修饰后SOD剩余酶活性来确定修饰率,最终选择出3种SOD合适的修饰方法[8]。修饰剂分别为月桂酸、牛血清白蛋白、壳聚糖。
1.3.3.1 月桂酸修饰SOD方法
在通风橱内安装回流装置,使月桂酸和氯化亚砜在75℃的水浴锅中反应2 h,后在90℃~95℃水浴中反应2 h。将反应物分馏、减压,除去过量的氯化亚砜,收集146℃~150℃馏分物月桂酰氯。
准确称取SOD冻干粉0.5 g,溶于pH8.0的0.002 mol/L磷酸盐缓冲液中。缓慢加入上述馏分物月桂酰氯,同时,加入0.1 mol/L NaOH溶液维持pH值,立即将水浴升温至42℃搅拌1 h,收集。冷却后加入1倍体积的冷丙酮,离心后收集沉淀物并将其溶于适量蒸馏水中,再次离心,取上清液,透析后冻干,即得月桂酸-SOD。
1.3.3.2 牛血清白蛋白修饰SOD方法
准确称取SOD冻干粉0.5g,溶于pH8.0、0.005 mol/L的磷酸缓冲溶液中。称取牛血清白蛋白0.5 g与SOD冻干粉混合均匀,置于冰浴中,缓慢加入25%戊二醛,放置1 h,加入甘氨酸20 mg使反应中止。透析冻干即得牛血清白蛋白修饰SOD。
1.3.3.3 壳聚糖修饰SOD的方法
将0.08 g纳米磁性Fe3O4加入100 mL去离子水中超声,再加入10 mL 0.75 mol/mL的NaOH溶液,充分搅拌;将0.16 g壳聚糖加入到质量分数为1%的醋酸溶液使壳聚糖溶解,再将壳聚糖溶液滴加到上述Fe3O4的NaOH溶液中。
称取0.2 g制备后的壳聚糖,用0.1 mol/L pH 7.8的磷酸盐缓冲液溶胀。将0.1 g的SOD冻干粉和0.2 g溶胀的壳聚糖加入到40 mLpH=7.5磷酸盐缓冲液中,并滴加质量分数为25%的戊二醛0.2 mL,在恒温摇床中于20℃振荡120 min,用磁铁将固定化的SOD沉淀,倾出上清液,即得壳聚糖修饰的SOD[9]。
2 结果与分析
2.1 考察不同原料中提取的SOD的稳定性
对上述3种原料中提取的SOD的稳定性进行了考察,主要考察pH值稳定性、不同温度下的稳定性、外源性试剂稳定性3个方面。
2.1.1 pH值稳定性
将 SOD 酶分别置于 pH3、4.5、6、7.5、9、10.5、12 不同的pH值下,分别于60 min后测定它们的酶活力。pH值稳定性见图1。

图1 3种不同来源SOD的pH值稳定性Fig.1 pH stability of three SOD
通过考察,pH7~8之间时3种SOD活力保存良好,3种SOD蛋白的活力残留率都可以保持在88%以上。当pH值偏酸性时,SOD的活力会随着pH值的升高而开始增加;在碱性pH值范围内时,SOD活力随着碱性的增强而降低,在考察中发现牛奶中提取的SOD的整体活力保存最好,酵母中的SOD活性次之,而木瓜中SOD的整体活力保存最差。
2.1.2 不同温度下SOD的稳定性
将 SOD 酶液分别于 25、37、50、60、80 ℃下保存24 h后,测定它们的酶活力。不同温度下SOD蛋白的稳定性见图2。

图2 三种不同来源SOD蛋白的热稳定性Fig.2 Heat stability of three SOD proteins
通过考察发现,当温度为25℃时3种不同来源的SOD的酶活力均达到最高,随着温度的升高,3种SOD酶的活力开始下降,当温度达到80℃时,3种SOD酶彻底失活。牛奶中提取的SOD酶在温度低于50℃时均表现出较稳定的状态,当温度高于50℃时其酶活性开始大幅度衰减,温度高达80℃时,其中的酶活性基本为零。3种SOD中,牛奶中SOD酶活力保存较好,木瓜中提取的SOD次之,酵母中SOD的活力保持最差。
2.1.3 外源试剂耐受性
SOD酶作为活性物质对于不同试剂的耐受性存在着较大的差异,此次选择SOD提取工艺中常用的67%的甲醇、67%的乙腈提取试剂,以及1 mol/L盐酸胍、3 mol/L尿素和50 mmol/L双氧水等常用缓冲剂作为此次考察的外源试剂。SOD蛋白对外源试剂的耐受性见图3。
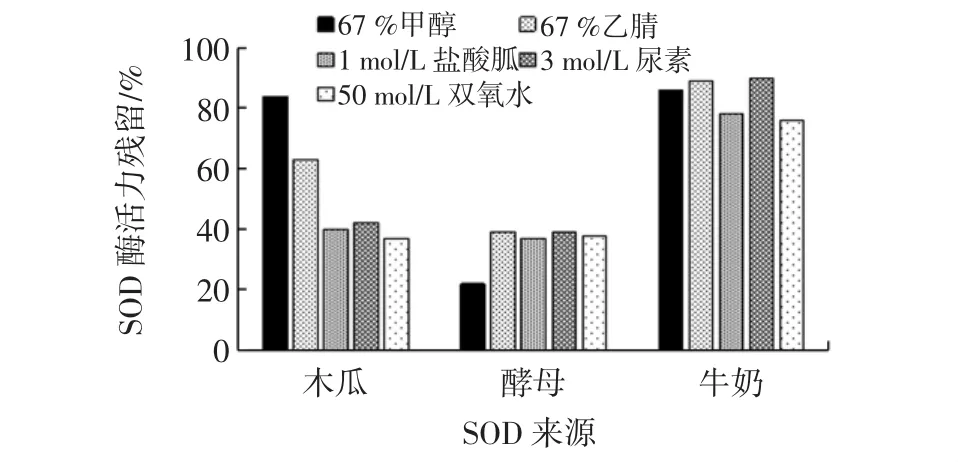
图3 三种不同来源SOD的对外源试剂的耐受性Fig.3 Acitivty rate of three SOD
木瓜中SOD对67%甲醇和67%的乙腈的耐受性表现较好,分别为84%和65%,但其对3 mol/L尿素、1 mol/L盐酸胍和50 mmol/L双氧水3种试剂的耐受性较差;此次考察中酵母菌对5种外源试剂的耐受性均在40%以下;而牛奶中的SOD对外源试剂的耐受性表现较好,其SOD的活力均保持在80%左右。根据测试结果显示,牛奶中SOD对5种外源试剂的耐受性明显优于木瓜和酵母菌中提取的SOD。
通过考察不同来源SOD蛋白在上述条件下的稳定性,得出结论:牛奶中的SOD蛋白在不同pH值、不同温度及对外源性试剂的干扰方面的稳定性较为理想。故选择牛奶作为提取原料进行试验,并对从其中提取的SOD做进一步修饰,提高其稳定性。
2.2 SOD酶活力的测定结果
针对牛奶中提取的SOD我们采用经典邻苯三酚自氧化法测定其SOD活性,SOD酶活力的测定采用邻苯三酚自氧化法规定每分钟反应液中SOD抑制邻苯三酚自氧化速率50%时为一个SOD活力单位[10]。
在紫外-可见分光光度计上采用波长扫描程序,在波长200 nm~600 nm范围内对提取物进行扫描,检测邻苯三酚自氧化产物波长吸收规律。利用紫外-可见分光光度计测得的SOD紫外吸收光谱图,见图4。如图4所示,牛奶中SOD的最大吸收波长出现在319 nm处,这与GB/T 5009.171-2003《保健食品中超氧化物歧化酶(SOD)活性测定》[10]中的试验条件320 nm相符,故本试验采用320 nm为试验的测定的波长。
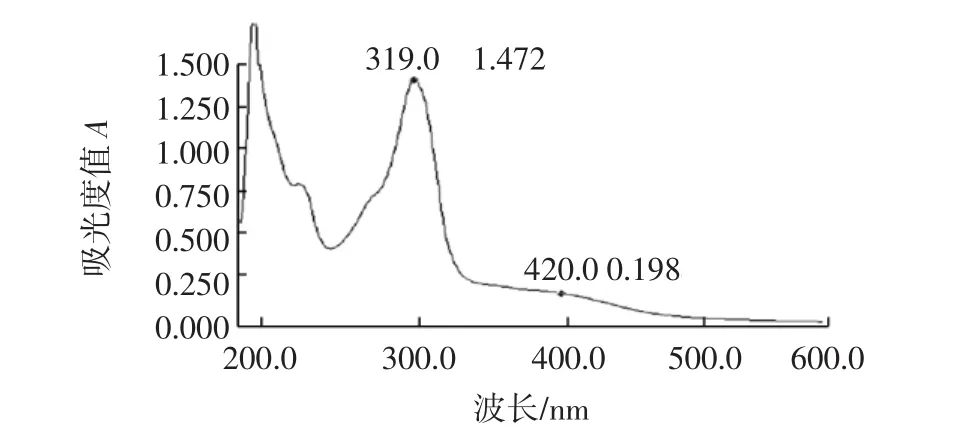
图4 SOD的紫外吸收光谱图Fig.4 UV absorption spectrum of SOD
取数支10 mL离心管,向离心管中加入A液2.35 mL、B液0.15 mL、一定量的蒸馏水及样液,整个试验过程中A液均应恒温于25℃。试验数据及相应的△A320(min-1)值见表1所示。
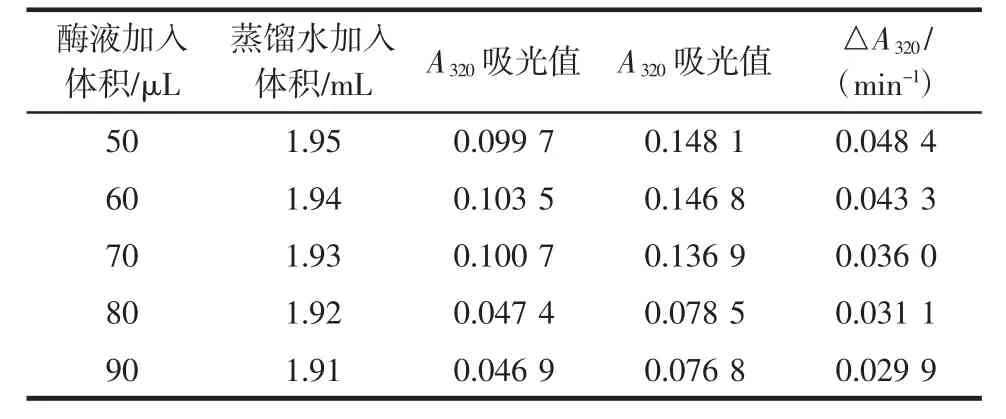
表1 邻苯三酚自氧化速率测定加样表Table1 Pyrogallot autoxidation rate test volume table
根据上表试验数据显示,当稀释后的酶液加入量为90 μL时,△A320(min-1)的值为0.029 9,近似于50%的自氧化速率空白值,满足试验要求。将酶加入量为90 μL时的相应数值代入公式。根据公式:

式中:A320为邻苯三酚的自氧化速率;A'320为样液抑制邻苯三酚自氧化速率;V1为反应液总体积,本次实验中为4.5 mL;V为加入样液的体积,本次实验中为0.2 mL;D为样液稀释倍数;m为样品质量。
最终计算出样品中SOD酶活性的结果为116 608 U/g。
2.3 3种修饰方法的比较
测定上述3种修饰剂后的SOD吸光值,并计算修饰率。向上述3种修饰酶中加入1 mL 4%NaHCO3,1 mL 10%十二烷基硫酸钠,充分溶解20 min;加入1 mL 0.1%三硝基苯磺酸,在40℃的水浴中保温2 h,用0.5 mL,1 mol/L HCl终止反应,利用紫外-可见分光光度计于350 nm处测定吸光值[11]。修饰结果见表2。


表2 修饰后SOD的剩余酶活力Table2 The left enzyme activity after modification
由表2可以得出,针对牛奶中提取的SOD考察了牛血清白蛋白、月桂酸、壳聚糖对其的修饰作用,月桂酸修饰SOD的得率最高。根据修饰后SOD的剩余活性和修饰率,本研究最终选定利用月桂酸修饰牛奶中提取的SOD。
3 结论
本研究考察了牛奶、木瓜及酵母菌3种不同来源的SOD,通过对它们稳定性的研究,最终确定以新鲜牛奶为原料,用乙醇作为提取试剂,所得SOD的酶活力为116 608 U/g。因SOD具有生物活性,为使其性质稳定,更适合其在各种环境下发挥作用。本研究考察了月桂酸、牛血清白蛋白、壳聚糖3种不同的修饰剂对其的修饰效果,最终确定用月桂酸对牛奶中SOD进行修饰,采用经典的邻苯三酚自氧化法测得修饰后的SOD的酶活力为115 127 U/g。
