脂联素对子宫内膜癌Ishikawa细胞增殖及侵袭和转移能力的影响
2018-07-23郭会敏范毛川华方方杨胜华
郭会敏,范毛川,华方方,杨胜华,杨 君
(新乡医学院第一附属医院妇科,河南 卫辉 453100)
子宫内膜癌是女性生殖系统常见的恶性肿瘤,严重威胁女性健康和生活质量[1]。近年来,子宫内膜癌发病率呈上升趋势,发病年龄也向年轻化发展[2]。子宫内膜癌传统的治疗方法主要有手术治疗、化学治疗和放射治疗,这些治疗方法均存在诸多缺陷[3]。因此,探索子宫内膜癌新的治疗方法至关重要。随着生命科学技术的发展,从基因、蛋白乃至分子水平上对子宫内膜癌进行联合治疗具有较大的潜力。目前,针对细胞凋亡蛋白进行肿瘤靶向治疗是一个新的研究方向[4]。脂联素是重要的肿瘤特异性蛋白之一,属于细胞凋亡相关蛋白,在抗肿瘤中发挥作用。脂联素表达水平高的肿瘤细胞的抗凋亡能力较低[5]。由此推测,脂联素可能在细胞凋亡过程中发挥调控作用。但是,脂联素是否参与子宫内膜癌细胞的侵袭和转移目前尚不清楚。本研究旨在探讨脂联素对子宫内膜癌Ishikawa细胞侵袭和转移的影响及其机制,以期为子宫内膜癌的临床研究提供理论依据。
1 材料与方法
1.1细胞、试剂与仪器子宫内膜癌Ishikawa细胞购自上海拜力生物科技有限公司,四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)、转染试剂脂质体购自北京鼎国生物工程有限公司,磷脂酰丝氨酸外翻检测试剂盒、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的膜联蛋白V(Annexin V-FITC)、碘化丙啶(propidium iodide,PI)、caspase-3活性检测试剂盒购自上海碧云天生物技术研究所,抗脂联素抗体和二抗购自美国Sigma公司,RPMI-1640培养基和胎牛血清购自上海丰寿生物科技有限公司,脂联素反义RNA及其对照microRNA由苏州吉玛基因股份有限公司构建和提供。细胞培养箱购自美国Thermofisher公司,BD Accuri C6流式细胞仪购自美国BD公司;ChemiDocTMTouch Imaging System购自美国Bio-Rad公司。
1.2方法
1.2.1细胞培养及分组将子宫内膜癌Ishikawa细胞复苏后应用含体积分数20%胎牛血清的RPMI-1640培养基在37 ℃、饱和湿度、含体积分数5% CO2的孵箱中培养,呈贴壁生长,1~2 d换液1次,2.5 g·L-1胰蛋白酶常规消化,13传代。将培养的子宫内膜癌Ishikawa细胞随机分为空白对照组、阴性对照组和实验组。
1.2.2细胞转染取3组对数生长期细胞,在转染前1 d使用0.1 nmol·L-1胰蛋白酶和二胺四乙酸混合物于37 ℃下消化10 min,加入新鲜培养基,1 000 r·min-1离心5 min,细胞沉淀重悬于新鲜的含体积分数20%胎牛血清的RPMI-1640培养基。第2天,细胞密度达到约95%,采用脂质体转染法将脂联素反义RNA(50 nmol·L-1)及其对照microRNA(50 nmol·L-1)分别转入实验组及阴性对照组子宫内膜癌Ishikawa细胞,转染24 h后换新鲜培养基,转染36 h后收集细胞进行后续实验。空白对照组细胞不进行转染。
1.2.3MTT法检测子宫内膜癌Ishikawa细胞增殖能力细胞转染36 h后,收集3组对数生长期细胞,调整细胞悬液浓度,每孔加入100 μL(96孔平底板),铺板使待测细胞密度为每孔1 000个,置于含体积分数5%CO2的37 ℃培养箱中孵育48 h,倒置显微镜下观察细胞的生长情况;每孔加入5 g·L-1MTT溶液20 μL,继续培养4 h;终止培养,小心吸去孔内培养液;每孔加入150 μL二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解,在酶联免疫检测仪波长490 nm处测各孔的吸光度值,实验重复5次。
1.2.4磷脂酰丝氨酸外翻流式细胞术检测子宫内膜癌Ishikawa细胞凋亡情况细胞转染36 h后,取3组Ishikawa细胞各2×105个,向250 μL细胞悬液中分别加入50 μL的Annexin V FITC试剂和1 μL反应缓冲液,常温下避光孵育20 min。采用流式细胞仪检测各组细胞凋亡情况,以磷脂酰丝氨酸在细胞膜表面的表达量作为凋亡指标。流式细胞术检测中发射光波长和吸收光波长分别为484、625 nm,实验重复5次。
1.2.5子宫内膜癌Ishikawa细胞中caspase-3活性检测细胞转染36 h后,取3组Ishikawa细胞各2×105个,向细胞中加入裂解液,使细胞中蛋白质释放出来,再向细胞裂解物中加入caspase-3生色底物,常温下避光孵育20 min。酶标仪分析各组细胞在波长492 nm处的吸光度值,实验重复5次。
1.2.6Westernblot法检测子宫内膜癌Ishikawa细胞中脂联素及细胞外调节蛋白激酶(extracellularregulatedproteinkinases,ERK)表达水平细胞转染36 h后,取3组Ishikawa细胞各2×105个,向细胞悬液中加入裂解液,充分裂解细胞,再向细胞裂解物中加入电泳上样缓冲液,制备western blot样品。使用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳对细胞中的蛋白水平进行分析。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳条件如下:先在60 V下电泳30 min,再在60 V下电泳100 min;将蛋白转移至硝酸纤维素膜,转移条件为90 mA、180 min;将硝酸纤维素膜浸泡于含50 g·L-1脱脂奶粉和吐温-20的磷酸盐缓冲液中,室温下轻轻摇动封闭2 h;使用含吐温-20的磷酸盐缓冲液洗涤2次。在硝酸纤维素膜上分别加入抗脂联素(12 000)的单克隆抗体或抗actin的内参单克隆抗体(14 000),室温条件下反应 3 h,使用含吐温-20的磷酸盐缓冲液洗涤2次。再向硝酸纤维素膜上加入山羊抗小鼠二抗(11 000),室温条件下反应3 h;使用含吐温-20的磷酸盐缓冲液洗涤2次。最后,对硝酸纤维素膜上的蛋白质进行显影和定影,采用Image J 6.0软件处理和分析各组子宫内膜癌Ishikawa细胞中ERK蛋白和脂联素的表达水平,实验重复5次。
1.2.7克隆形成实验细胞转染36 h后,取3组Ishikawa细胞,用含体积分数20%胎牛血清的培养液调整细胞密度至1×106L-1,按照0、10、50、100、200倍的梯度进行稀释,将稀释后的细胞接种至软琼脂中,置于含体积分数5%CO2的37 ℃培养箱中培养2周。待有克隆形成时,弃去培养液,加入纯甲醇室温下固定15 min。加入Giemsa染色30 min,进行克隆计数,实验重复5次。
1.2.8Transwell实验检测子宫内膜癌Ishikawa细胞迁移能力细胞转染36 h后,取3组Ishikawa细胞,在Transwell板上层铺固体培养基,下层铺含有趋化因子的培养基,上层分别接种3组Ishikawa细胞,培养48 h后计数下层细胞数,实验重复5次。

2 结果
2.13组Ishikawa细胞增殖能力比较空白对照组、阴性对照组和实验组Ishikawa细胞增殖能力(灰度值)分别为49.2±11.1、52.3±12.3、85.0±18.1;实验组Ishikawa细胞增殖能力大于空白对照组及阴性对照组,差异均有统计学意义(q=5.745、5.266,P<0.01);空白对照组与阴性对照组Ishikawa细胞增殖能力比较差异无统计学意义(q=0.479,P>0.05)。
2.23组Ishikawa细胞凋亡情况比较空白对照组、阴性对照组、实验组Ishikawa细胞膜表面磷脂酰丝氨酸表达分别为6.8±1.3、7.4±1.6,4.2±0.9;实验组Ishikawa细胞膜表面磷脂酰丝氨酸表达低于空白对照组及阴性对照组,差异均有统计学意义(q=4.477、5.510,P<0.05),空白对照组与阴性对照组Ishikawa细胞膜表面磷脂酰丝氨酸表达比较差异无统计学意义(q=1.033,P>0.05);见图1。空白对照组、阴性对照组和实验组Ishikawa细胞中caspase-3活性分别为3.6±1.1、3.8±1.2、1.1±0.1;实验组Ishikawa细胞中caspase-3活性低于空白对照组和阴性对照组,差异均有统计学意义(q=6.085、6.562,P<0.01);空白对照组与阴性对照组Ishikawa细胞中caspase-3活性比较差异无统计学意义(q=0.477,P>0.05)。
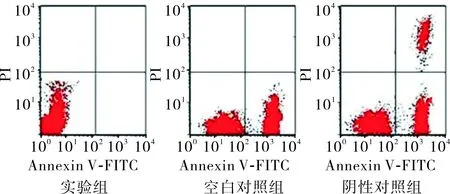
图13组Ishikawa细胞膜表面磷脂酰丝氨酸的表达
Fig.1ExpressionofphosphatidylserineofonthesurfaceofIshikawacellmembraneinthethreegroups
2.33组Ishikawa细胞中脂联素及ERK蛋白表达比较空白对照组、阴性对照组和实验组Ishikawa细胞中脂联素蛋白表达分别为3.50±0.01、3.41±0.01、1.32±0.01;实验组Ishikawa细胞中脂联素蛋白表达低于空白对照组和阴性对照组,差异均有统计学意义(q=69.803、66.630,P<0.01);空白对照组与阴性对照组Ishikawa细胞中脂联素蛋白表达比较差异无统计学意义(q=3.173,P>0.05);见图2。空白对照组、阴性对照组和实验组Ishikawa细胞中ERK蛋白表达分别为1.1±0.1、1.2±0.1、1.4±0.1;实验组Ishikawa细胞中ERK蛋白表达低于空白对照组和阴性对照组,差异均有统计学意义(q=7.423、4.949,P<0.01);空白对照组与阴性对照组Ishikawa细胞中ERK蛋白表达比较差异无统计学意义(q=2.474,P>0.05);见图3。

图23组Ishikawa细胞中脂联素蛋白表达
Fig.2ExpressionofadiponectinproteininIshikawacellsinthethreegroups

图33组Ishikawa细胞中ERK蛋白表达
Fig.3ExpressionofERKproteininIshikawacellsinthethreegroups
2.43组Ishikawa细胞克隆能力比较结果见图4。空白对照组、阴性对照组和实验组Ishikawa细胞克隆数分别为101.3±23.1、109.1±25.4、236.3±41.2;实验组Ishikawa细胞克隆能力大于空白对照组和阴性对照组,差异均有统计学意义(q=9.819、9.238,P<0.05);空白对照组与阴性对照组Ishikawa细胞克隆能力能力比较差异无统计学意义(q=0.582,P>0.05)。

图43组Ishikawa细胞克隆能力(×20)
Fig.4CloningabilityofIshikawacellsinthethreegroups(×20)
2.53组Ishikawa细胞侵袭能力比较结果见图5。空白对照组、阴性对照组和实验组Ishikawa细胞进入下室的细胞数分别为90.1±13.2、89.3±14.3、486.2±69.1。实验组Ishikawa细胞侵袭能力大于空白对照组和阴性对照组,差异均有统计学意义(q=21.422、21.476,P<0.01);空白对照组与阴性对照组Ishikawa细胞侵袭能力比较差异无统计学意义(q=0.054,P>0.05)。
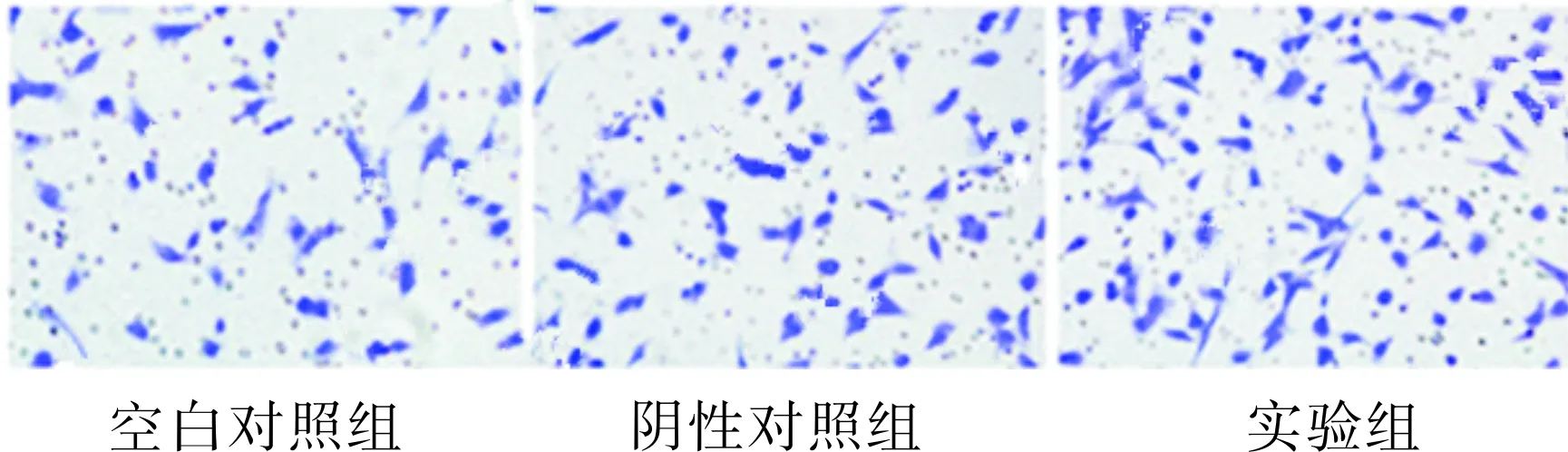
图53组Ishikawa细胞侵袭能力(×20)
Fig.5InvasivenessofIshikawacellsinthethreegroups(×20)
3 讨论
脂联素是由apM1基因编码的一种脂源性胶原样蛋白,主要存在于血液中,正常情况下血浆脂联素水平为1.9~17.0 mg·L-1,人类apM1基因是单拷贝基因,位于染色体3q27,全长约16 kb,包括3个外显子和2个内含子,有6种存在方式,不同形式的脂联素与其受体结合后发挥不同的生物学效应。脂联素在肿瘤发生发展中的作用尚不十分清楚,有研究表明,脂联素是重要的肿瘤特异性蛋白之一,它是细胞凋亡的促进蛋白,发挥重要的抗肿瘤作用。脂联素高表达的肿瘤细胞的抗凋亡能力差[5-9]。PETRIDOU等[10]研究发现,<65岁女性血清脂联素水平每增加1个标准差,其患子宫内膜癌的风险就降低50%。CUST等[11]和MA等[12]研究发现,血清脂联素水平与子宫内膜癌呈负相关。目前,脂联素在子宫内膜癌中的作用机制仍不明确[13-15]。恶性增生和转移侵袭能力是肿瘤细胞的重要特征,它是一个主动过程,主要涉及肿瘤细胞、宿主细胞及细胞外基质之间一系列复杂的相互作用,癌细胞与细胞外间质的黏附、细胞外间质和基底膜的降解及癌细胞的移动常导致肿瘤细胞发生远处转移[7]。本研究以子宫内膜癌Ishikawa细胞为细胞模型,采用靶向脂联素的反义RNA转染技术探讨了脂联素对子宫内膜癌Ishikawa细胞的调控作用。
本研究结果显示,实验组Ishikawa细胞增殖能力大于空白对照组及阴性对照组,空白对照组与阴性对照组Ishikawa细胞增殖能力比较差异无统计学意义;同时,克隆形成实验及Transwell实验发现,在应用脂联素反义RNA敲减子宫内膜癌Ishikawa细胞中脂联素的表达水平后,子宫内膜癌Ishikawa细胞的克隆形成能力及细胞的迁移能力明显增强;说明转染脂联素反义RNA的子宫内膜癌Ishikawa细胞的生长和侵袭能力更强,提示脂联素具有抑制肿瘤细胞生长及转移的作用。
细胞凋亡是机体的一种生理过程,机体在产生新生细胞的同时,衰老和突变的细胞通过凋亡机制被清除,使器官和组织得以正常发育和代谢。细胞凋亡的调控障碍与肿瘤的发生密切相关,肿瘤的发生与控制细胞增殖的癌基因的过度表达有关,也与抑制细胞凋亡的基因高表达及诱导细胞凋亡的抗癌基因变异失活有关。本研究结果显示,转染脂联素反义RNA的Ishikawa细胞中caspase-3活性及细胞膜表面磷脂酰丝氨酸表达降低,说明转染脂联素反义RNA的Ishikawa细胞凋亡减少,提示脂联素可以促进肿瘤细胞凋亡,抑制肿瘤细胞生长。这与以往研究[16-17]结果一致。
ERK是一类丝/苏氨酸蛋白激酶,是传递丝裂原信号的信号转导蛋白,调节着细胞的增殖、分化和存活,ERK和其信号途径在肿瘤侵袭和转移过程中起中介和放大信号的作用。有研究表明,脂联素受体在人类子宫内膜基质细胞及上皮细胞中均有表达[18],脂联素通过与子宫内膜上皮细胞及间质细胞上的脂联素受体结合,增加腺苷一磷酸依赖的蛋白激酶(5′-adenosine monophosphate-activated protein kinase,AMPK)a亚基的磷酸化而激活AMPK来调节不同细胞周期蛋白D1(Cyclin D1)和E2(Cyclin E2)以及信号蛋白ERK1/2和蛋白激酶B,上调抑癌基因 肝激酶B1表达来抗肿瘤增殖,诱导细胞凋亡的发生[19]。本研究结果显示,应用脂联素反义RNA敲低子宫内膜癌Ishikawa细胞中脂联素水平后引起了ERK蛋白表达升高,提示脂联素可能通过抑制ERK蛋白表达而抑制肿瘤细胞的增殖、分化与存活。
综上所述,脂联素可能通过诱导子宫内膜癌细胞凋亡及抑制子宫内膜癌迁移和侵袭双重作用发挥抗肿瘤作用。但是,脂联素在子宫内膜癌中的作用机制仍不明确,有待于进一步研究。
