肝再生增强因子与大鼠肝移植急性排斥反应的相关性分析
2018-07-23龙飞伍李世红李云涛刘雁军
龙飞伍,李世红,刘 展,李云涛,刘雁军,侯 康,张 抒
(成都市第三人民医院普通外科,四川 成都 610031)
肝脏移植作为终末期肝病的唯一治疗手段,近年来发展迅速,然而免疫抑制剂价格昂贵且长期服用免疫抑制剂可能带来的各种毒副作用严重影响肝移植的发展,同时已经实施肝移植手术的患者术后慢性排斥反应也逐年增加。所以,在研究中揭示肝移植免疫及急性排斥反应机制及其调控方法,研究高效能、无毒性的免疫抑制剂是目前国内外研究的热点。肝再生增强因子(augmenter of liver regeneration,ALR)是从初生大鼠肝组织提取出来的蛋白质,能够特异性促进肝切除后肝组织再生及肝细胞增殖[1],在急性及慢性肝炎、肝硬化患者肝组织中均能够检测到ALR表达增加[2]。外源性给予重组人ALR(Recombination human augmenter of liver regeneration,rhALR)能够保护大鼠实验性肝纤维化、肝硬化及药物性肝损伤[3~5]。最近的研究发现肝脏自然杀伤细胞(Nature kill cell,NK cell)的活性被ALR所抑制,减少产生及分泌INF-γ,显现出ALR调控免疫活性的特性[2,6,7]。最新的体外实验发现外周血单核细胞活化及增殖也被ALR的活性所抑制,继而减少IL-2合成及分泌,这一结果直接表明ALR免疫调控的能力及作用方式[8,9]。作为内生性的肝脏免疫及营养调节因子,现有的研究结果尚未揭示肝移植免疫调节中是否有ALR参与及其机制,值得我们进一步的探讨。
本研究成功建立了同种同基因及同种异基因大鼠肝移植动物模型,观察肝脏移植后大鼠的肝功能变化和移植物组织中INF-γ、IL-2和ALR的表达,尝试在体内实验研究中探讨大鼠肝移植后移植物急性排斥反应过程中ALR与INF-γ之间及ALR与IL-2之间表达变化趋势的相关关系,探讨肝移植后移植物急性排斥反应中ALR可能的生物学作用及具体机制。
1 材料与方法
1.1材料本研究自2009年3月至2012年6月,ALR兔抗大鼠单克隆抗体由重庆医科大学第二附属医院病毒性肝炎研究所赠送;总RNA提取试剂盒购自Promega中国公司;逆转录试剂盒及SYBR®PrimeScriptTMRT-PCR Kit购自大连TaKaRa公司;羊抗兔辣根过氧化物酶标记的二抗购自Santa Cruz公司;大鼠IL-2及INF-γ 酶联免疫吸附试验检测试剂盒购自晶美(深圳)生物科技有限公司;RIPA裂解液及蛋白酶抑制剂PMSF购自碧云天(上海)生物技术有限公司;其他相关实验试剂均定购于相应的试剂公司。
1.2实验动物及分组采用改良的Kamada[10,11]“二袖套法”进行大鼠原位肝移植。LEW和BN大鼠购自北京维通利华试验动物技术有限公司。术前禁食12小时,禁水6小时,采用乙醚吸入麻醉,建立急性排斥大鼠肝移植动物模型组(急性排斥组,LEW到BN) 12只及免疫耐受大鼠肝移植动物模型组(免疫耐受组,BN到BN) 12只。术后第1、3、5和7天两大鼠各组随机处死3只,取血浆-70 ℃冰箱保存,肝脏组织液氮迅速冷冻后保存于-150 ℃冰箱备用。
1.3肝功能检测两组大鼠肝移植后外周血浆中TBIL、ALT及AST采用全自动生化分析仪(BeckmanCX7)自动检测。
1.4Real-timePCR检测肝脏移植物组织内ALR、INF-γ及IL-2mRNA的表达按Promega公司SV Total RNA Isolation System提取试剂盒的操作说明完成肝脏移植物总RNA抽提。按逆转录试剂盒(TaKaRa公司)操作说明完成逆转录反应来合成cDNA链。ALR(5’-AGCTGGATATGGCGCACATCA-3’,5’-AATTCAGGCATGCCCACCTTC-3’);INF-γ (5’-ACGCCATCACCAACAAGATAAGTA-3’,5’-CACAGCT TAGTGCAGGATCTCTG-3’);IL-2 (5’-AACGCTGGA ATTTTCATCTGCA-3’,5’-GCACATCATCGTATTGGCT CTC-3’) ;β-actin(5’-GCAGATTACAGCCCTGGGTCCTA-3’,5’-GTCTCATCGTAGTCCTGCTAGCTG-3’),由TaKaRa公司(大连)完成引物设计及合成。按TaKaRa大连公司Realtime PCR试剂盒操作说明(25 μl体系)完成定量PCR反应。所有读数均以β-actin值进行校正后用2-ΔΔCT值表示[12]。
1.5ELISA检测肝脏组织内INF-γ和IL-2含量取-150 ℃保存的肝脏组织约500 mg移入玻璃匀浆器,加入预冷PBS(0.02 mol/L,pH 7.0~7.2)3 ml于冰浴下反复研磨,匀浆液移入EP管中于冰浴下超声破碎进一步处理,5000转离心5分钟,留取上清备用。按大鼠INF-γ及IL-2 ELISA检测试剂盒操作说明完成肝脏组织内INF-γ及IL-2检测。
1.6Westernblotting检测肝脏组织内ALR蛋白的表达采用RIPA裂解液及PMSF提取肝脏组织总蛋白。Thermo BCA 蛋白浓度检测试剂盒,检测各样本蛋白浓度,根据最终计算的上样量加入5×Loading Buffer,100 ℃水浴5 min变性蛋白质,自然冷却后分装,-80 ℃保存。按Western blotting操作流程制备12%分离胶,4%浓缩胶,根据计算好的各样品上样量上样,每孔50 μg,(空余的孔加入10 μl 1×Loading Buffer)。选择恒定电压下电泳,浓缩胶40 V,分离胶80 V。恒定电流300 mA完成转膜。TBST配制的5%脱脂牛奶封闭后加入稀释好的ALR抗体,4 ℃孵育过夜;TBST洗涤3次后按1∶5000加入二抗,室温下孵育1 h。TBST洗涤3次后采用ECL试剂盒显影,采集图像。
1.7统计学方法数据均采用SPSS 16.0软件进行分析。所有相关实验数据表示为均数±标准差,两组间比较采用t检验,ALR和INF-γ以及ALR和IL-2蛋白表达变化的相关性应用Pearson相关分析完成,并用线性回归分析得出回归方程。P< 0.05表示差异具有统计学意义。
2 结果
2.1大鼠肝移植后肝功能变化两组肝移植术后第1天ALT、AST和TBIL比较,差异无统计学意义(P> 0.05)。急性排斥组术后第3、5、7天ALT、AST和TBIL高于术后第1天,差异有统计学意义,而免疫耐受组上述各项指标在术后不同时间点比较差异无统计学意义;术后第3、5、7天两组间比较,急性排斥组ALT、AST、TBIL明显高于免疫耐受组,差异有统计学意义(P< 0.05)。见表1。
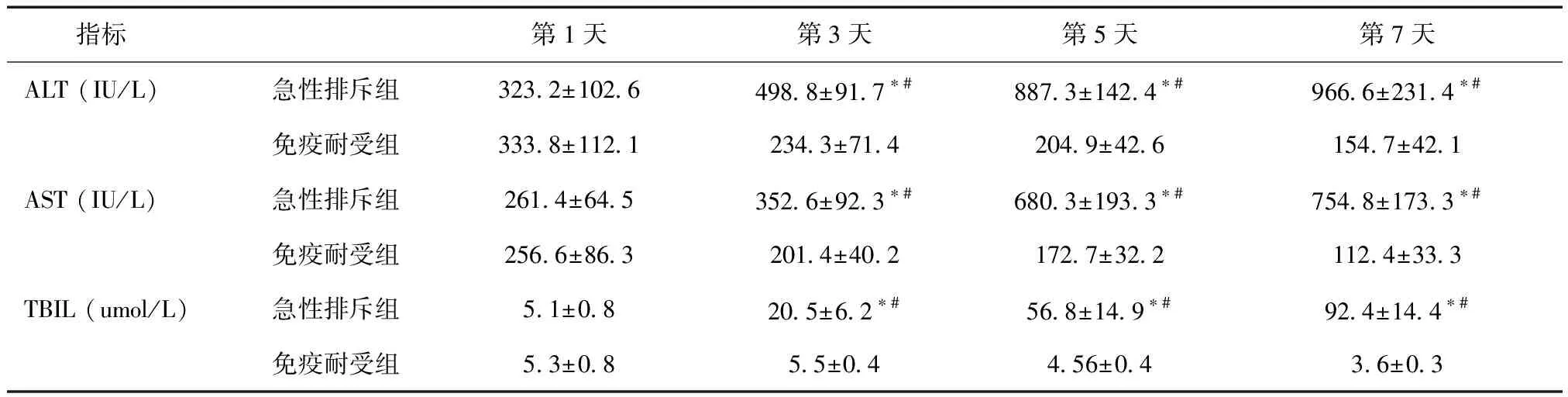
表1 肝移植后大鼠肝功能ALT、AST和TB水平变化
*组内与术后第1天比较,P< 0.05;#与免疫耐受组比较,P< 0.05
2.2肝组织内IL-2的表达两组术后第1天IL-2 mRNA比较,差异无统计学意义(P>0.05)。急性排斥组术后第3、5、7天IL-2 mRNA表达明显高于术后第1天,且明显高于免疫耐受组,差异有统计学意义(P< 0.01)。肝脏组织内IL-2表达与IL-2 mRNA一致。
2.3肝组织内ALR的表达术后第1天两组ALR mRNA比较差异无统计学意义(P>0.05)。第3、5、7天急性排斥组及免疫耐受组ALR表达均高于术后第1天,差异有统计学意义(P< 0.05)。术后第3天两组ALR mRNA表达均明显低于术后第1天,且免疫耐受组明显高于急性排斥组,差异有统计学意义(P< 0.05)。术后第5、7天免疫耐受组 ALR mRNA表达明显高于急性排斥组,差异有统计学意义(P< 0.05)。术后第5、7天急性排斥组ALR蛋白表达明显低于免疫耐受组,差异有统计学意义(P< 0.05),见表2。
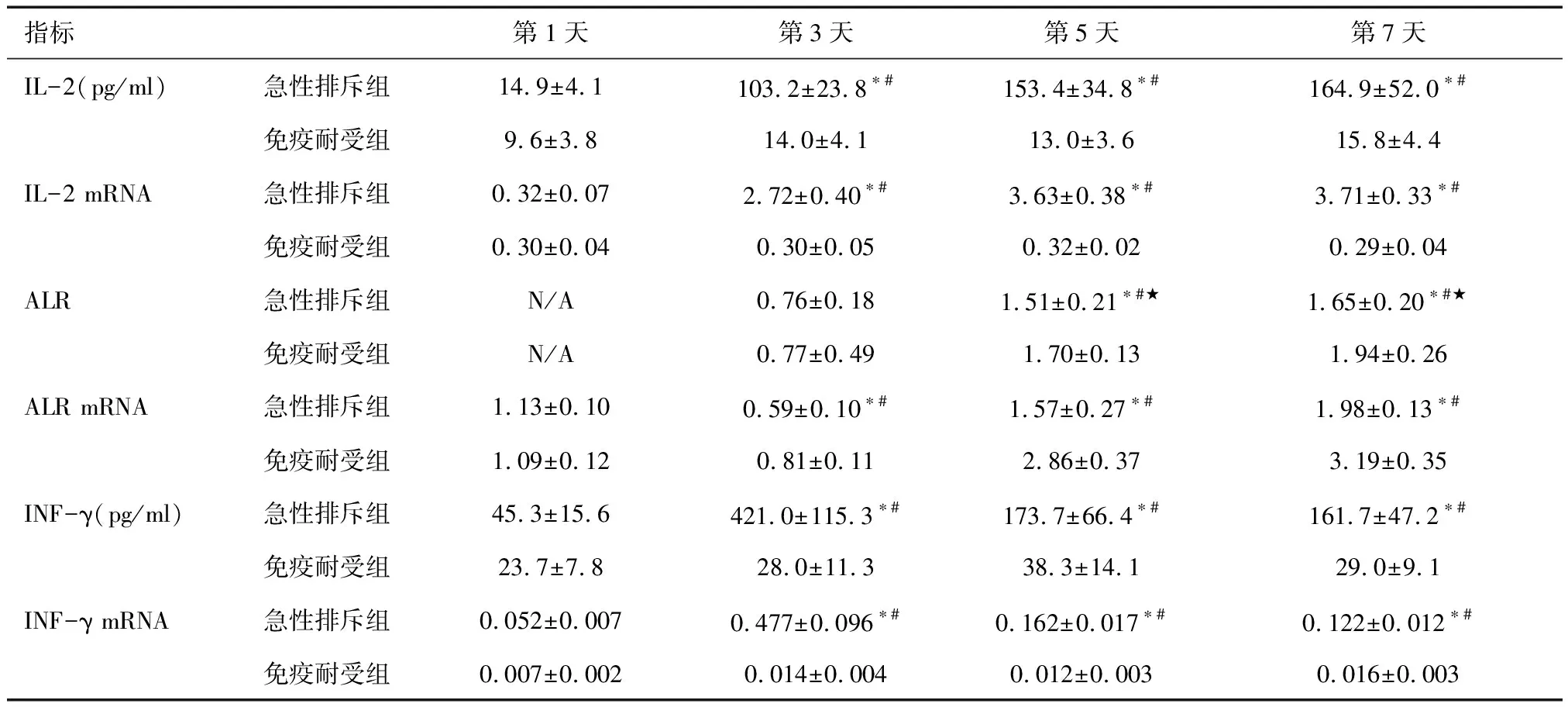
表2 移植肝脏组织内INF-γ、IL-2与ALR表达
*与术后第1天比较,P< 0.05;★与术后第3天比较,P< 0.05;#与免疫耐受组比较,P< 0.05
2.4肝组织内INF-γ的表达术后第1天急性排斥组肝脏组织内INF-γ mRNA表达明显高于免疫耐受组,且急性排斥组术后第3天明显高于第1、5、7天,差异有统计学意义;免疫耐受组各时间点之间比较差异无统计学意义(P>0.05)。肝脏组织内INF-γ表达与INF-γ mRNA一致。
2.5ALR表达与急性排斥反应的相关性分析大鼠肝移植术后急性排斥反应发生时同种异基因组ALR与INF-γ 表达呈明显的负相关(r=-0.6833,P< 0.05,y=-223.99x+545.15,图1a),而与IL-2的表达无显著的相关性 (r=0.3775,P> 0.05,图1b)。

图1 ALR与INF-γ和IL-2表达相关曲线
3 讨论
根据文献报道Hagiya等研究者[1]1994年在胎儿大鼠来源的肝脏组织中首次分离出能特异性的促进部分肝切除后肝脏组织及肝细胞再生的生长因子,称为肝再生增强因子。其实质上是一种能够催化蛋白质间二硫键形成的连接了黄素腺嘌呤核苷酸的巯基氧化酶(FAD-linked sulfdryl oxidase)[13]。
后来的研究在肝脏及睾丸组织发现ALR高表达,同时肝脏和睾丸组织是公认的免疫特惠器官。肝脏或者睾丸与其他器官或组织联合移植,可以诱导相关目标移植物表现出免疫耐受,目标移植物生存时间得以延长[14~16]。研究发现ALR能够在实验中抑制NK细胞活性,减少IFN-γ的表达及分泌[2]。肝脏干细胞移植后ALR能够抑制其免疫排斥反应,在体外研究中效果优于环孢素A;肝脏干细胞移植联合ALR治疗急性肝衰竭,治疗效果比单纯干细胞治疗得到明显提高。体外研究结果证实,ConA诱导的脾脏单核细胞增殖及活化被ALR抑制,其合成及分泌IL-2明显减少;因此有学者认为认为ALR本身具有免疫抑制能力[8,9]。潘桃等[17]的研究发现hALR能够通过诱导Treg细胞的增殖和分化,促进TGF-1及IL-10的产生,从而调节免疫反应。
我们在研究结果中发现无免疫抑制剂干预的条件下我们观察到急性排斥组大鼠术后第1天IFN-γ的表达明显升高,最高峰值在术后第3天出现,在术后第5、7天开始出现逐渐下降的趋势;免疫耐受组肝移植术后各个时间点的IFN-γ表达均显著低于急性排斥组,数据在较低水平波动。Liang等[18]的研究结果发现大鼠肝移植后ALR与IFN-γ mRNA表达呈负相关,但ALR在肝脏组织内广泛表达,其转录水平的变化不能准确反映ALR蛋白的功能状态,因此我们在研究中从蛋白质水平探讨了ALR与IFN-γ及IL-2表达的相关性。我们的研究结果与Hideaki[19]的研究结果一致,相关性分析发现同种异基因移植组移植肝脏组织内IFN-γ与ALR蛋白表达呈明显的负相关,我们推测ALR可能通过参与调节IFN-γ表达而影响急性排斥反应。
Oliveira等[20]研究了肾移植后肾脏组织活检提取的原代细胞分泌的细胞因子,发现22例患者出现急性排斥反应时血清中IL-2含量明显升高,而在病情稳定的21例患者血清中仅检测到少量IL-2表达。我们在研究中发现急性排斥组肝移植术后第3天开始外周血中能够检测到IL-2表达增加,而且进行性表现为逐渐增高的趋势;而免疫耐受组肝移植术后IL-2的表达在不同的时间无显著差异。相关性分析结果发现ALR与IL-2的表达变化无统计学差异。Chen等[21]在研究中观察到在大鼠肝移植后立即给予rhALR移植肝脏组织病理改变明显减轻,移植物组织内IFN-γ与IL-2的表达明显下降,从而促进T淋巴细胞的凋亡,而Xie[8]等在体外研究中的研究结果与此相同。我们的在研究中发现ALR与IL-2蛋白表达不相关,可能与同种异基因移植组肝移植后急性排斥反应过程未被干预,ALR表达被影响有关;也可能与细胞因子网络调控影响了急性排斥反应的过程有关。
综上所述,我们在未给予外源性免疫抑制药物干预的情况下通过体内实验研究了肝移植后移植肝脏内ALR与IL-2及ALR与IFN-γ在发生急性排斥反应时的表达变化关系。我们在研究中发现大鼠肝移植后急性免疫排斥反应过程可能受到ALR的调控,而具体机制可能是ALR通过调节免疫细胞合成及分泌细胞因子来实现,Wang等[22]在研究中发现肝脏kupffer细胞表面广泛分布着ALR受体,kupffer细胞合成及分泌免疫细胞因子受到ALR调控。因此,我们在这里推测ALR能够抑制肝脏移植物急性免疫排斥反应,其具体机制可能是ALR结合到KCs细胞膜上的受体,调控KCs合成及分泌免疫活性细胞因子,从而调节Th活性,最后实现调控肝细胞增殖及细胞免疫作用。
