18β-甘草次酸的结构修饰及生物活性研究进展
2018-07-21石明辉戴均贵顾政一
马 媛,石明辉,戴均贵,赵 军,徐 芳,顾政一
(1.新疆维吾尔自治区药物研究所,乌鲁木齐 830004;2.新疆维吾尔自治区中药民族药研究所,乌鲁木齐 830002;3.中国医学科学院 北京协和医学院药物研究所,天然药物活性物质与功能国家重点实验室,北京 100050)
甘草次酸(glycyrrhetinic acid,GA,C30H46O4)是甘草的主要活性成分之一,属五环三萜类化合物,由于三萜皂苷母核18位手性碳原子(C-18)构型不同,有α和β2种差向异构体,见图1。甘草次酸具有广泛的药理活性[1-2],尤其是其衍生物具有抗炎[3-5]、抗肿瘤[6-9]、抗氧化[10]、抗病毒[11-12]和抑菌[13-14]等活性,已被广泛应用于食品、烟草、医药和化妆品等行业[1]。但长期服用该药可引起类醛固酮增多症(pseudo aldosteronism)等不良反应(表现为患者长期用药后出现水肿、湿疹、低血钾和钠潴留等现象),且其水溶性差,高浓度时对正常细胞有毒性,限制了其在临床上的广泛应用。为了改善甘草次酸的溶解性、增强药理活性并降低和克服上述不良反应,国内外专家对其进行了大量的化学合成[1-2],此外,近年来开展的采用植物细胞、微生物和酶对甘草三萜类化合物进行结构修饰的研究,已经成为国内外学者研究的热点,并取得显著进展[15]。本文综述了近年国内外有关18β-甘草次酸的结构修饰及生物活性的研究进展。
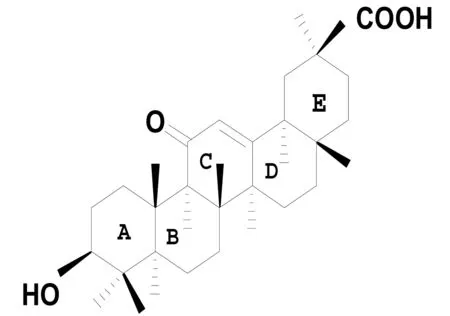
18α-glycyrrhetinic acid

18β-glycyrrhetinic acid
图1甘草次酸的化学结构类型
Fig.1 Chemical structure types of glycyrrhetinic acid
1 化学合成
国内外学者利用化学合成方法对18β-甘草次酸从不同的角度进行了结构修饰和改造,合成了大量结构各异的衍生物,研究其不同的药理活性,取得了显著的研究成果。
1.1A环部位修饰的甘草次酸衍生物及活性
1.1.1A环具有不同官能团衍生物的化学合成 高振北等[16]采用化学合成方法对18β-甘草次酸A环进行改造,合成了一系列新型18β-甘草次酸A环官能团化衍生物。构效关系分析表明,A环内烯键的形成对抑制人类肿瘤细胞增殖有重要影响。
1.1.22位羟基部位修饰的甘草次酸衍生物及活性 Chadalapaka G等[17]通过分析构效关系,在18β-甘草次酸A环C-2位引入一系列吸电子基团合成1-烯-3-氧-甘草次酸衍生物,这些衍生物对人膀胱癌细胞KU7、253JB-V和人胰腺癌细胞Panc-1、Panc-28均有不同程度的抑制活性,尤其是1,2-烯-2-三氟甲基-3-羰基-18β-甘草次酸和1,2-烯-2-氰基-3-羰基-18β-甘草次酸的抗癌效果更优。
1.1.33位羟基部位修饰的甘草次酸衍生物及活性 Csuk R等[18]研究发现,在甘草次酸C-3位引入酰氯等活泼基团,可合成一系列不同碳链的C-3位烷胺基取代18β-甘草次酸甲酯衍生物,其中7个碳原子的烷胺基取代的生物活性表现更为出色。
1.1.42位和3位羟基部位同时修饰的甘草次酸衍生物及活性 Gao C等[19]在C-2和C-3位引入各种五元稠合杂环,得到18个新的GA衍生物,评估了它们对8种不同肿瘤细胞系细胞生长的抑制活性,其中活性最强化合物的半抑制浓度(IC50)为5.19~11.72μmol·L-1,比GA强11倍。研究表明,GA及其衍生物对受试肿瘤细胞的迁移具有抑制作用,尤其是衍生物的抗转移活性比GA强20倍。
1.2C环11位羰基部位修饰的甘草次酸衍生物及活性 18β-甘草次酸C环的结构修饰一般主要集中在C-11位羰基上。羰基通常可以用Zn或Zn-Hg齐还原成亚甲基,或硼氢化钠选择性还原成羟基,而保留C-30位羧基。
Lin D等[20]将11-羰基还原为11-羟基得到了11-deoxy glycyrrhetinic acid(11-DOGA),研究发现,GA和11-DOGA以剂量和时间依赖方式显著抑制胃癌细胞的生存能力,两者均可有效抑制裸鼠胃癌细胞肿瘤形成,GA对胃癌细胞的体内和体外毒性均比11-DOGA高。结果表明,对甘草次酸C环11位羰基的结构修饰能够有效降低其毒性和不良反应。
1.3E环30位羧基部位修饰的甘草次酸衍生物及活性 陈凑喜等[21]合成了5个含吡啶杂环多酰胺结构的18β-甘草次酸衍生物,对其抑制人宫颈癌HeLa细胞活性进行了体外评价,初步发现目标化合物对人宫颈癌HeLa细胞具有细胞毒活性,能够有效抑制HeLa细胞增殖、诱导其凋亡,IC50最小值仅为0.02μmol·L-1,均优于临床常用抗肿瘤药物阿糖胞苷。
Yan T L等[22]合成了一系列新的甘草次酸衍生物,评价了它们对4种癌细胞系(MCF-7、HeLa、HepG2和A-549)的血管内皮生长因子受体2(VEGFR2)的抑制活性及其抗增殖性能。其中化合物3a(3β-羟基-30-(4-苯基-1-哌嗪基)-齐墩果烷型-12-烯-11,30-二酮)对MCF-7细胞具有最好的抑制活性,也显示出对VEGFR2酪氨酸激酶最有效的抑制活性。对化合物3a进行了结合模式的对接模拟,结果表明,其能在VEGFR2活性位点处结合。
1.4多环同时结构修饰的甘草次酸衍生物及活性
1.4.13位羟基部位和(或)30位羧基部位修饰的甘草次酸衍生物及活性 马红艳等[23]以18β-甘草次酸为先导化合物,分别通过高温碱催化构型转化反应及硫酸催化酯化反应,合成了5个甘草次酸衍生物:18α-甘草次酸(产率63%)、3-乙酰-18β-甘草次酸(产率96%)、3-乙酰-18α-甘草次酸(产率90%)、18β-甘草次酸甲酯(产率79%)和18α-甘草次酸甲酯(产率67%)。2013年木合布力·阿布力孜等[24]和高苗苗等[25]对C-3位和C-30位酯化或酰胺化、C-11位脱氧及C-18βH的构型转化等进行化学修饰,合成了14个甘草次酸衍生物(包括甘草次酸酯类、酰胺类和11-脱氧衍生物)。
1.4.2其他同时修饰的甘草次酸衍生物及活性
1.4.2.1A环和E环同时修饰的甘草次酸衍生物及活性 Gao Y等[26]设计并合成了15个含C-30氮杂环和不同A环取代基的新型甘草次酸衍生物,这些衍生物均具有抑制人白血病HL-60细胞的增殖作用。研究发现,与具有2-羟基亚甲基-3-酮基,异唑或2-氰基-3-酮基的化合物相比,在A-环上具有氰基-烯酮官能团的化合物表现出更好的生长抑制效果。
孟艳秋等[27]设计并合成了12个甘草次酸C-3和C-30衍生物,并对其体外抗肿瘤活性进行研究。结果表明,上述衍生物对肿瘤细胞MCF-7和A549的抑制活性均明显强于GA,其中2,3-环氧-11-氧代-齐墩果烷型-30-羧酸乙酯(GA-I1)、2,3-环氧-11-氧代-齐墩果烷型-30-羧酸苄酯(GA-I2)和N-[3,11-氧代-齐墩果烷型-12-烯-30-酰]-环己胺(GA-II1)对MCF-7和A549 2种细胞表现出很好的抑制活性,明显高于对照药吉非替尼。
1.4.2.2A环、C环和E环同时修饰的甘草次酸衍生物及活性 Salomatina O V等[8]在A环引入2-氰基-3-氧代-1-烯部分,在E环C-30位形成甲酯,同时改变C环和E环中的双键和羰基的形成位置,合成了4个甘草次酸的新半合成衍生物,使用鼠类巨噬细胞样和肿瘤细胞的生物测定显示,2-氰基-3,12-氧代-齐墩果烷型-30-羧酸甲酯与甲基查尔酮不同,因其C环中不具有9(11)-双键而表现出对肿瘤细胞的抑制活性和抗炎的高选择性。
Li X等[28]合成了14个具有C环不同结构的2-氰基-3,12-二氧代-18β-齐墩果烷型-1,9(11)-二烯-30-酸(CDODO-Me-12)类似物,以确定抑制人白血病HL-60细胞生长和诱导细胞凋亡的活性基团。C环中的不饱和基团需要维持抑制细胞生长和诱导凋亡的能力。化合物2-氰基-3-氧代-9(11),12-二烯-齐墩果烷型-30-羧酸甲酯C环中具有9(11),12-二烯,与c-FLIP水平降低相关的CDODO-Me-12相比,表现出显著的细胞凋亡诱导能力,但与Mcl-1和XIAP无关。它具有降低GSH消耗的能力,能代表通过与CDODO-Me-12不同的机制起作用的新活性化合物。
孟艳秋等[29]对甘草次酸C-3、C-11和C-30进行结构修饰,设计并合成了7个目标产物,抗肿瘤活性筛选结果表明,3β-叠氮基-齐墩果烷型-12-烯-30-羧酸乙酯对肿瘤细胞MCF-7的抑制率比母体显著提高,3β-叠氮基-齐墩果烷型-12-烯-30-羧酸乙酯、3β-叠氮基-齐墩果烷型-12-烯-30-羧酸正丙酯和3β-叠氮基-齐墩果烷型-12-烯-30-羧酸正丁酯对肿瘤细胞A549的抑制率均比母体有所提高。陈兰等[30]对甘草次酸C-3、C-11和C-30进行结构修饰,合成了6个目标产物,经过鉴定确认了其化学结构。
唐百达等[31]对18β-甘草次酸A环、11位羰基及30位羧基进行结构修饰,设计并合成了20个2-取代-3-氧代-齐墩果烷型-12-烯-30-酰胺类化合物。这些衍生物对PC-3细胞显示了不同程度的生长抑制活性,明显好于其母体化合物,其中N-(2-氰基-18β-齐墩果烷型-1,12-二烯-30-酰基)哌啶的活性最强。构效关系表明,A环引入2-氰基-3-氧代-1-烯的化合物活性最好,2位引入羟亚甲基与2,3位骈合异恶唑环类化合物活性相当,2位引入氰基的化合物活性较弱;30位羧基与哌啶及哌啶基哌啶成酰胺活性较好,与 4-甲基哌嗪、吗啉和哌嗪成酰胺活性较弱。
黄敏等[32]为了探讨18β-甘草次酸C环双键位置对其抗肿瘤活性的影响,设计并合成了新型C环上具有9(11)-烯基结构的化合物,以此C环骨架对A环及30位羧基进行结构修饰,共24个GA衍生物,并测定了它们对人前列腺癌PC-3和白血病HL-60细胞的体外抑制活性。结果表明,大多数衍生物对上述细胞显示出比GA更强的生长抑制活性,尤以2-氰基-3-氧代-齐墩果烷型-1,9-双烯-30-羧酸甲酯的活性最强。
Zou L W等[33]将GA的11-氧代-12-烯转化为12-二烯部分,将C-3羟基和C-30羧基分别转化成3-O-β-羧基丙酰基和乙基酯,得到了一系列GA衍生物,致使先导化合物18β-GA对人羧酸酯酶2(hCE2)和hCE1的选择性抑制作用显著增强。
2 生物转化
生物转化(biotransformation)是利用微生物、动植物的培养体系或其产生的酶制剂对外源性化合物进行结构修饰而获得有价值产物的生物化学反应过程,亦称为生物催化(biocatalysis),其本质是利用生物体系本身所产生的酶对外源性化合物进行酶催化反应,反应类型有水解、羟基化和糖基化等,具有高度的立体和位置选择性、反应条件温和、催化效率高、反应类型多和不污染环境等特点。采用生物转化方法可进行化学法相对较难进行的反应,从中寻找并获得新的高活性或低毒性的天然活性先导化合物,是创制药物新分子的重要手段之一[15]。
2.1植物组织细胞培养
2.1.1以植物组织细胞作为生物转化体系 将植物组织细胞培养应用于甘草中有效成分的生物转化,具有重复性好、材料充足和周期短等优点。Orihara Y等[34]用桉树的细胞悬浮培养液转化18β-GA,得到2个产物,即28-羟基-18β-甘草次酸-30β-吡喃葡萄糖酯和23,28-二羟基-18β-甘草次酸-30β-吡喃葡萄糖酯。这种游离悬浮细胞的生物转化系统具有直接使用前体、细胞转移限制少、不存在影响细胞活力和生理状态等优点,是目前使用最多的一个转化系统。
2.1.2以毛状根作为生物转化体系 相对于悬浮细胞,毛状根具有生长快速、加倍时间短、遗传和生化稳定的特点。Asada Y等[35]利用人参毛状根具有糖基化和丙二酰基化的生物转化能力,对18β-GA进行生物转化,由于18β-GA的C-3位羟基、C-30位连有羧基,利用人参毛状根培养能使其糖基化和丙二酰基化,得到6个转化产物。
2.2微生物转化 Qin Y J等[36]用短刺小克银汉霉(Cunninghamellablakesleeana)转化GA,得到2个主产物和4个次主产物。2个主产物鉴定为3-酮基-7β-羟基甘草次酸和7β-羟基甘草次酸,并筛选了底物及2个主产物的抑菌活性。结果表明,短刺小克银汉霉AS 3.970对GA具有羟基化作用,GA和2个主产物对耐药菌粪肠球菌具有良好的抑菌活性。
马媛等[37-38]和Ma Y等[39]利用52种微生物进行18β-GA的微生物转化研究,经检测发现10种真菌对GA有不同程度的转化,选择短刺小克银汉霉CGMCC 3.970对GA进行微生物转化的放大实验,经纯化和制备最终获得 18 个甘草次酸衍生物,其中 12 个为新化合物。结果提示短刺小克银汉霉CGMCC 3.970对GA具有选择性酮基化、羟基化及酰基化作用,药理活性实验结果显示,所得衍生物中7β,15α-二羟基-18β-甘草次酸的体外神经保护活性最强,其IC50值为0.000 45μmol·L-1,甚至比甘草酸的活性更强。
2.3酶水解转化 吴少杰等[40]分别利用酶水解法及液体发酵转化法制备单葡萄糖醛酸基甘草次酸,酶水解法产物的产率为23.7%,液体发酵法的产率为10%。由此可知,利用酶水解法转化甘草次酸,可显著提高目标化合物的转化率。直接以酶为反应体系的生物转化,是获得单一目标产物的有效途径,具有方便、快捷、产率高的优势,在工业化生产中具有应用价值。
3 结语
甘草次酸的生物转化一直是国内外研究的热点,然而目前基本上处于实验室研究阶段,未能实现产业化,国内对其研究刚刚起步,但其作用不可忽视,今后需要加大研究力度,逐步了解其生物转化的途径、反应的特点和条件,寻找新的、药理活性更强的化合物,进而研制新药。大量研究表明,用微生物转化18β-甘草次酸具有广阔的应用前景,获得的目标组分多,但要获得专一性强的微生物转化菌株和适宜的转化条件较为困难。加强菌株筛选及简便、快捷的转化条件研究,对利用微生物转化甘草次酸的工业化生产具有重要意义。
