TBARR、TBRR、TBCR在血浆置换治疗后慢加急性肝衰竭患者预后评估中的作用
2018-07-20辛克锋李铭李莎莎李劲松张晶
辛克锋,李铭,李莎莎,李劲松,张晶
(1安徽医科大学阜阳传染病临床学院·阜阳市第二人民医院,安徽阜阳236015;2首都医科大学附属北京佑安医院)
慢加急性肝衰竭(ACLF)是在慢性肝病基础上发生的急性肝功能失代偿[1],单纯内科治疗其病死率可高达60%~70%,乙型肝炎病毒(HBV)感染是我国引起肝衰竭的首要原因。人工肝治疗是内科治疗和肝移植以外的另一重要治疗手段[2]。目前研究认为,终末期肝病模型(MELD)评分对ACLF患者短期或长期生存率有较准确的预测价值[3,4],但亦有研究认为其对人工肝血浆置换治疗预后的判断并不理想[5],临床实践发现,人工肝血浆置换治疗后血浆总胆红素(TBIL)水平即有明显下降,但随着血管内外的胆红素重新分布,出现不同程度的反弹,推测TBIL的水平变化与其预后可能相关。2017年10月,我们探讨了总胆红素反弹率(TBRR)、总胆红素清除率(TBCR)、总胆红素存留率(TBARR)在人工肝血浆置换治疗后ACLF患者预后评估中的作用。
1 资料与方法
1.1 临床资料 选取2014年10月~2017年5月在阜阳市第二人民医院肝病科治疗的乙型肝炎ACLF患者95例,男81例(85.3%)、女14例(14.7%),年龄24~73(48.73±10.97)岁。均符合中国《肝衰竭诊疗指南》(2012年版)的慢加急性肝衰竭诊断标准[1]。排除合并其他肝炎病毒重叠感染,并排除合并有严重的心、肾、脑疾病、精神病史、自身免疫性肝病等疾病。
1.2 治疗方法 患者均予以抗乙肝病毒治疗,选用药物为拉米夫定或恩替卡韦,同时予还原型谷胱甘肽、异甘草酸镁等保肝、支持等综合治疗,并积极防治各种并发症。患者均行血浆置换治疗:以右颈内或股静脉置管的方式建立血液通路,应用珠海弘陞公司HF400多功能血液净化治疗装置进行血浆置换,每次补充新鲜血浆2 000~3 000 mL,两次人工肝血浆置换时间间隔2~3 d。
1.3 观察指标 患者年龄、性别,入院时未予治疗前血常规、生化、凝血功能指标、并发症。计算MELD分值和Child-Turcorto-Pugh (CTP)评分。MELD分值参考文献[6]方法计算。Child-Turcotte-Pugh分级方法参照Child-Turcotte-Pugh评分分级[7]。根据首次血浆置换治疗前后血清TBIL水平计算TBCR、TBARR、TBRR并进行相关分析。计算公式:TBCR=(术前TBIL-术后首次TBIL)/术前TBIL×100%,TBARR=术后第3天TBIL/术前TBIL×100%。TBRR1=(术后第2天TBIL-术后首次TBIL)/术后首次TBIL×100%,TBRR2=(术后第3天TBIL-术后首次TBIL)/术后首次TBIL×100%。术后首次TBIL为人工肝治疗结束时静脉采血结果。观察患者在首次人工肝治疗后3个月内的病情转归情况,比较生物化学指标,包括丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、白蛋白(ALB)、前白蛋白(PALB)、TBIL、直接胆红素(DBIL)、碱性磷酸酶(ALP)、血尿素氮(BUN)、肌酐(CR)、血糖(GLU)、总胆固醇(CHO)、国际标准化比值(INR)、凝血酶原时间(PT)。

2 结果
2.1 存活与死亡者生物化学指标基线比较 存活60例(存活组),年龄(47.8±11.3)岁,ALT为(522.9±489.4)U/L;死亡35例(死亡组),年龄(50.4±11.7)岁,ALT为(359.7±382.9)U/L。死亡组总胆红素、PT、INR均高于存活组(P均<0.05),余指标未见统计学差异,见表1。
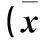
表1 存活组与死亡组患者生物化学指标基线比较±s)
注:与死亡组相比,*P<0.05。
2.2 两组各种评价指标比较 存活组与死亡组TBARR、TBRR1、TBRR2、TBCR、CTP、MELD比较差异有统计学意义(P均<0.05),见表2。
2.3 各种评价指标对ACLF短期预后预测的价值比较 CTP、TBARR、TBRR1、TBRR2、TBCR、MELD预测ACLF预后的AUC分别为0.848、0.641、0.693、0.737、0.678、0.719,均有预测价值。因AUC<0.7去除TBARR、TBRR1、TBCR,CTP、TBRR2、MELD均有良好的预测价值(AUC)>0.7。CTP与MELD (Z=1.865,P=0.062)、TBRR与CTP(Z=1.536,P=0.125)、TBRR与MELD(Z=0.245,P=0.806)的AUC比较,差异均无统计学意义(P均>0.05)。ROC曲线见图1。
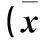
表2 存活组与死亡组各项评价指标比较±s)
注:与死亡组相比,*P<0.05。
2.4 TBRR与病死率情况 根据术后第3天TBRR分为3组,TBRR<0.5为Ⅰ组,存活33例,死亡9例,病死率21.4%;TBRR值0.5~1.0为Ⅱ组,存活22例,死亡10例,病死率31.3%;TBRR>1.0为Ⅲ组,存活5例,死亡16例,病死率76.2%。Ⅲ组与Ⅰ、Ⅱ组病死率比较差异有统计学意义(χ2=17.54,P<0.05;χ2=10.25,P<0.05)。
2.5 评价指标对ACLF短期预后预测的最佳诊断界值 以约登指数最大所对应的值为最佳诊断界值,CTP评分、TBRR、MELD评分的最佳临界值分别为11分(灵敏度68.57%,特异度88.33%)、85%(灵敏度56.5%,特异度88.33%)、23.64分(灵敏度56.5%,特异度73.33%)。约登指数分别为0.569、0.426、0.376。TBRR联合CTP评分预测ACLF预后的灵敏度86.3%,特异度78%,TBRR联合MELD评分预测ACLF预后灵敏度81.1%,特异度64.7%。
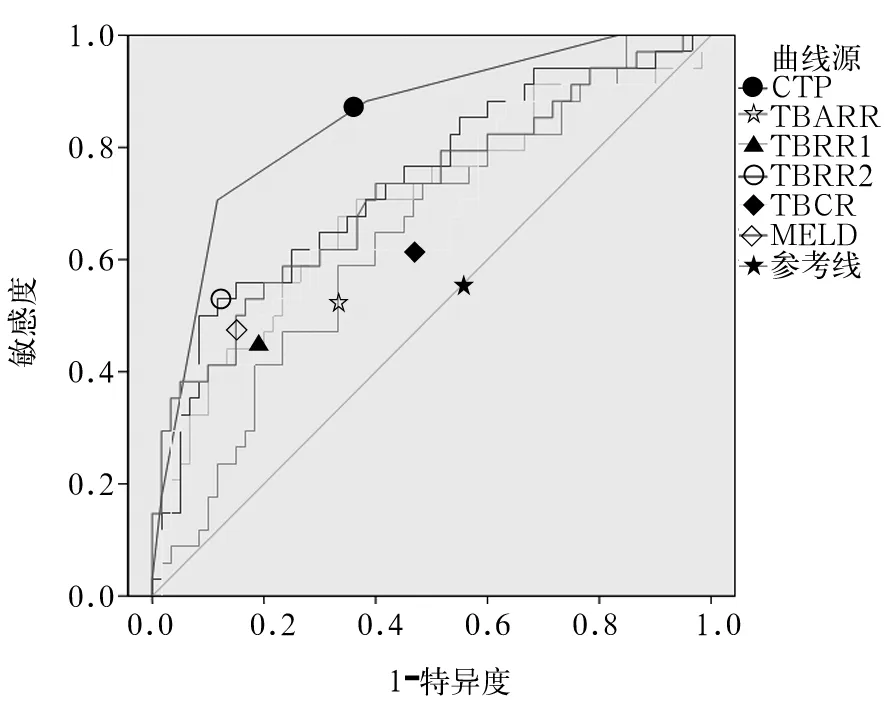
图1 评价指标预测ACLF预后的
3 讨论
ACLF导致的病死率较高,是临床治疗的难点。肝移植是治疗肝衰竭的有效治疗方案,但由于肝源有限及费用昂贵,不能成为主流治疗手段。人工肝血浆置换治疗不仅能清除肝衰竭患者血液中大量的胆红素、内毒素等内源性毒素,亦能清除免疫复合物、大分子物质、炎性因子等,同时补充患者缺乏的凝血因子、白蛋白等,为肝细胞再生创造较好的内环境,可有效促进肝衰竭患者的病情恢复,目前应用较广泛[8]。由于血浆资源短缺及费用昂贵的问题,制约了血浆置换技术的开展,如能在人工肝治疗前或治疗的早期阶段对疾病预后做出初步评判,则对于临床治疗选择及医疗资源分配有重要意义[9]。
死亡组治疗前TBIL水平高于存活组,差异有统计学意义,提示基线TBIL水平是判断预后的独立危险因素。经人工肝血浆置换治疗后,患者血液中的胆红素水平可快速下降,本研究中患者的血清TBIL下降水平为治疗前50%~60%,与文献报道相符[10],存活组与死亡组的TBCR均数分别为42.53%和48.54%,两者相比虽有差异,但AUC为0.678,提示预测价值较小。由于人工肝治疗后体液中的TBIL与血液中的TBIL通过交换达到新的平衡,因此大部分患者短期内TBIL即有不同程度的反弹。根据人工肝血浆置换前后胆红素的水平变化创建的简易评价指标TBARR、TBRR、TBCR对于ACLF均有一定预测价值,以TBRR的预测价值最高。文献报道,人工肝术后TBRR与预后之间存在负相关[11],即反弹率越高(>40%),预后越差。本研究发现应用术后第3天的TBIL水平计算TBRR价值最高,死亡组与存活组相比,前者的TBRR明显高于后者,TBRR大于100%者病死率高达76.2%,<50%者病死率仅21.9%,两者相比有统计学差异。应用ROC曲线和AUC评估各个指标预测ACLF预后的价值,TBRR与MELD及CTP评分系统的AUC均>0.7,TBRR的AUC略高于MELD,两两相比,AUC差异无统计学意义,提示TBRR对于ACLF短期预后有临床预测价值。依据本研究结果,笔者认为对于人工肝治疗后低TBRR,且未合并严重并发症者,可暂不采用血浆置换治疗,以节约医疗资源。
目前有多项研究提示MELD、CTP等多项预后模型对ACLF短期及长期的生存预后有较准确的预测价值[12]。MELD评分纳入的主要因素为TBIL、Cr、INR,忽略其他并发症的指标,而非生物型人工肝治疗对于TBIL及Cr有较好的清除作用,故MELD评分对应用人工肝治疗的HBV感染引起的ACLF生存预后评估有一定局限性。文献报道CTP评分对于ACLF的预测价值相对偏低[3],但本研究发现对于应用人工肝治疗的ACLF患者该评分系统有较高的预测价值,说明ACLF合并多种并发症是其预后差的关键原因,CTP评分的缺点是肝性脑病、腹水等指标需主观判断,且不能对显著异常的实验室指标进行评价。TBRR评价指标主要为TBIL变化,不受主观因素影响,计算简单,且可多次计算,动态评价人工肝治疗效果。但TBRR作为一种短期的预后评价指标,易受血浆置换量、综合支持治疗等因素的影响。本研究中,单独应用TBRR评估应用人工肝治疗的HBV感染引起的ACLF生存预后的灵敏度56.5%,特异度88.33%,TBRR联合CTP评分的灵敏度86.3%,特异度78%,TBRR联合MELD评分的灵敏度81.1%,特异度64.7%,提示TBRR联合MELD、CTP对ACLF的短期预后有较高的预测价值。
综上所述,TBARR、TBRR、TBCR对HBV导致的ACLF短期疗效有一定预测价值,其中以TBRR的预测价值最高。
