遮光对地被菊花色苷含量和CmUFGT基因表达的影响
2018-07-19杨中义尚嘉琪赵夏陆张春来吕晋慧
杨中义,尚嘉琪,赵夏陆,赵 靓,张春来,吕晋慧*
(1 山西农业大学 林学院,山西太谷 030801;2 山西农业大学 农学院,山西太谷 030801)
花色苷是高等植物体内主要的呈色物质,由一系列花色苷结构基因编码的关键酶所催化合成,其生物合成途径在矮牵牛、金鱼草、葡萄和玉米等模式植物中研究较为成熟[1],参与编码关键酶的结构基因主要有PAL(phenylalanine ammonialyase)、CHS(chalcone synthase)、CHI(chalcone isomerase)、F3H(flavanone3-hydroxylase)、DFR(dihydroflavonol4-reductase)、ANS(anthocyanidin synthase)及UFGT(flavonoid3-O-glucosyl-transferase)等,其中UFGT是植物花色苷生物合成所必需的[2]。蝴蝶兰红色花中UFGT表达丰度显著高于白色花[3]。蓝花龙胆中UFGT大量表达,且积累量显著高于白花龙胆[4]。孙磊[5]、Kobayashi等[6]和Boss等[7]在葡萄果皮中也有相似发现,黑果葡萄果皮中UFGT表达量显著高于白果葡萄。除遗传因素,植物花或果实的着色还受外部环境影响[8]。环境因子(光照[8-10]、温度[11-12]、紫外辐射[12]等)不仅影响花色苷生物合成速率,而且对其积累量和稳定性也有明显影响。其中,光照是影响紫马铃薯块茎花青素合成的重要因素,増加光照强度能够不同程度提高其花青素含量、花青素积累量及花青素合成关键酶活性[10]。遮光处理可导致葡萄果皮花色苷含量减少[13]。随着遮光率的升高,滇山茶花瓣花青素苷含量呈先升后降的变化趋势[14]。张孟夏[9]认为光照强度调控花色苷的合成,与其调控UFGT基因表达和UFGT酶活性相关。以上研究多集中于光在花色苷合成代谢途径的调控机制。花开放后期,光对花色苷的合成作用逐渐减弱,光是否导致花色苷降解以及遮光能否延缓花色苷降解尚无定论。因此,本研究以地被菊品种‘紫重楼’为试材,在花发育的不同时期对其进行不同程度的遮光处理,检测花色苷含量和UFGT结构基因的表达情况,分析光在花色苷合成和降解过程中的调控机制,旨在为进一步深入研究菊花花色苷代谢的分子调控机制奠定科学基础。
1 材料和方法
1.1 材料与处理
2014年5月将生长健壮、长势一致的地被菊(Chrysanthemummorifolium)品种‘紫重楼’按照株行距50 cm×50 cm定植于山西农业大学林学院林业站(Alt:803 m,E112°34′34″,N37°25′24″)试验田中,种植基质为沙壤土,正常水肥管理。其中,‘紫重楼’为山西农业大学培育的优良地被菊品种,株型紧凑、开花繁茂、花瓣紫色、重瓣性高,盛花期9月中旬。
分别于现蕾期(花蕾直径1~2 mm)、露色期(透过花蕾总苞可看到花朵颜色,即花序发育第3阶段)、盛花期(50%~70%的花序完全开放,即花序发育第5阶段)对植株进行遮光处理,使用不同透光率的黑色遮阴网进行遮光处理,遮光棚南北方向,高1.3 m,宽2.5 m,南北敞开,便于通风透气。遮光度通过增加遮阴网的层数来调整,并且用照度计测定。设置4种光环境梯度:L0(CK,全光照)、L1(1层遮阴网,80%全光照)、L2(2层遮阴网,60%全光照)和L3(3层遮阴网,40%全光照)。遮光处理时间为每天9:00~18:00,花衰败后停止处理,每处理20株,3次重复。期间各处理及对照的其他水肥管理相同。
根据韩科厅等[15]、尚嘉琪等[16]对菊花花序发育顺序的分级标准,将‘紫重楼’花序发育顺序分为8个阶段(图1),分别是(1)花蕾,直径0.5~0.6 cm;(2)花蕾,直径0.8~1 cm;(3)花蕾,直径1.0~1.2 cm,少数舌状花微伸出总苞;(4)舌状花完全伸出总苞,外轮舌状花充分着色,直立,未平伸;(5)2~3轮舌状花平伸;(6)4~6轮舌状花平伸;(7)7~9轮舌状花平伸;(8)中间管状花全部开放,舌状花褪色。
1.2 测定指标及方法
1.2.1叶绿素含量的测定盛花期随机取植株第3~4节位叶片,参照李合生等[17]方法测定叶绿素含量。
1.2.2干重和干重比的测定于处理前标记相同部位、大小一致的花蕾,遮光后,待花序发育至第8阶段,称量花序(舌状花、管状花和子房等)鲜重。在105 ℃烘箱中杀青15 min,80 ℃烘干至恒重,称量干重。干重比=干重/鲜重。
1.2.3花色苷含量的测定称取0.1 g舌状花,加入1 mL提取液(甲醇∶盐酸=99∶1,V/V),研磨成匀浆,定容至5 mL,振荡15 min,8 500×g离心15 min后,吸取上清液。以盐酸甲醇为空白对照,测定波长525 nm下提取液的吸光度(OD)。
计算公式[18]为:花色苷含量(mg/kg)=(100×A×Mw×DF)/ε×1
式中,A为吸光度;Mw为矢车菊素-3-葡萄糖苷分子量(449.2);DF为稀释倍数;ε为矢车菊素-3-葡萄糖苷的摩尔消光系数(取26 900);1为比色皿光程(1 cm)。
1.2.4可溶性糖含量的测定取不同花序发育阶段的舌状花,105 ℃杀青15 min,80 ℃烘干至恒重,釆用蒽酮比色法[17]测定可溶性糖含量。
1.2.5CmUFGT基因相对表达量的测定取0.1 g舌状花,液氮速冻,保存于超低温冰箱中备用。采用改良Trizol法[19]提取RNA,使用TaKaRa试剂盒Prime ScriptTMRT Master Mix反转录。以菊花Actin基因作为内参基因,引物为Actin-F(5′-CCAAAAGCCAATCGTGAGAAG-3′)与Actin-R(5′-CACCATCACCAGAATCCAACA-3′),采用TaKaRa SYBRTMPremix Ex TagTM Ⅱ试剂盒进行荧光定量PCR,对UFGT表达进行检测。引物为UFGT-F(5′-GCCTTGTTCGATGTTTCAGTG-3′)与UFGT-R(5′-AGATCACAGGGACTAGCAACC-3′),预测产物长度为166 bp,每个样3次重复。
1.3 数据分析
采用Excel 2010和SPSS 17.0等软件对数据进行统计分析和多重比较(LSD法)。不同大小写字母分别表示在P<0.01和P<0.05水平上差异显著。
2 结果与分析
2.1 遮光对‘紫重楼’叶片叶绿素含量的影响
现蕾期、露色期,L3处理下叶绿素a、b含量显著高于其他处理;盛花期,L1处理下叶绿素a、b含量极显著高于其他处理(表1)。现蕾期和露色期遮光处理下,叶绿素a、b含量随光照强度的降低而逐渐增加,且L1和L2处理间差异不显著。其中,露色期L1和L2处理下叶绿素a、b含量极显著高于L0,叶绿素a显著低于L3,叶绿素b极显著低于L3。盛花期,L1、L2和L3处理下叶绿素a、b含量显著高于L0。现蕾期各处理间Chla/b无显著差异。露色期和盛花期L1和L2处理下Chla/b差异不显著,但显著低于L0,其中盛花期L1、L2处理下Chla/b显著低于L3。

图1 地被菊‘紫重楼’头状花序不同发育时期分级[16]Fig.1 Developmental stages of chrysanthemum ‘Zichonglou’ capitulum[16]
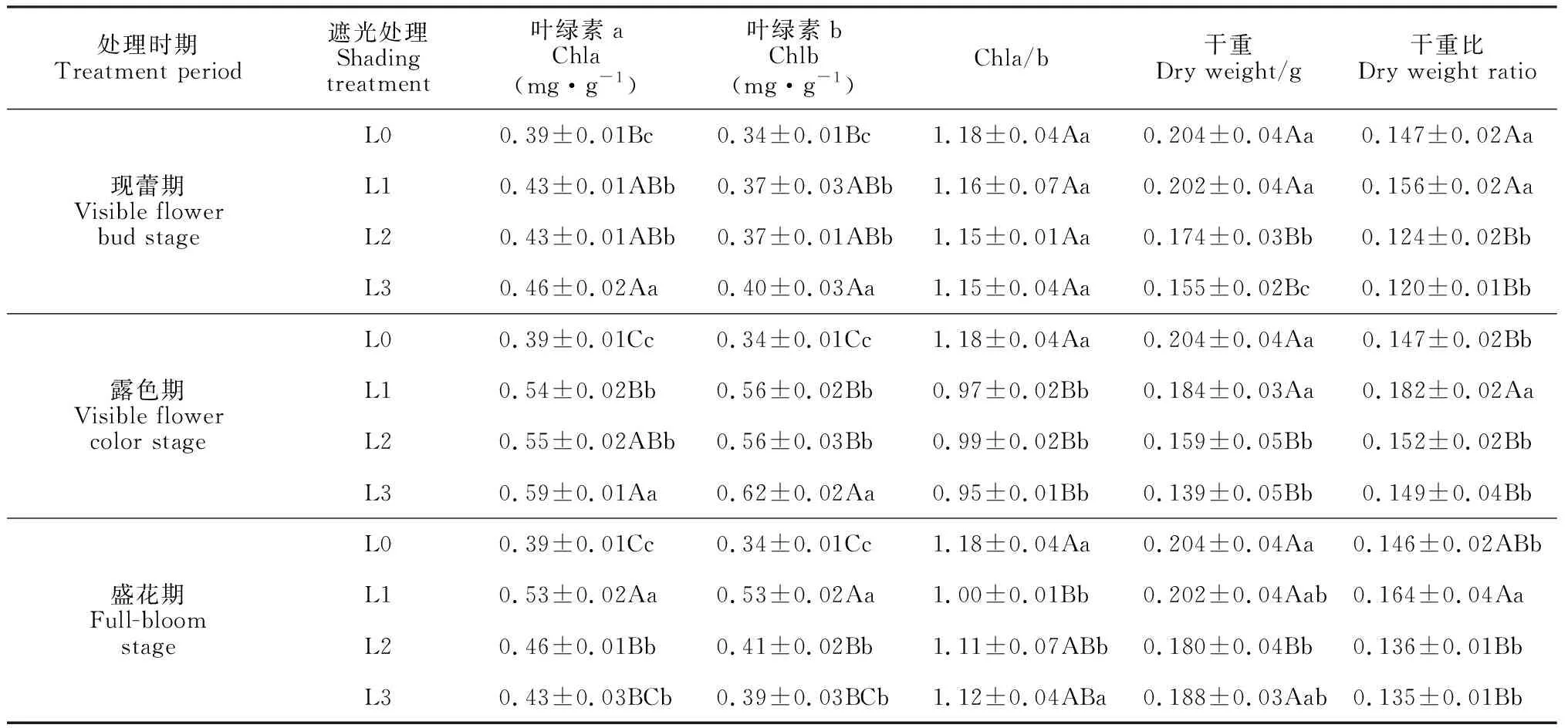
表1 不同时期遮光对叶片叶绿素含量及花序干重、干重比的影响
注:不同大(小)写字母表示不同时期遮光处理下差异显著性达0.01(0.05)水平Note: different capital (normal) letters, indicate the shading treatments at different florescence stages were significantly different at the 0.01 (0.05) level
2.2 遮光对‘紫重楼’花序干重、干重比的影响
随着光照强度的降低,花序干重呈下降趋势,花序干重比呈先升后降的趋势;不同时期遮光,L1处理下花序干重比增加(表1)。方差分析表明,现蕾期L0和L1处理下花序干重和干重比差异不显著,但极显著高于L2和L3。露色期和盛花期L0、L2和L3处理下花序干重比差异不显著,但极显著低于L1。露色期L0和L1处理下花序干重差异不显著,但极显著高于L2和L3。盛花期L0、L1和L3处理下干重差异不显著,但极显著高于L2。
2.3 遮光对‘紫重楼’不同发育阶段舌状花花色苷含量的影响
现蕾期、露色期遮光处理下花色苷含量随着花序发育呈先升后降趋势,盛花期遮光处理下呈下降趋势。花序发育第3、4阶段,光照越强花色苷含量越高;第7、8阶段,光照越弱花色苷含量越高(图4)。现蕾期,第3、4阶段遮光处理下花色苷含量降低;第5、6阶段L1处理下花色苷含量极显著高于其他处理;第8阶段遮光处理下花色苷含量显著高于L0(图2,Ⅰ)。露色期和盛花期,第8阶段遮光处理下花色苷含量极显著增加。露色期,第3至第6阶段花色苷含量随光照强度的降低而逐渐降低;第4阶段,L0处理下花色苷含量极显著高于其他处理;第5、6阶段,L0处理下花色苷含量极显著高于L3;第7阶段,L0、L1和L2处理下花色苷含量差异不显著,但极显著高于L3(图2,Ⅱ)。盛花期,第5、6阶段,L1处理下花色苷含量分别极显著、显著高于L0;第7阶段,L3处理下花色苷含量极显著高于其他处理(图2,Ⅲ)。
2.4 遮光对‘紫重楼’不同发育阶段舌状花可溶性糖含量的影响
遮光处理下舌状花可溶性糖含量随着花序发育总体呈先升后降趋势,L1处理下可溶性糖含量增加(图3)。
现蕾期,L1处理下可溶性糖含量高于L0。第1、2阶段,L1和L2处理下舌状花可溶性糖含量显著高于L0,L3处理下可溶性糖含量显著低于L0;第3阶段,L3处理下可溶性糖含量极显著低于L0,L1、L2处理下可溶性糖含量与L0差异不显著;第4阶段,L1处理可溶性糖含量极显著高于其他处理;第5至第8阶段,L1处理可溶性糖含量显著高于L0(图3,Ⅰ)。
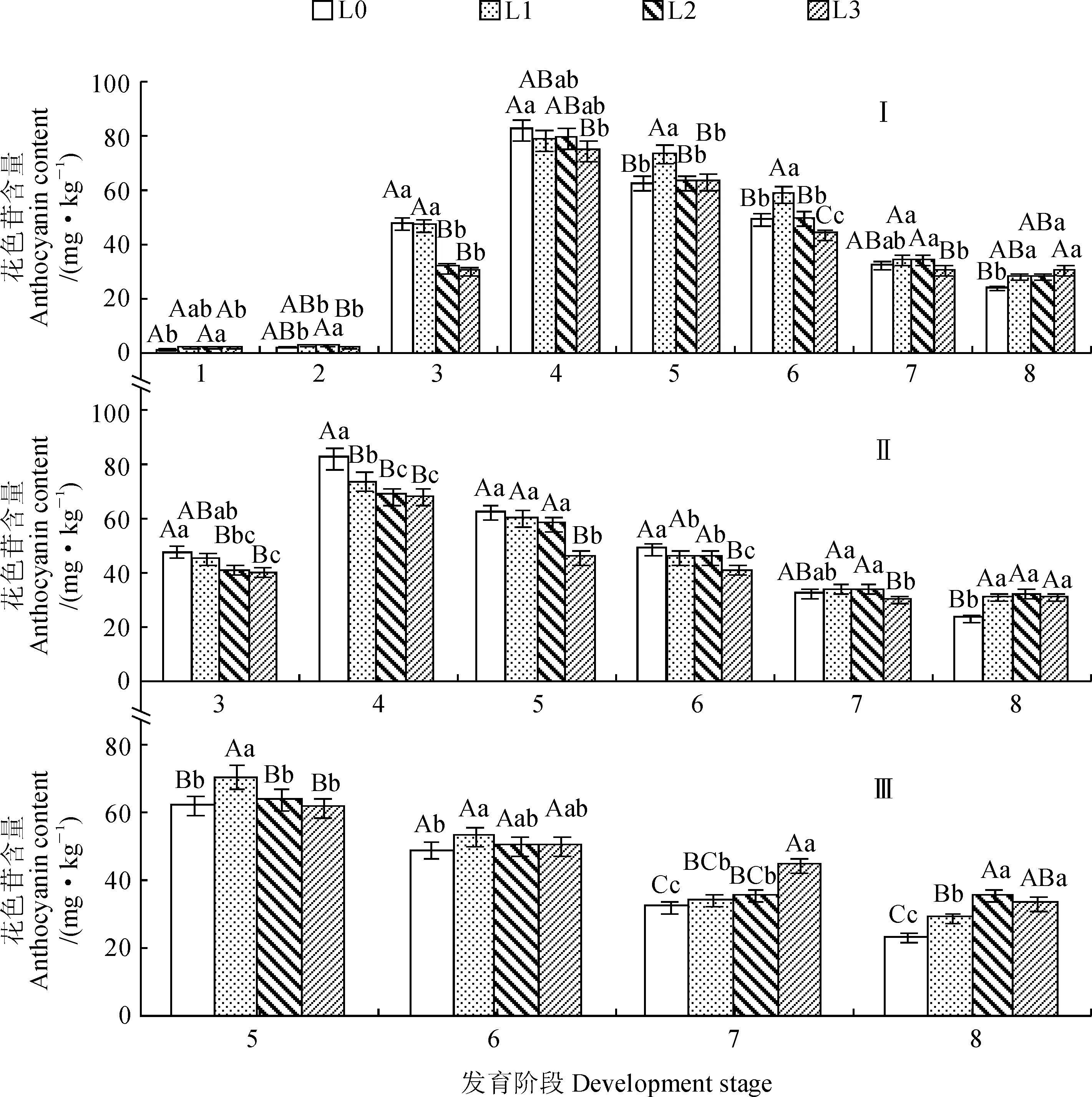
Ⅰ.现蕾期;Ⅱ.露色期;Ⅲ.盛花期遮光;1~8发育阶段同图1;不同大(小)写字母表示不同时期遮光处理下差异显著性达0.01(0.05)水平。下同图2 不同时期不同遮光处理对花色苷含量的影响Ⅰ.Visible flower bud stage;Ⅱ. Visible flower color stage; Ⅲ.Full-bloom stage; 1-8 Development stages are same as Fig.1; Different capital (normal) letters indicate the shading treatments at different florescence stages were significantly different at the 0.01 (0.05) level. The same as belowFig.2 The effect of shading at different stages on the anthocyanin content in each stage
露色期,第3阶段L0处理下可溶性糖含量极显著高于其他处理;第4至第8阶段,L1处理下可溶性糖含量显著高于其他处理(图3,Ⅱ)。
盛花期,第5阶段L2处理下可溶性糖含量显著高于L0;第6至第8阶段,L1处理下可溶性糖含量显著高于L0(图3,Ⅲ)。
2.5 遮光对‘紫重楼’舌状花CmUFGT表达的影响
现蕾期(图4,Ⅰ)、露色期(图4,Ⅱ)遮光处理下,花序发育第4阶段CmUFGT表达量显著高于其他阶段,其中L1处理下,第3、4阶段CmUFGT的表达量均降低;盛花期(图4,Ⅲ)遮光处理下,第5阶段CmUFGT表达量显著高于其他阶段。遮光处理极显著抑制花序发育第5阶段CmUFGT的表达,且表达量随着光照强度的降低而逐渐降低。
现蕾期(图4,Ⅰ)遮光处理下,CmUFGT的表达量随着花序的发育呈先升后降趋势。第1、2阶段,L3处理下CmUFGT基因表达量极显著高于其他处理;第3至第5阶段,CmUFGT的表达量随光照强度的降低逐渐降低,L0处理下CmUFGT表达量极显著高于其他处理;第6阶段L1和L2处理下CmUFGT表达量极显著高于L0和L3处理;第7阶段L0、L1处理下CmUFGT表达量极显著高于L2和L3;第8阶段L3处理下CmUFGT基因表达量显著高于其他处理。
露色期(图4,Ⅱ)遮光处理显著影响不同发育阶段CmUFGT基因表达。L0、L1和L2处理下CmUFGT表达量随着花序的发育呈先升后降趋势,L3处理下CmUFGT表达量呈下降趋势。第5阶段,CmUFGT基因表达量随着光照强度的降低呈下降趋势,且各处理间差异达极显著水平;第6、第8阶段L1处理下CmUFGT表达量极显著高于其他处理。

图3 不同时期不同遮光处理对可溶性糖含量的影响Fig.3 The effect of shading at different stages on the soluble sugar content in each stage
盛花期(图4,Ⅲ),L0处理下CmUFGT表达量呈下降趋势,L1处理下CmUFGT表达量呈先升后降再升的趋势,L2处理下CmUFGT表达量呈先降后升趋势,L3处理下CmUFGT持续低水平表达。第5至第7阶段,遮光处理极显著抑制CmUFGT表达,L1、L2、L3处理下CmUFGT表达量极显著低于L0;第8阶段,L1处理下CmUFGT表达量极显著高于其他处理。
3 讨 论
花色素在植物体内极不稳定,糖基化修饰能够提高其稳定性[20]。UFGT基因调控花色素糖基化[21]。UFGT酶是光调节酶[22],UFGT基因的表达受光调节[23]。本研究中,现蕾期遮光处理下,花序发育第1、2阶段L3处理下CmUFGT基因表达量极显著高于其他处理,可能与低光胁迫诱导CmUFGT基因表达有关[24]。这说明花序发育前期重度遮光极显著促进CmUFGT基因表达。第3至第5阶段 L0处理下CmUFGT表达量极显著高于其他处理,说明花序发育中期遮光极显著抑制CmUFGT基因表达。露色期遮光处理下,第4、5阶段CmUFGT表达量极显著降低,花色苷含量降低,说明CmUFGT的表达与花色苷的积累密切相关[4,21]。这与张孟夏[9]、吴翠平等[10]、韩科厅等[15]的研究结果一致。盛花期遮光处理下,第5至第7阶段CmUFGT基因的表达极显著低于L0,但花色苷含量变化与之相反。这可能是花发育后期CmUFGT基因表达下调,花色苷合成减少,花色苷降解加快,但遮光形成的低温环境延缓了花色苷的降解,因此花色苷含量高于全光照。
花色苷是花色素与糖以糖苷键结合而成的一类化合物[25]。凡能导致细胞中糖分积累的因素都在不同程度上促进花色苷的合成[23]。光为光合作用提供能量。同时,植物通过调整叶绿素含量以适应不同强度的光照[26]。本研究中现蕾期、露色期遮光处理下叶绿素a、b含量显著增加,Chla/b值降低,有利于光合作用的进行。究其原因,可能是植物对遮光胁迫的生态适应。这也与侯兴亮等[27]、周翠丽[28]的研究结果一致。同时遮光降低了试验区域小环境的温度,植物呼吸速率下降,碳水化合物的消耗减少,有利于糖分的积累。因此现蕾期、露色期遮光处理下可溶性糖含量高于L0。不同时期遮光,L1处理下花序干重比、可溶性糖含量均增加,说明轻度遮光有利于可溶性糖的积累。糖的积累,可诱导多种花色苷生物合成相关酶基因的表达[29],为花色苷的形成提供能源和前体物质[30],进而促进花色苷合成。张超等[31]和程怡[32]认为花瓣可溶性糖含量与花色苷含量呈正相关。本研究中,随着花序的发育,花色苷含量和可溶性糖均呈先升后降趋势,但可溶性糖含量峰值滞后,在舌状花完全展开时可溶性糖含量达到最高,与菊花品种‘丽金’花序发育过程中还原糖含量的变化趋势相同[33]。可能是菊花头状花序开放的过程中,花序内不同轮舌状花处于不同的发育阶段,花色苷的合成和降解同时存在,而不同轮舌状花在发育过程中可溶性糖含量不断积累,最终导致可溶性糖含量峰值滞后。

图4 不同时期不同遮光处理对CmUFGT基因表达的影响Fig.4 The effect of shading at different stages on the expression of CmUFGT in each stage
光是影响花色苷积累的重要环境因子,在大多数植物组织细胞中花色苷的合成受光调节,强光有利于花色苷的合成[34]。菊花花发育早期是感受光诱导的关键阶段[33]。本研究中‘紫重楼’花发育第3、4阶段,光照越强花色苷含量越高;第7、8阶段,光照越强花色苷含量越低。表明花序发育中期强光照有利于花色苷的合成,花序发育后期弱光有利于缓解花色苷的降解。Fukuoka N等[35]认为夏季高温导致紫背天葵叶花色苷含量降低。胡可[11]认为高温导致菊花花色苷降解。本研究中,‘紫重楼’花序发育后期,遮光延缓了花色苷的降解,是由于遮光降低了花序生长微环境中的气温,进而降低了花色苷降解酶的活性,同时降低了呼吸作用,减少了碳水化合物的消耗,延缓了花色苷降解。遮光不能完全抑制花色苷的降解,只能延缓其降解,说明在花开放的过程中,花色苷降解是不可避免的,植物体自身生理生化发生变化导致花色苷含量减少,是植物体的一种调节机制。花色苷是植物体内重要的次生代谢物,具有很高的生物活性,花色苷极可能降解成其他有利于植物生长或参与其它代谢的物质。
综上所述,地被菊开花过程中,花序不同发育期遮光处理显著或极显著影响CmUFGT基因表达;轻度遮光(L1)促进可溶性糖含量增加,花序干重比增加;花发育中期(第3、4阶段)轻度遮光(L1)有利于花色苷的合成,花发育后期(第7、8阶段)重度遮光(L3)有利于缓解花色苷的降解。
