外源硅对甘蓝镉毒害的缓解机制研究
2018-07-19杨文嘉王庆亚孙建云
杨文嘉,王庆亚,孙建云
(南京农业大学 生命科学学院,南京 210095)
近年来,随着中国工业化与城市化进程的加快,制革、冶铁等行业迅速发展,随之产生的重金属(镉、铬等)经由废水大量排放到自然环境中,造成土壤重金属污染问题日趋严重。而所有的污染金属元素中,Cd是一种移动性强、毒性高的重金属元素,它不仅会影响作物的生长发育和品质,还会通过食物链的富集作用危害人体健康,因而备受关注[1]。目前,Cd已被世界卫生组织、联合国国际环境规划署、国际劳动卫生重金属委员会等列为优先研究的环境和食品污染物[2]。据报道,中国已被Cd污染的农田面积涉及11个省市的25个地区,达2.8×105hm2,进而产生的Cd超标农产品每年可达1 460万吨[3]。
当作物体内的Cd达到一定浓度时,会产生毒害作用,主要影响其生理代谢,并且能够影响农产品中氨基酸、蛋白质和淀粉等营养物质的含量,同时重金属残留在农产品中,其质量和作物的经济价值必然下滑[4]。十字花科芸薹属植物中的某些可食用蔬菜品种,对重金属具有超强的吸收积累能力[5]。其中,甘蓝是中国重要的蔬菜之一,全国各地都有栽培。因此,有效缓解Cd对甘蓝生长的毒害和降低其可食用部分Cd含量措施的研究显得尤为迫切,但这方面的研究目前还较为匮乏。Si是土壤中丰度最高的元素,其是否为植物生长所必需的营养元素还有待进一步研究。已有大量研究表明,外源添加适宜浓度的Si可显著增强植物抵御生物及非生物胁迫的能力[1,6-9]。如,Si能减少盐胁迫下植物中Na+的含量以减轻离子的毒害[6]; Si可通过促进植物生长,局部化和钝化重金属离子,缓解重金属对植物的毒害[7];Si能够显著增强Cd胁迫下水稻的抗氧化能力,减轻氧化损伤[8];也有研究表明,在锰胁迫下,外施Si可以提高黄瓜幼苗的光合机构自我保护能力,增强叶片的光合速率[9]等。这说明Si对植物Cd毒害有一定的缓解作用。
本实验以2个耐Cd性不同的甘蓝品种‘绿丰’(Cd敏感性)和‘牛心’(Cd耐性)为材料,研究了Si对Cd毒害下甘蓝某些生理反应的影响,以期明确它在控制Cd毒害和减少Cd吸收上的潜在作用。
1 材料和方法
1.1 植物培养及处理
根据前期的品种及处理浓度的筛选结果,以甘蓝品种‘牛心’(Cd耐性)和‘绿丰’(Cd敏感性)为材料,甘蓝种子经5% NaClO消毒5 min后,用去离子水反复洗净,25 ℃避光萌发,露白后于25 ℃蛭石上发芽,正常光照,播种7 d后移至装有5 L营养液的周转箱中培养。先用1/4 Hoagland营养液培养4 d,再用1/2 Hoagland营养液培养6 d,此后用全营养液培养,每2 d更换1次营养液,自然光照。经过比对其他文献中的Cd浓度并且根据前期的Cd浓度筛选实验,发现在50 μmoL/L Cd胁迫程度为中度,与较高或较低浓度的Cd处理相比,外源Si的缓解效果最好,因此本实验选用此 Cd浓度。幼苗长至五叶一心后,设置3组处理:0(CK)、50 μmol·L-1Cd(Cd)、50 μmol·L-1Cd + 1.2 mmol·L-1Si(Cd+ Si),每处理重复3次。其中,Cd以CdCl2·2.5H2O形式供给,Si以Na2SiO3·9H2O形式供给,且营养液pH在 6.0左右。水培营养液为Hoagland溶液,其组成为:2.5 mmol·L-1Ca(NO3)2、2.5 mmol·L-1KNO3、1 mmol·L-1MgSO4、0.5 mmol·L-1KH2PO4、20 μmol·L-1Fe-EDTA、46 μmol·L-1H3BO3、0.32 μmol·L-1CuSO4、0.71 μmol·L-1ZnSO4、11.1 μmol·L-1MnCl2、0.38 mmol·L-1H2MoO4。幼苗共计处理12 d后取样进行相关指标的测定。
1.2 测定项目及方法
1.2.1干重处理结束时,每处理分别取4株,并置于10% EDTA-Na2溶液中浸泡30 min,取出,用去离子水清洗干净,将地上部和根系分开,105 ℃杀青30 min,70 ℃烘干植株至恒重,分别称取根系与地上部干重。用抑制率表示植株生长受抑的程度,计算公式如下:
抑制率(%)=[1—(处理组干重/ CK组干重)]×100%。
1.2.2Cd及营养元素含量准确称取0.5 g植物样品,加入硝酸和双氧水混合液(V∶V=4∶1)过夜,次日置于消煮炉中消煮,用电感耦合等离子体发射光谱仪 (ICP) 测定Cd、Mg、Fe、Mn、Cu元素含量。
1.2.3叶绿素含量叶绿素含量按蔡庆生的方法[10]。准确称取0.2 g 叶片鲜样,加入95%乙醇及石英砂和碳酸镁粉研磨至匀浆,再加96%的乙醇10 mL,继续研磨至组织变白,静置3~5 min。取滤纸置漏斗中,用96%乙醇湿润,将研磨后的液体及残渣倒入漏斗中,收集置容量瓶中,且将滤纸上的叶绿体色素全部洗入容量瓶中,最后用96%乙醇定容至25 mL,摇匀。分别测定A645、A663。按下列公式计算叶绿素含量:
叶绿素a(mg·g-1)=(12.71A663—2.59A645)×V/1 000W;
叶绿素b(mg·g-1)=(22.88A645—4.67A663)×V/1 000W;
式中,V为提取液体积(mL);W为材料鲜质量(g)。
1.2.4光合参数在对甘蓝进行处理的前1天起,每隔2 d测定1次,直至第12天。取甘蓝功能叶采用Li-6400便携式光合作用测定仪测定净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)及胞间二氧化碳浓度(Ci)。每次测定选择叶片的相同位置,且测定条件一致。
1.2.5叶绿素荧光参数取相同叶位采用Li-6400便携式光合仪进行测定。将植株充分暗适应,用弱测量光测定初始荧光(Fo)、最大荧光(Fm)及原初光能转化效率(Fv/Fm)。在天气晴朗的上午,持续照射得到稳态荧光(Fs)、光下最大荧光(Fm′)、光下最小荧光值(Fo′)及激发能捕获效率(Fv′/Fm′)。进一步计算光系统Ⅱ(PSⅡ)的实际光化学效率(ΦPSⅡ)、光化学淬灭系数(qP)。
1.2.6MDA含量分别准确称取0.3 g植物样,置于研钵中加入1%三氯乙酸(TCA) 3 mL,冰上研磨成匀浆转移至10 mL离心管中,12 000 g离心15 min。MDA含量的测定按Tripathi等[11]的方法。取上清液0.5 mL于干净试管中加入1.5 mL 0.5%硫代巴比妥酸(TBA),摇匀后,90 ℃水浴20 min,冷却至室温,以10 000 g离心5 min,取上清测532、600、450 nm处的吸光值。
1.2.7抗氧化酶活性取0.5 g植物样,加5 mL酶提取液 (0.1 mol·L-1、 pH7.0磷酸缓冲液,20 mmol·L-1EDTA,10% pvp,去离子水),冰浴研磨,4 ℃冷冻离心 (12 000 g, 15~20 min),取上清液作为测定粗酶液。超氧化物歧化酶(SOD)、愈创木酚过氧化物酶(POD)、谷胱甘肽还原酶(GR)及抗坏血酸过氧化物酶(APX)的测定采用Ali等[12]的方法。
SOD 活性采用氯化硝基四氮唑蓝(NBT)光化还原法测定;POD 活性采用愈创木酚法测定;GR活性测定时,取上清液200 μL,加入反应液(1.5 mL 0.1 mol·L-1PBS (pH7.8),0.3 mL 20 mmol·L-1EDTA-Na2, 0.3 mL 5 mmol·L-1GSSG, 0.3 mL 1.5 mmol·L-1NADPH, 450 μL去离子水),测定340 nm处的吸光值。APX活性测定时,取上清液50 μL,加入反应液[1.5 mL 0.1 mol·L-1PBS (pH7.0),15 μL 100 mmol·L-1ASA, 30 μL 30% H2O2, 1 405 μL去离子水],测定290 nm处的吸光值。过氧化氢酶(CAT)活性的测定采用Batool等[13]的方法,取上清液100 μL,加入反应液[1.5 mL 0.1 mol·L-1PBS (pH7.0), 10 μL 30% H2O2, 1 390 μL去离子水],测定240 nm处的吸光值。
1.3 数据分析
用Office 2010对实验数据进行处理;使用SPSS 20.0对数据进行方差分析,采用Duncan’s新复极差法进行差异显著性检验(α=0.05)。利用Office 2010、Origin 8.0制作图表。
2 结果与分析
2.1 外源Si对Cd胁迫下甘蓝幼苗生物量的影响
如图1所示,与CK(对照)相比, Cd处理(单独Cd胁迫)显著降低了2品种甘蓝植株的生物量(P<0.05),敏感性品种‘绿丰’的地上部和根系干重的抑制率分别为28.4%、28.2%,耐性品种‘牛心’抑制率则分别为19.9%、21.1%,证实‘绿丰’对Cd胁迫更为敏感。与Cd处理相比,Cd+Si处理(外源Si与Cd同时处理)显著提高了两品种的生物量 (P<0.05),但仍均显著低于对照,品种‘绿丰’的地上部、根系干重的抑制率分别降低了14.8%、13.8%,品种‘牛心’的抑制率则分别降低了9.3%、11.3%。以上结果说明Cd胁迫显著抑制了甘蓝的生长,Cd敏感性品种受到抑制更严重;外源Si能够显著缓解镉胁迫的伤害,敏感性品种效果更明显。
2.2 外源Si对Cd胁迫下甘蓝幼苗Cd含量及其转运系数的影响
由表1来看,与Cd处理相比,Cd+Si处理显著降低了2个品种甘蓝地上部的Cd含量,却大幅度显著提高了根系Cd含量,‘绿丰’和‘牛心’地上部Cd含量分别减少了17.1%和20.8%,它们根系Cd含量分别增加了84.7%和114.1% (P<0.05);品种间相比较,Cd和Cd+Si处理的‘绿丰’地上部Cd含量均显著高于‘牛心’,而其根系Cd含量却均显著低于‘牛心’ (P<0.05)。同时,与Cd处理相比,Cd+Si处理显著降低了2个品种的Cd离子转运系数,且‘牛心’降低的幅度显著高于‘绿丰’ (P<0.05) ;‘绿丰’的Cd离子转运系数在Cd和Cd+Si处理下均显著高于相应的‘牛心’。可见,外源Si可以显著降低Cd胁迫下甘蓝地上部的Cd含量,却显著大幅度提高了甘蓝根系Cd含量,致使Cd转运系数显著降低,且耐性品种升降幅度更大。
2.3 外源Si对Cd胁迫下甘蓝幼苗营养元素含量的影响
表2显示,与CK相比,Cd处理显著降低了两品种甘蓝根系Fe、Mn、Cu的含量及其地上部Mg、Fe和Mn的含量,且‘绿丰’的降幅显著高于‘牛心’(P<0.05);与Cd处理相比,Cd+Si处理显著增加了‘绿丰’地上部Mg、Fe、Cu的含量和‘牛心’地上部Mg、Cu的含量 ,但仍大多显著低于相应CK,且品种间差异显著(P<0.05),同时外源硅却对2个品种根系营养元素含量基本无显著影响。即Cd胁迫降低了甘蓝叶片和根系Fe、Mn等元素的含量,外源Si能有效缓解这种降低趋势。
2.4 外源Si对Cd胁迫下甘蓝幼苗光合作用的影响
2.4.1光合色素含量由表3可知,与CK相比,Cd处理显著降低了2个品种甘蓝叶片的叶绿素a、叶绿素b、总叶绿素及类胡萝卜素的含量,且‘绿丰’的降幅显著高于‘牛心’(P<0.05);与Cd处理相比,Cd+Si处理显著提高了两品种叶绿素a、叶绿素b、总叶绿素及类胡萝卜素(‘牛心’除外)的含量,且‘绿丰’增高的幅度明显高于‘牛心’(P<0.05)。可见,Cd胁迫显著降低甘蓝叶片光合色素含量,但在外源Si作用下得到有效缓解,且敏感品种升降幅度更大。
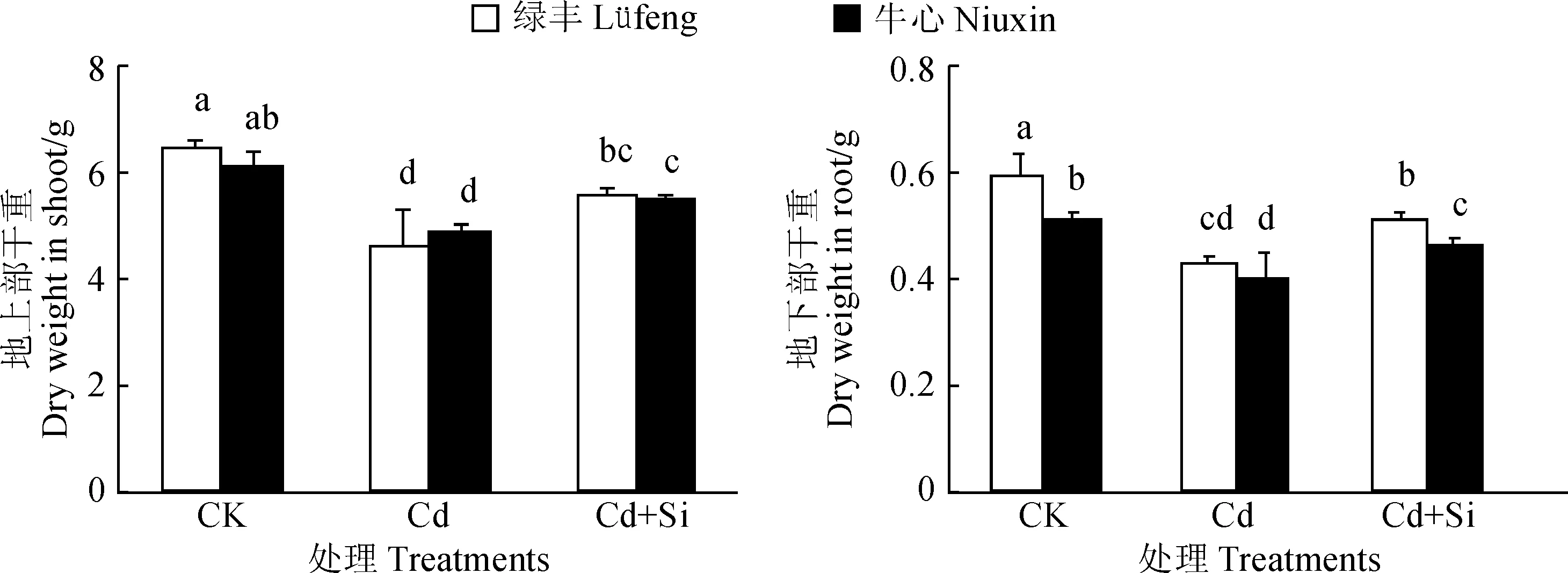
CK. 对照; Cd. 50 μmol·L-1 Cd; Cd+Si. 50 μmol·L-1 Cd + 1.2 mmol·L-1 Si;不同小写字母表示处理和品种间在0.05水平存在显著性差异;下同图1 外源Si处理对Cd胁迫下甘蓝幼苗生物量的影响CK. Control; Cd. 50 μmol·L-1 Cd; Cd+Si. 50 μmol·L-1 Cd + 1.2 mmol·L-1 Si; The different normal letters indicate significant difference among cultivars and treatments at 0.05 level. The same as belowFig.1 Effects of exogenous Si on biomass of cabbage seedlings under Cd stress
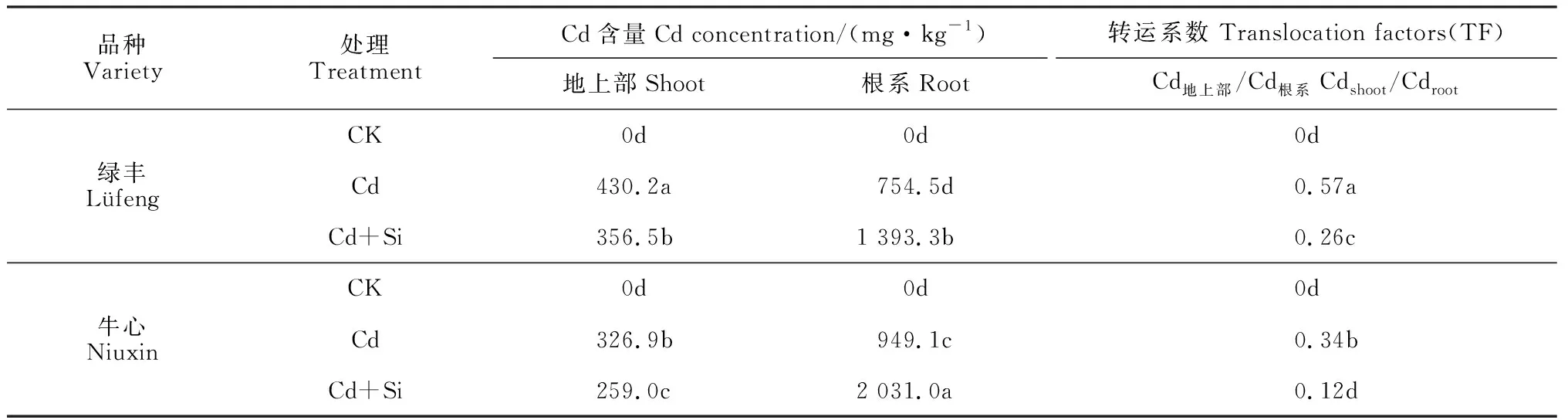
表1 Si对Cd胁迫下甘蓝幼苗地上部、根系的Cd含量和Cd的转运系数的影响
注: “0”表示没有检测到;每列中不同字母表示品种和处理间在0.05水平上达显著性差异,下同Note:“0” is not detectable. Different normal letters in each column indicate significant difference among treatments and varieties at 0.05 level,the same as below
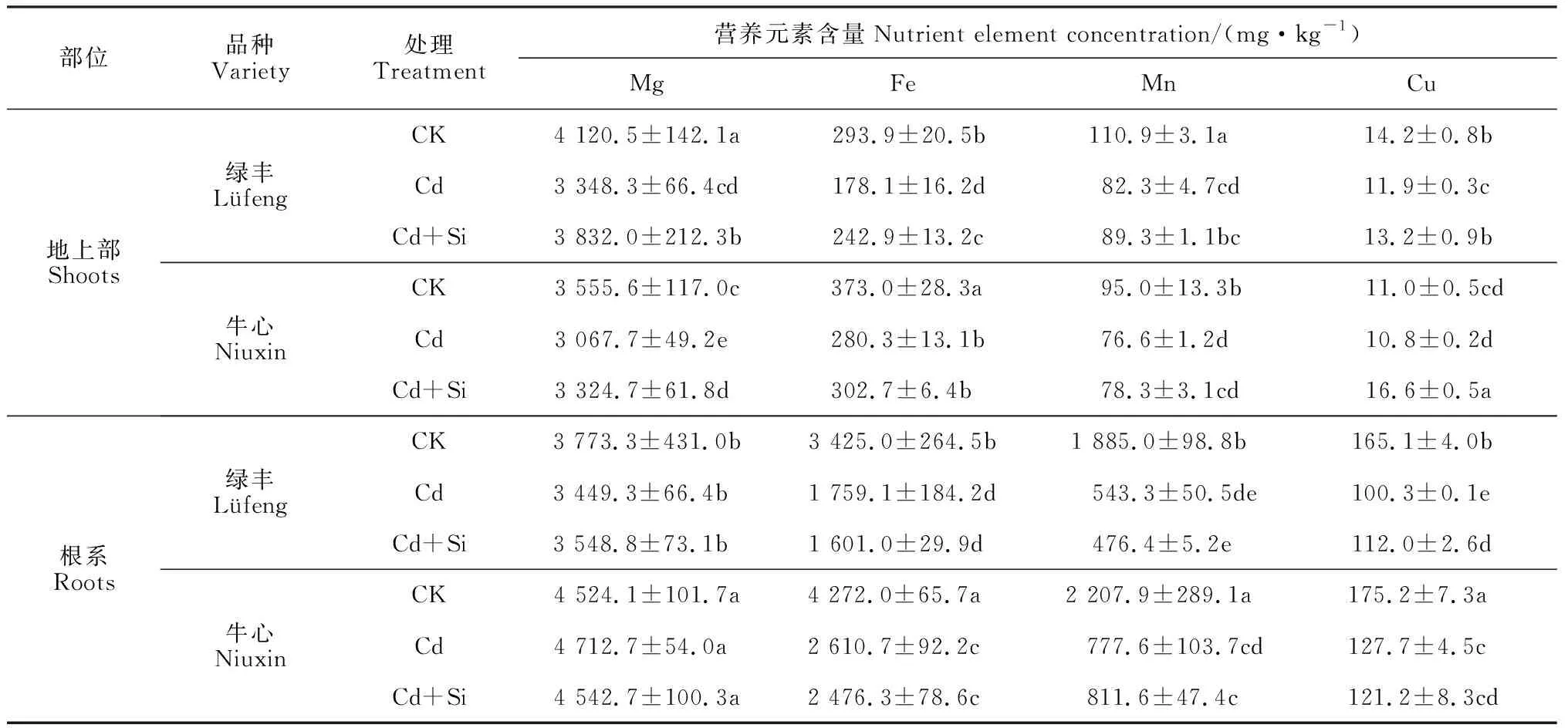
表2 外源Si对Cd胁迫下甘蓝幼苗地上部和根系内营养元素含量的影响
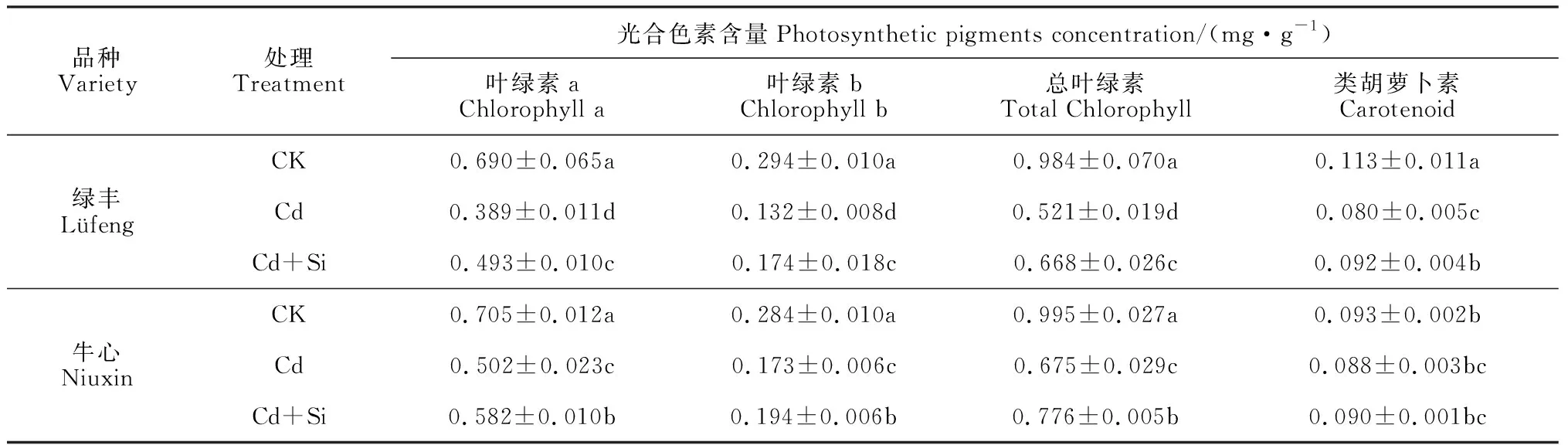
表3 外源Si对Cd胁迫下甘蓝幼苗叶片光合色素含量的影响
2.4.2光合参数图2显示,在Cd处理条件下,2品种甘蓝叶片Pn、Gs和Tr随着Cd处理时间的延长整体呈下降趋势;至Cd处理第12 天,‘绿丰’品种各参数比对照的降幅明显高于‘牛心’(P<0.05)。在Cd+Si处理条件下,2个品种叶片的Pn、Gs和Tr在整个处理过程中均始终高于同期的Cd 处理组,但各参数仍明显低于同期对照。与以上参数表现不同,在Cd胁迫条件下,2个品种甘蓝叶片的Ci随处理时间的延长呈先降后升的趋势。其中,‘牛心’和‘绿丰’品种叶片Ci分别在处理第3 天和第6 天时降至最低值,至处理第12 天均高于对照水平,但‘绿丰’Ci下降和升高的幅度均显著高于同期‘牛心’(P<0.05)。与Cd处理相比,在Cd+Si处理后,2个甘蓝品种的Ci随着处理时间的延长,其比对照降低和升高的幅度均有所减小,且品种间差异显著(P<0.05)。
2.4.3叶绿素荧光参数由图3可知,与对照相比,随着处理时间的延长,2个品种甘蓝叶片的Fv/Fm、ΦPSⅡ和qP 在Cd处理下均呈下降趋势,至处理第12天时‘绿丰’的降幅显著高于‘牛心’(P<0.05);在Cd+Si处理后,2个甘蓝品种叶片的Fv/Fm、ΦPSⅡ和qP均始终高于同期Cd处理组,且两处理间差异随着处理时间的延长而逐渐增大,品种间差异显著(P<0.05)。以上结果说明,Cd胁迫显著降低了甘蓝的叶绿素荧光参数值,而与Cd处理相比,外源Si显著提高了叶绿素荧光参数值,且趋向于对照水平。
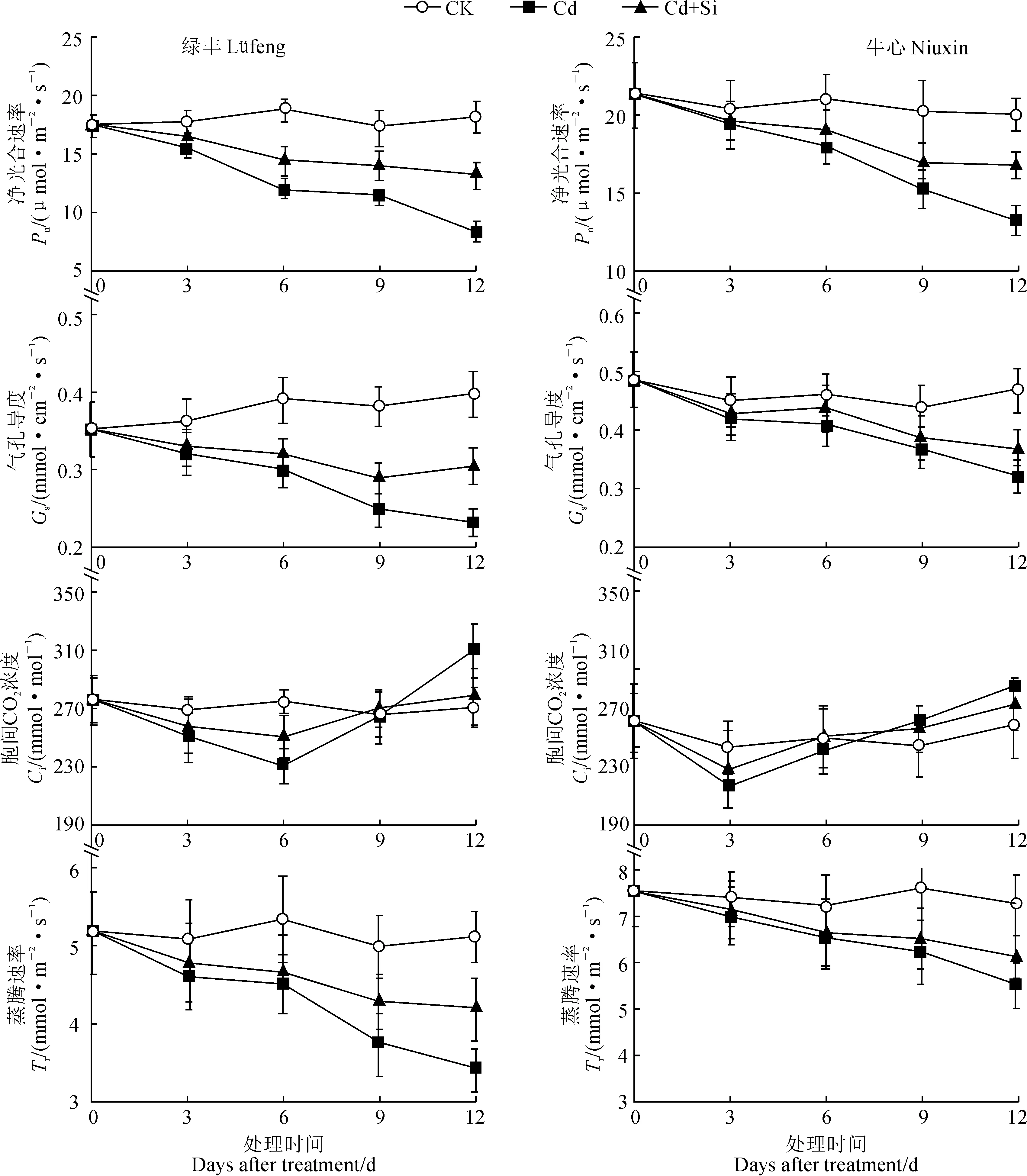
图2 外源外源Si处理对Cd胁迫下甘蓝品种‘绿丰’(左)和‘牛心’(右)幼苗光合参数的影响Fig.2 Effects of exogenous Si on the photosynthetic parameters of cabbage variety ‘Lüfeng’ (left) and ‘Niuxin’ (right) seedlings under Cd stress
2.5 外源Si对Cd胁迫下甘蓝幼苗MDA含量和抗氧化酶活性的影响
2.5.1MDA含量图4,A表明,在单独Cd处理下,2个品种甘蓝叶片和根系内MDA的含量均比对照显著增加,且‘绿丰’MDA含量的增幅显著高于‘牛心’(P<0.05)。与单独Cd处理相比,Cd+Si处理下2甘蓝品种叶片和根系内MDA含量均显著降低(P<0.05),‘绿丰’与‘牛心’叶片MDA的含量分别显著减少了19.0%和11.4%,而根系MDA含量分别显著减少了16.1%和12.4%,且品种间差异显著(P<0.05)。
2.5.2SOD活性如图4,B所示,在Cd处理下,2个品种甘蓝叶片和‘绿丰’根系内SOD活性均比对照不同程度降低,且‘绿丰’叶片和根系内SOD活性与对照差异达显著水平(P<0.05),而‘牛心’根系内SOD活性却比对照显著升高(P<0.05)。在Cd+Si处理后,2个品种甘蓝叶片以及‘绿丰’根系内SOD活性均比Cd处理显著增高,并达到对照水平,而‘牛心’根系内SOD活性却比Cd处理显著降低,但其仍显著高于对照(P<0.05)。
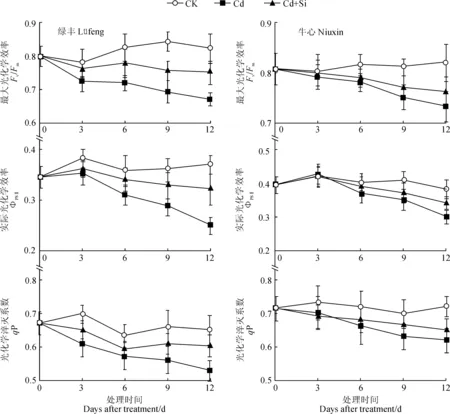
图3 外源Si处理对Cd胁迫下甘蓝‘绿丰’(左)和‘牛心’(右)幼苗叶绿素荧光参数的影响Fig.3 Effects of exogenous Si on the chlorophyll fluorescence parameters of cabbage variety ‘Lüfeng’ (left) and ‘Niuxin’ (right) seedlings under Cd stress
2.5.3POD活性于单独Cd处理下,2个品种甘蓝叶片和牛心根系内POD活性均显著比对照升高,且品种‘牛心’升高的幅度又显著高于品种‘绿丰’(P<0.05);与Cd处理相比,Cd+Si处理甘蓝品种叶片的POD活性均无明显变化,而同时品种‘绿丰’根系的POD活性显著升高,‘牛心’根系POD活性则显著下降,但其活性仍明显高于对照(P<0.05)。
2.5.4CAT活性在单独Cd处理下,2个品种甘蓝(除‘牛心’叶片外)的CAT活性均比对照降低,且‘绿丰’降幅更大;与单独Cd处理相比,Cd+Si处理甘蓝品种根系和叶片的CAT活性均不同程度升高,且根系升幅达到显著水平(P<0.05)。
2.5.5APX活性在单独Cd胁迫条件下,品种‘绿丰’叶的APX活性均比对照显著降低(P<0.05),而‘牛心’根叶的APX活性却无显著变化。在Cd+Si处理后,2个甘蓝品种根叶的APX活性均比Cd处理组不同程度升高,且两品种叶片的升幅均达到显著水平,同时它们均达到或显著高于对照水平。
2.5.6GR活性与对照相比,Cd胁迫下的甘蓝品种GR活性除‘绿丰’根系外显著升高(P<0.05),而‘绿丰’根系GR活性则显著降低。在Cd+Si处理条件下,2个甘蓝品种叶片和‘绿丰’根系的GR活性均比单独Cd处理显著升高(P<0.05),而‘牛心’根系GR活性则无显著变化。
以上结果说明,Cd胁迫显著降低了甘蓝的SOD、APX、CAT的活性,而显著提高了甘蓝根叶中MDA含量;与Cd处理相比,外源Si同时处理后,不同程度地提高了甘蓝的抗氧化酶活性,从而显著降低了叶中MDA含量。在整个胁迫过程中,耐性甘蓝品种抗氧化酶活性和MDA含量的变化幅度更大。
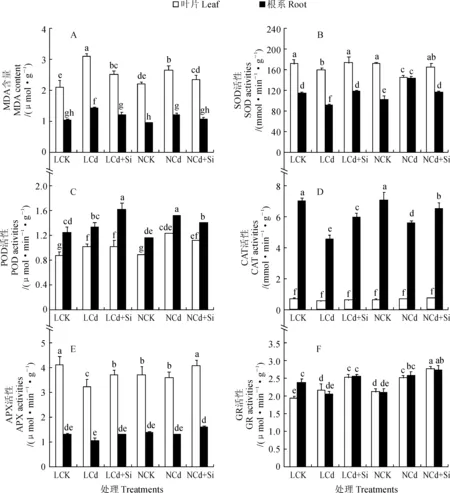
LCK、LCd、LCd+Si.‘绿丰’的3种处理;NCK、NCd、NCd+Si.‘牛心’的3种处理图4 外源Si对Cd胁迫下甘蓝幼苗叶片和根系MDA含量和抗氧化酶活性的影响LCK, LCd, LCd+Si. Three treatments of ‘Lüfeng’; NCK, NCd, NCd+Si. Three treatments of ‘Niuxin’Fig.4 Effects of exogenous Si on MDA content and antioxidant enzyme activities in leaves and roots of cabbage seedlings under Cd stress
3 讨 论
大量研究结果表明,植物在Cd胁迫下体内会发生一系列生理代谢过程的紊乱,直至植物生长受抑,而Si能够缓解Cd毒害对植物生长的抑制作用[1,6,9]。本实验中,Cd处理显著抑制了甘蓝的生长,而外源Si能够提高甘蓝的生物量,并以外源Si对敏感品种‘绿丰’的缓解效果最为明显。
Si缓解植物毒害的一个重要机制是减少植株对Cd的吸收和转运,但目前对于其机制的研究还不足[14]。可能是由于Si和Cd会在植物根系细胞壁和液泡中以复合物形式沉淀下来,从而限制了Cd由根系向地上部的转运[15]。Cd离子转运系数(TF)表示Cd由根系转运到地上部的能力。本实验结果表明,与单独Cd处理相比,外源Si明显减小了甘蓝Cd离子的TF(P<0.05),且耐性品种‘牛心’Cd离子的TF下降更为明显(P<0.05),这与Shi等[16]以花生为实验材料的研究结果相似。说明Si对甘蓝Cd毒害的缓解作用部分原因是通过减少Cd由根系向地上部的转运,从而降低其地上部的Cd含量,缓解Cd对植株生长的抑制作用。与此同时,Cd亦能降低植物对营养元素的吸收和转运能力,引起矿质代谢紊乱,导致营养元素间失去平衡,扰乱植物的新陈代谢,从而降低光合效率[15]。
Mn、Fe、Mg和Cu在光合作用中发挥重要作用;如:Mg是叶绿素的重要成分[17],Cd诱导的Fe不足会导致萎黄症的出现[18]等;因而其含量的不足必然影响光合效率。本实验中,单独Cd处理显著降低了2个品种甘蓝根系Fe、Mn、Cu的含量,同时亦显著降低了其地上部Mg、Fe、Mn的含量,并且敏感品种‘绿丰’的降幅显著高于耐性品种‘牛心’(P<0.05)。同时,光合色素含量的变化反映了Cd胁迫对植物的伤害程度[19]。本实验中,单独Cd处理显著降低了甘蓝叶片光合色素的含量,且‘绿丰’下降的幅度明显高于‘牛心’(P<0.05),表明耐性品种‘牛心’在Cd胁迫下仍可以保持较高的光合效率。而Si可以通过提高植物自身维护光合系统的能力、增加光合色素含量、提高光合效率、增强抵御胁迫的能力来缓解重金属毒害[15]。Wang[20]等研究结果表明,外源Si能够缓解Cd胁迫下水稻幼苗的生长,改善Mg、Fe、Zn的营养,增加叶绿素含量。Farooq等[21]发现Cd显著降低了水稻对S、Ca、K、Mg和Zn的吸收和积累,在营养配方中添加Si则大大抑制了这种效应。在本实验中,与单独Cd处理相比,外源Si显著提高了2个甘蓝品种地上部的Mg、Fe、Mn及Cu含量,而且此时两品种光合色素含量亦显著提高(P<0.05)。光合色素含量的增加是由于光合色素合成的增加或降解的减少所致[22]。这些结果表明Si可以通过调节Cd胁迫下的甘蓝对营养元素的吸收和转运,来影响光合色素的代谢,这可能也是Si提高甘蓝光合效率的另一个重要因素。
重金属胁迫能够影响植物的蒸腾速率和气孔开度,进而影响其光合作用[23]。本实验中,Cd胁迫下两品种甘蓝的Pn、Gs和Tr均随着处理时间的延长整体呈下降趋势。研究表明,Ci值可用以判断影响光合作用的因素主要是气孔或非气孔限制。若Ci与Pn、Gs同时下降时,可判为Pn下降主要由气孔限制;若Pn下降,而Gs降低和Ci升高,则可判为Pn下降由非气孔限制,即叶肉细胞光合活性下降[24]。本实验中,在Cd处理前期,2个品种的甘蓝叶片Pn和Gs下降且Ci也逐渐降低,说明此时期叶片Pn是受气孔限制(主要是CO2供应减少)的影响;随着处理时间的延长,其Pn和Gs继续下降而Ci逐渐升高,表明此时期甘蓝叶片Pn下降主要受非气孔限制(主要是CO2的同化效率下降)的影响。外源Si同时处理后,两品种叶片光合参数均趋向于对照水平,表明Si可以提高甘蓝的光合效率。
同时,叶绿素荧光变化也反映了植物光合机构的运转状况。其中,Fv/Fm值的变化表示PSⅡ 原初光能转换效率能力的大小;ΦPSⅡ值表示PSⅡ的实际光化学效率[25]。而qP值表示PSⅡ开放中心的数目及PSⅡ原初电子受体QA的氧化还原状态,qP值增大,PSⅡ的电子传递活性升高[26];qP值减小,则PSⅡ反应中心的开放比例和参与CO2固定的能量减弱[27]。本实验中,单独Cd处理下,随着处理时间的延长,2个品种叶片的Fv/Fm和ΦPSⅡ值呈下降趋势,说明PSⅡ的原初光化学效率和从天线色素到PSⅡ反应中心的传能效率明显受到Cd胁迫的影响,出现光抑制现象[28],降低了PSⅡ反应中心进行光化学反应的效率。另外,在本实验单独Cd处理下,2个品种叶片的qP值呈下降趋势,说明其叶片吸收的光化学反应减弱。而外源Si同时处理显著抑制了这些负效应,这表明Si可以提高Cd胁迫甘蓝植株内光化学反应能力、PSⅡ的原始光能转化率、PSⅡ的潜在活性以及PSⅡ库容量和光合电子传递,从而提高了Cd胁迫下甘蓝的光合效率。影响光合作用的另一个重要因素为细胞膜的完整性。
综上所述,在Cd胁迫环境下,外源Si首先能够抑制Cd由甘蓝根系向地上部的转运,降低Cd在地上部的积累;其次能提高相关抗氧化酶活性,减轻细胞膜脂过氧化程度;再次还能促进根系对营养元素的吸收,维持营养元素间的平衡;另外还促进或抑制叶绿素的合成或降解,提高了叶片的光合速率。从而有效缓解了Cd胁迫对甘蓝生长的毒害。
