大豆GmABI4基因克隆及表达分析
2018-07-19周文冠赵思华杨文钰
江 如,周文冠,赵思华,尹 晗,杨文钰,舒 凯
(四川农业大学 生态农业研究所,农业部西南作物生理生态与耕作重点实验室,成都 611130)
ABI4(abscisic acid-insensitive 4)最初是在松属裸子植物中发现的一类属于APETALA2/ethylene responsive factor(AP2/ERF)家族类的转录因子[1]。Finkelstein利用射线照射筛选到了对脱落酸(abscisic acid,ABA)不敏感的拟南芥突变体种子,它能够在ABA存在的条件下正常萌发,而野生型WT(Col-0)种子无法正常萌发,因此命名为abi4(abscisicacidinsensitive4)[2]。包括本课题组在内的大量前期研究表明,ABI4能结合与ABA相关基因的启动子区,直接介导其基因转录,同时还能间接调控一系列基因的表达,包括胚后期发育、种子萌发与休眠、幼苗生长、非生物胁迫响应、ABA信号转导、脂类代谢、开花调控和光合作用途径上的基因[3-10]。
在模式植物拟南芥中,通过生物化学和遗传学的方法,已发现ABI4的多个靶标基因。在这些基因中,有受其转录激活的,也有受其转录抑制的,如ABI4 可以直接结合ABI5、SBE2.2、DGAT1等基因的启动子,促进这些基因的转录[11-12];另一方面,ABI4也可直接与AOX1a、Lhcb等基因的启动子区结合,进而抑制这些基因的转录[13-15]。这表明,ABI4 作为转录因子,可能并非简单的以单体行使功能,而很可能是与其他转录辅助因子形成转录因子复合体,视不同的靶标基因,决定行使转录激活或是抑制的功能[16]。
ABI4在植物的生长发育及逆境响应中发挥着重要的作用。在种子的发育及萌发方面,ABI4能够提高三酰甘油的合成基因DGAT1的表达,提高了三酰甘油含量,并对其分解有一定的抑制作用[11],为种子的萌发储存足够的能量,当其发生突变以后,萌发率降低。同时,ABI4还通过正调控ABA合成、负调控GA合成,进而促进种子休眠。ABI4作为ABA和GA之间实现拮抗生理的重要枢纽,从而精细调控种子的休眠水平及萌发速率[5-6]。ABI4 作为一种含AP2 结构域的转录因子,在侧根发育过程中起着重要作用。在ABI4过表达(OE-ABI4)植株中,负责编码生长素运输蛋白的PIN1基因的表达水平下降,影响了生长素的极性运输,使得侧根的生长受到了抑制,因此abi4突变体的侧根长度和密度均高于野生型[17]。abi4还表现出对盐胁迫不敏感的表型[18],有研究表明ABI4 可以结合HKT1;1启动子区域,进而调控植物对盐胁迫的响应能力[8]。此外,ABI4能够通过正调控开花关键基因FLC的表达,进而负调控开花时间,ABI4是继ABI5以来在ABA途经上新鉴定到的调控开花的关键基因[9]。这些研究表明,拟南芥ABI4在植物发育的各个阶段以及非生物胁迫响应过程中,具有重要的生物学功能。
目前,对ABI4的研究大多数集中在拟南芥等模式作物中,而在作物尤其是栽培大豆等豆科作物中的研究较少。大豆作为重要的蛋白质和油脂的来源,分布范围广,种植面积较大,是全球最为重要的粮、油、饲兼用作物之一。长期以来,各种环境问题(如土地盐碱化等)对大豆生长造成不良影响,进而影响大豆的产量[19]。本研究对大豆GmABI4进行了生物信息学分析,检测了其时空表达特征,这将为进一步深入研究大豆GmABI4的生物学功能奠定基础。
1 材料和方法
1.1 实验材料与处理
本研究采用的大豆品种为‘南豆-12’,是中国西南地区广泛栽培的大豆品种。种子在四川农业大学现代农业研发基地种植、收获以及储存。选取大小均一,颗粒饱满,无明显病虫害的大豆种子播种于土壤中,放入人工气候室(温度25 ℃,相对湿度60%,12 h光周期)培养。分别在植物生长过程中进行不同组织取样,大豆幼苗取根和茎、大豆生长至第一片真叶时(VE期)取真叶、第一片复叶时(V1期)取复叶、盛花时(R2期)取花瓣、豆粒鼓到最大时(R6期)取豆荚。所有样品经液氮速冻后于-80 ℃超低温冰箱保存,用于提取总RNA。
1.2 实验方法
1.2.1大豆GmABI4基因的鉴定及生物信息分析从拟南芥数据库TAIR网站(http://www.arabidopsis.org/)下载拟南芥的ABI4氨基酸序列。在Phytozome网站(http://www.Phytozome.net/)与大豆数据库进行比对[20],得到2个GmABI4蛋白序列。通过NCBI Blast进行氨基酸序列比对;利用ExPASy ProtParam Tool 分析GmABI4编码的蛋白的理化性质;ExPASy ProtScale软件分析其疏水性;用IBCP在线工具SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl? page=npsa_sopma.html)预测GmABI4的二级结构;SWISS-MODEL(https://swissmodel.expasy.org/)预测其三级结构;利用Signalp 4.1在线软件,并根据蛋白序列的特征,利用神经网络算法和隐马氏模型方法进行信号肽预测;利用TMHMM在线软件对蛋白的跨膜结构进行预测;运用MEGA 7软件,以邻近法构建系统进化树[21]。
1.2.2引物设计先在TAIR中使用基因编号获取相应的氨基酸序列,将其导入Phytozome V 12.0(Blast)中以检索编码相应氨基酸序列的大豆基因序列。将相应的大豆基因序列导入Beacon Designer 8与大豆cDNA文库进行比对并进行引物合成,并确保引物最适退火温度在60 ℃左右。引物序列见表1,引物的合成与测序由上海生工生物工程有限公司完成。

表1 qPCR相关的引物序列
1.2.3RNA提取和cDNA第一链合成RNA采用酚/氯仿方法进行提取,1%琼脂糖凝胶电泳检测RNA 的完整度,Nanodrop plus(Thermo Scientific)测定其浓度和纯度。按照M-MLV(TaKaRa)反转录酶说明书进行cDNA第一链合成。
1.2.4基因表达分析以大豆根、茎、真叶、复叶、花和豆荚为组织材料,提取总RNA并合成cDNA第一条链。qRT-PCR反应体系和反应条件按Vazyme公司的VazymeTMAceQ qPCR SYBR说明书进行操作,反应体系稍作修改,总体系为10 μL:其中AceQ qPCR SYBR Mix 5 μL,引物分别加0.2 μL,cDNA 2 μL,最后用ddH2O补齐至10 μL。在Quant Studio 6 Flex Real-Time PCR System上进行测定,每个材料3次技术重复,采用2-ΔΔCT方法进行数据分析。SPSS进行显著性分析,Excel 2016 进行数据分析。
2 结果与分析
2.1 大豆GmABI4-1和GmABI4-2氨基酸的序列比对分析
将大豆中GmABI4氨基酸序列提交至NCBI数据库,进行序列比对。结果显示,与雷蒙德氏棉(Gossypiumraimondii)XP_012457656.1和陆地棉(Gossypiumhirsutum)XP_016724531.1序列一致性分别为81%和83%,与樱桃(Prunusavium)XP_021805597.1和榴莲(Duriozibethinus)XP_022744412.1的氨基酸序列一致性为81%。序列比对结果显示,GmABI4与不同物种氨基酸在58~166 bp处有较高的一致性,说明该区段在进化的过程中高度保守,可能具有重要的生物学功能(图2)。
2.2 GmABI4-1和GmABI4-2生物信息学分析
2.2.1GmABI4-1和GmABI4-2基因及蛋白的理化性质分析GmABI4编码蛋白的理化性质分析结果表明,该蛋白分子式分别为C1536H2365N479O492S5和C1603H2456N480O526S6,其中丙氨酸Ala(19,5.9%;19,5.6%),精氨酸Arg(19,5.9%;18,5.3%),天冬酰胺Asn(29,9%;32,9.5%),谷氨酰胺Gln(20,6.2%;15,4.4%),丝氨酸Ser(40,12.7%;51,15.1%),缬氨酸Val(31,9.6%;23,6.8%),甘氨酸Gly(22,6.8%;22,6.5%)等氨基酸含量较高,而半胱氨酸Cys(3,0.9%;2,0.6%),甲硫氨酸Met(2,0.6%;4,1.2%)等含量较低。该蛋白的预测分子量分别为35.58 kD和37.06 kD,理论等电点为8.96和8.46,不稳定系数为47.15和58.09,可能是一个不稳定蛋白,总的平均亲水指数-0.755和-0.762。ExPASy ProtScale预测该蛋白属于亲水性蛋白(图1)。
2.2.2GmABI4-1和GmABI4-2的高级结构预测在线软件SOPMA预测GmABI4蛋白的二级结构(图3),结果显示含有大量的延伸链(Extended strand)和无规则卷曲(Random coil),分别占氨基酸总量的26.01%和50.15%。α螺旋(Alpha helix)和β转角(Beta turn)仅占氨基酸总量的16.1%和7.74%。由此可见该蛋白主要以无规则卷曲元件为主。利用SWISS-MODEL对其三级结构进行预测(图4),结果与二级结构相吻合。
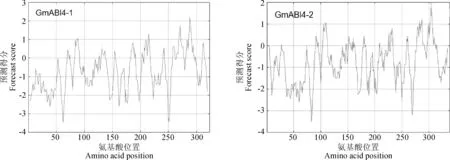
图1 GmABI4-1与GmABI4-2蛋白亲水性预测Fig.1 Hydrophilic regions of protein GmABI4-1 and GmABI4-2

KRH14926.1. 大豆GmABI4-1;XP_014622037.1. 大豆GmABI4-2;XP_014504327.1. 绿豆;XP_020209993.1. 木豆;XP_012457656.1. 雷蒙德氏棉;XP_016724531.1. 陆地棉;XP_021805597.1. 甜樱桃;XP_022744412.1. 榴莲图2 GmABI4与其他物种ABI4氨基酸序列比对KRH14926.1 Glycine max ABI4-1;XP_014622037.1 Glycine max ABI4-2;XP_014504327.1 Vigna radiata;XP_020209993.1 Cajanus cajan;XP_012457656.1 Gossypium raimondii;XP_016724531.1 Gossypium hirsutum;XP_021805597.1 Prunus avium;XP_022744412.1 Durio zibethinusFig.2 Multiple alignment of GmABI4 with those of other species
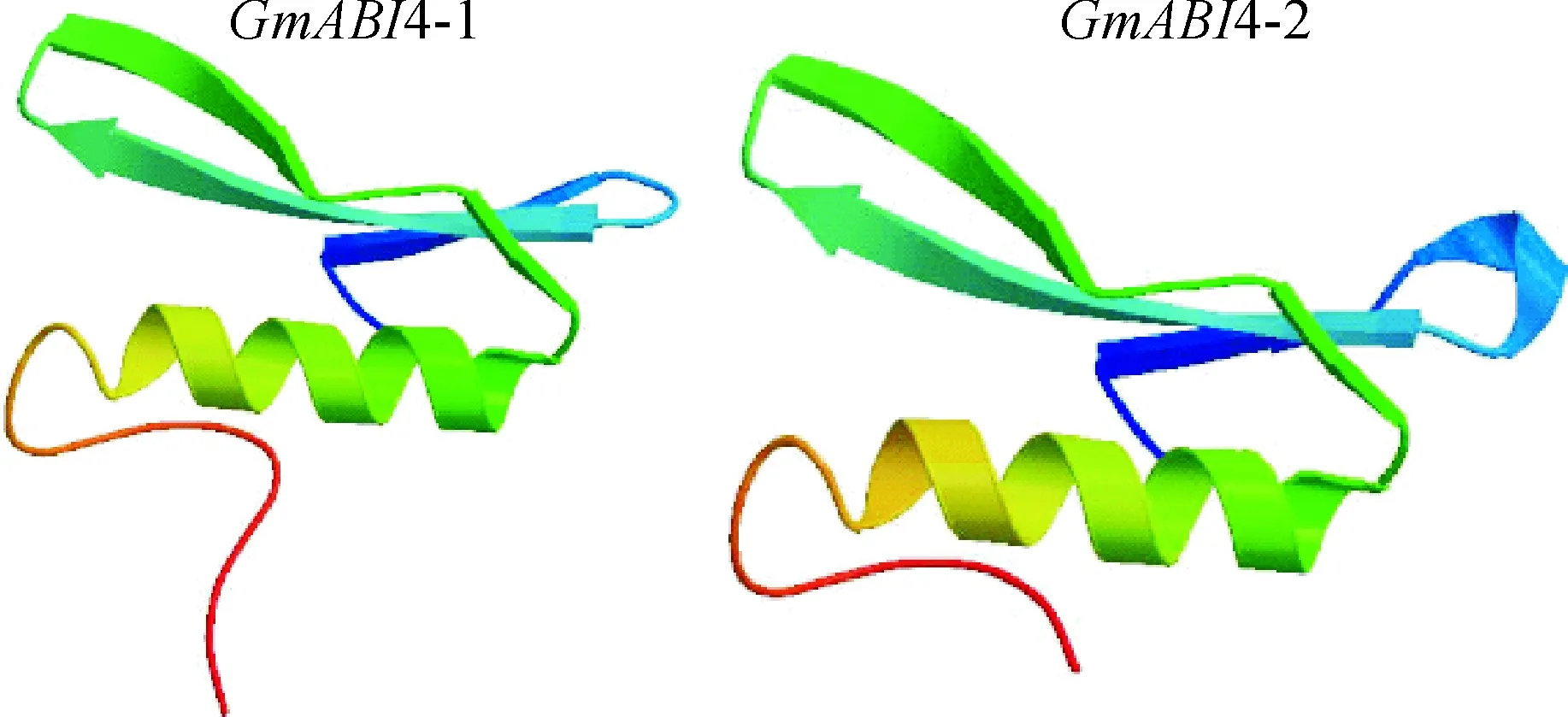
图4 GmABI4-1和GmABI4-2三级结构预测Fig.4 The tertiary structure prediction of GmABI4-1 and GmABI4-2
2.2.3GmABI4-1和GmABI4-2的蛋白信号肽、跨膜结构预测信号肽预测有助于蛋白结构分析和蛋白质的亚细胞定位。利用Signalp 4.1在线软件,并根据蛋白序列的特征,利用神经网络算法和隐马氏模型方法进行预测。是否分泌蛋白用mean S-score判断,信号肽切割位点用Y-score maximum 判断。结果显示,GmABI4-1和GmABI4-2的mean S值分别为0.098和0.102,均小于0.5,不存在信号肽(图5)。利用TMHMM在线软件对蛋白的跨膜结构进行预测,结果表明这2个蛋白均不存在跨膜结构。
2.2.4GmABI4-1和GmABI4-2同源性分析在数据库中选择具有功能的不同物种的ABI4蛋白构建系统进化发育树。结果(图6)显示,来自不同植物的ABI4主要分为三大类,其中大豆中的GmA-BI4-1和GmABI4-2 的同源关系最近,其次与野生大豆有较高的同源性。
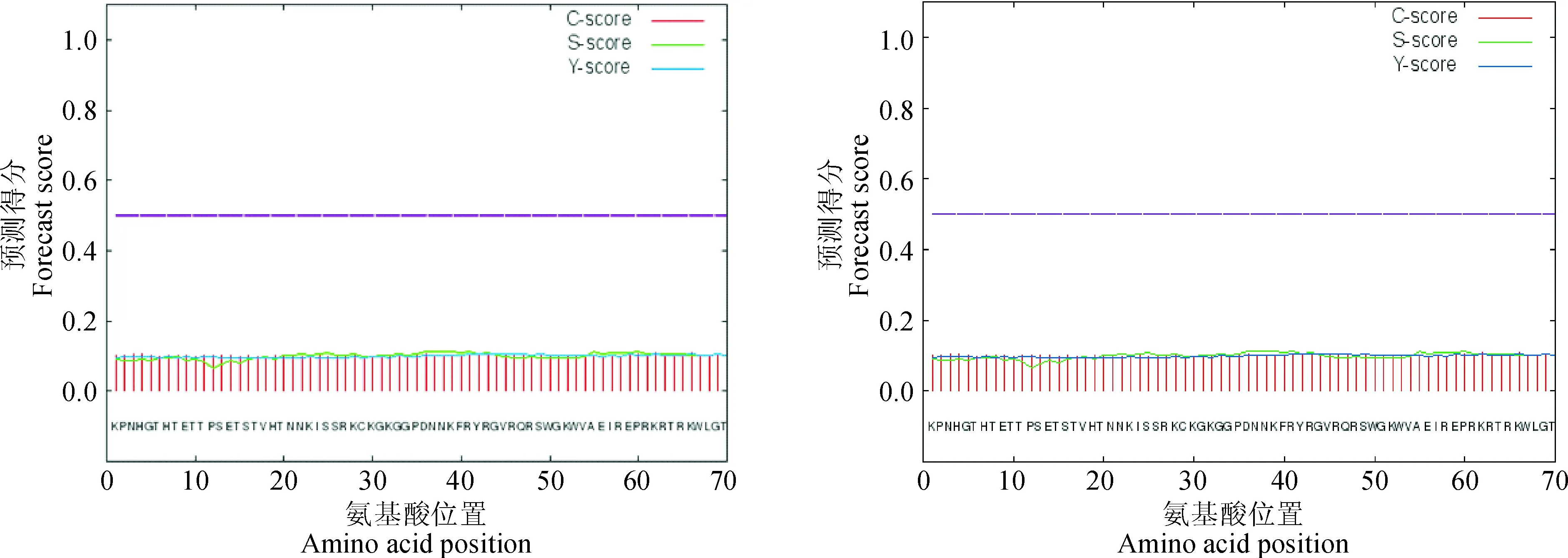
图5 GmABI4-1 和GmABI4-2蛋白信号肽预测Fig.5 The signal peptide prediction of GmABI4 and GmABI4-2

图6 GmABI4-1 和GmABI4-2的系统进化分析Fig.6 Phylogenetic analysis of GmABI4-1 and GmABI4-2
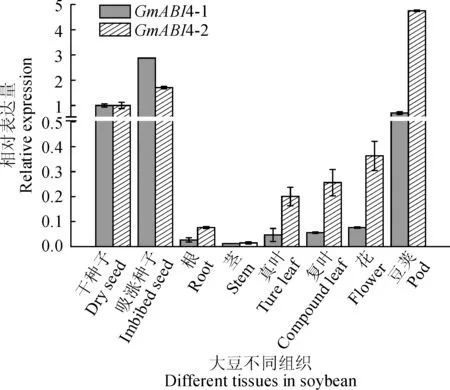
图7 GmABI4-1 和GmABI4-2在大豆不同组织中的表达量分析Fig.7 Expression of GmABI4-1 and GmABI4-2 in different tissues of soybean
2.3 GmABI4-1和GmABI4-2在不同组织中的表达分析
以大豆干种子为对照,以GmTubulin为内参,qRT-PCR分别分析了GmABI4-1 和GmABI4-2基因在大豆的不同组织中的表达量。结果表明(图7),GmABI4-1和GmABI4-2在大豆不同组织中均有表达,其中在种子和豆荚中的表达量较高,而在根、茎、叶中表达量较低。这2个基因在大豆种子和种子形成过程中表达水平较高,表明该基因可能在此过程中发挥着重要的作用。
3 讨 论
大豆是世界上最重要的粮油作物之一,其产量和品质受环境的影响较大。提高大豆对非生物胁迫的耐受能力和其对光能的利用效率,对于提高大豆对环境的适应能力具有重要的意义。ABI4在植物种子萌发和种子发育期间发挥着重要的作用。目前已在多种物种中鉴定和克隆到ABI4家族基因,然而在大豆中的研究尚少,尚无对大豆中GmABI4家族基因进行鉴定和分析的报道。本研究利用已测序的大豆(Williams 82)基因组序列[22],共鉴定到2个GmABI4基因。众所周知,染色体加倍是植物进化的主要动力,许多植物都经历过染色体加倍事件[23]。大豆作为古四倍体作物,进化过程中经历了染色体加倍,使其基因的拷贝数增加[24],大豆中GmABI4基因为2个,可能与其经历的染色体加倍有关。
ABI4属于植物特有的一类AP2家族转录因子,调控植物的生长发育。本研究克隆了大豆中的GmABI4-1和GmABI4-2,并经过与其他的物种进行氨基酸序列的比对,发现其在N端的结构域具有相对保守的序列。研究发现ABI4参与调控的信号通路有很多,如ABI4调控种子休眠与萌发[5,7,10]、负调控拟南芥的开花[9]、参与质体(包括叶绿体和线粒体)与细胞核之间的信号转导调控[14,25]、通过促进甘油三酯合成基因DGAT1的表达,促进甘油三酯的合成,并抑制其降解[11]等。
本实验qPCR检测不同组织特异性表达结果表明,GmABI4-1和GmABI4-2均具有明显的组织表达特异性,其在种子和豆荚中的表达量较高,而在根、茎、叶等组织中表达量都很低,推测其可能在大豆种子的生长发育过程中发挥着重要的作用。本文已经对GmABI4基因的生物信息学分析及其表达特征进行探究,将为进一步深入研究大豆GmABI4的生物学功能奠定一定基础。
