超声引导下门静脉穿刺导引TIPS联合曲张静脉栓塞治疗肝硬化上消化道出血
2018-07-18汪靖园李伟之邰明辉
汪靖园,薛 挥,李伟之,邰明辉,魏 炜*
(1.西安交通大学第一附属医院检验科,2.消化内科,3.超声影像科,陕西 西安 710061)
上消化道出血是肝硬化门静脉高压症的主要并发症之一,也是导致患者死亡率较高的主要原因[1-2]。对于顽固性上消化道出血多行三腔管压迫及内镜下曲张静脉套扎治疗,但效果并不满意[3]。外科分流手术创伤较大,部分患者难以耐受,且传统穿刺通路的盲目性易致手术失败。TIPS联合食管胃底曲张静脉栓塞术(percutaneous transhepatic variceal embolization, PTVE)可有效降低门静脉压力,短期疗效较显著[4],而肝内门体分流道穿刺是TIPS联合PTVE手术成功的关键。本研究采用超声引导下经皮经肝直接穿刺门静脉并造影,探讨超声导引TIPS联合PTVE治疗肝硬化上消化道出血的价值。
1 资料与方法
1.1 一般资料 收集2015年5月—2017年3月我院82例肝硬化伴反复上消化道出血患者,男47例,女35例,年龄25~65岁,平均(43.9±11.7)岁。根据手术方式不同分为2组,病例组47例,男27例,女20例,年龄27~65岁,平均(44.8±12.9)岁,包括乙型病毒性肝炎肝硬化37例、丙型病毒性肝炎肝硬化6例、乙型合并丙型病毒性肝炎肝硬化3例及酒精性肝硬化1例,行超声引导下经皮经肝门静脉穿刺并辅助导引TIPS联合PTVE;对照组35例,男20例,女15例,年龄25~62岁,平均(42.6±10.4)岁,包括乙型病毒性肝炎肝硬化31例及丙型病毒性肝炎肝硬化4例,行肝动脉造影或对照腹部CT经肝静脉穿刺门静脉并建立门体分流通道及PTVE。纳入标准:肝硬化并反复上消化道出血,经内科保守治疗无效,或无法耐受外科手术治疗。排除标准:肝脏体积显著萎缩,不适宜介入治疗。
1.2 仪器与方法 采用Philips Allura 12数字减影血管造影机,Siemens Acuson彩色多普勒超声诊断仪,配备4V1穿刺探头(频率3.5 MHz)及穿刺架。
1.2.1 病例组 以超声预先规划穿刺路径,实时超声引导下采用18G PTC针经皮经肝穿刺进入门静脉,将导丝下行至门静脉,沿导丝依次送入5F动脉鞘管及Cobra导管,行门静脉及食管胃底曲张静脉造影。根据造影结果,以直径5~8 mm弹簧圈及无水乙醇硬化剂依次栓塞曲张静脉。经颈内静脉穿刺并导入超滑导丝下行至肝静脉,顺导丝送入RUPS-100穿刺系统,以门静脉造影导引穿刺,分流道穿刺成功后,将RUPS-100穿刺系统送入门静脉。随后将Cobra导管退回至肝内并封闭穿刺道。以直径6~8 mm球囊扩张门体分流道后,植入直径7~10 mm聚四氟乙烯覆膜支架骑跨肝实质分流道,再次造影确认支架通畅和曲张静脉完全栓塞(图1)。
1.2.2 对照组 经颈内静脉穿刺并导入超滑导丝下行至肝静脉,经股动脉穿刺并导入超滑导丝上行至肝动脉并造影,根据股动脉造影结果或对照腹部CT引导RUPS-100穿刺系统穿刺门静脉,分流道穿刺成功后以球囊扩张分流道,植入直径7~10 mm覆膜支架,再行门静脉造影及PTVE。
1.3 观察指标 记录分流道穿刺次数及时长、PTVE手术时长及手术总时长等,计算分流道穿刺成功率及术中出血率。分别于术后1周、1个月、1年复查,观察肝脏血管情况,包括门静脉、脾静脉内径及流速,肠系膜上静脉及下腔静脉流速,肝动脉流速及RI;记录并发症。
1.4 统计学分析 采用SPSS 19.0统计分析软件。对数据行正态分析(Kolmogorov-Smirnov检验)和方差齐性检验(F检验),计量资料以±s表示。采用独立样本t检验比较2组分流道穿刺次数、时长、PTVE手术时长、手术总时长及并发症差异,采用χ2检验比较2组穿刺成功率、术中出血率及术后复发出血率;采用单因素方差分析分别比较2组术前、术后1周、1月、1年门静脉、脾静脉内径及流速,肠系膜上静脉及下腔静脉流速,肝动脉流速及RI差异,组内两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果
病例组47例均穿刺门静脉成功,分流道穿刺成功率100%,并成功施行TIPS联合PTVE。对照组35例中,对31例成功完成分流道穿刺及PTVE手术;4例失败。病例组分流道穿刺次数和穿刺时长、手术总时长及术中出血率均低于对照组,而分流道穿刺成功率高于对照组(P均<0.05);2组PTVE手术时长差异无统计学意义(P=0.15),见表1。
病例组及对照组术后1周、1个月、1年门静脉、脾静脉内径及流速,肠系膜上静脉及下腔静脉流速,肝动脉流速及RI分别与术前相比差异均有统计学意义。病例组术后两两时间点比较,门静脉、肝动脉流速差异均有统计学意义;对照组术后两两时间点比较,门静脉、脾静脉、下腔静脉、肠系膜上静脉及肝动脉流速差异均有统计学意义(P均<0.05,表2、3)。
术后随访期内,病例组3例(3/47,6.38%)分流道失效,2例(3/47,6.38%)合并肝性脑病,无复发消化道出血病例;对照组2例(2/35,5.71%)分流道失效,2例(2/35,5.71%)合并肝性脑病,3例(3/35,8.57%)复发消化道出血。2组复发消化道出血率差异有统计学意义(χ2=4.30,P=0.03),分流道失效及合并肝性脑病发生率差异无统计学意义(P均>0.05)。
3 讨论
TIPS是治疗肝硬化门静脉高压症的有效微创手段,可降低上消化道出血风险,而PTVE也可进一步防控术后再出血风险[5-6]。经肝静脉穿刺门静脉是手术成功的关键。由于门静脉系统相对独立,无法通过穿刺外周血管达到直接显影门静脉的目的,传统方法是通过对肝动脉、肠系膜上动脉或脾动脉造影而间接显影门静脉,但效果不满意[7]。由于靶目标不明确,加之肝硬化血管走行僵硬、扭曲,把控肝内穿刺方向及角度甚为困难,反复多次穿刺及使用过量对比剂不仅增加出血风险[8],也加重肝脏和肾脏负荷。
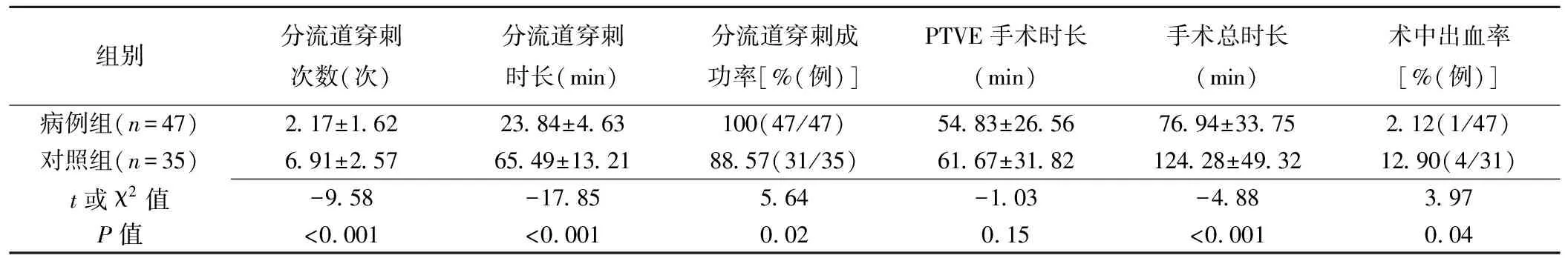
表1 2组成功完成PTVE手术情况
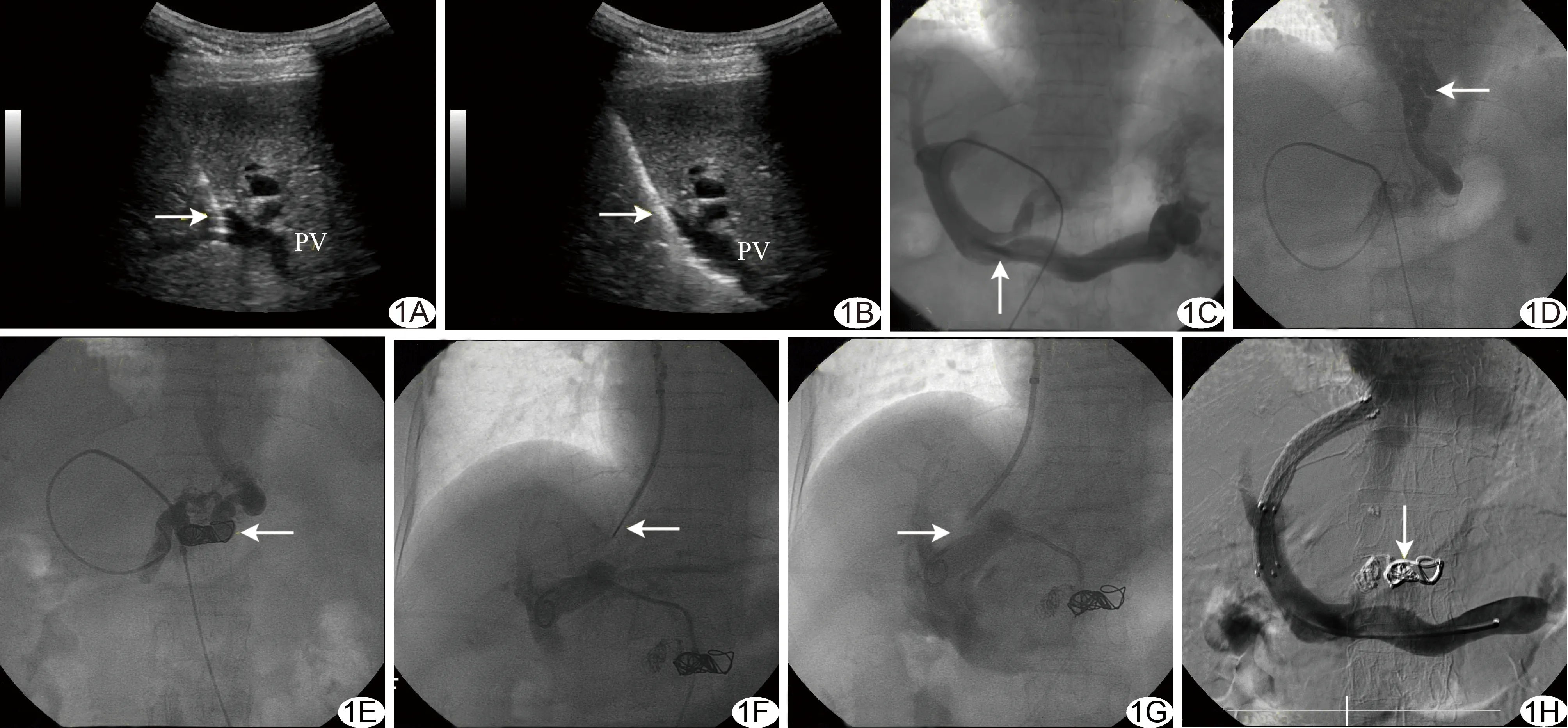
图1 患者女,70岁,乙型病毒性肝炎肝硬化伴门静脉高压,食管胃底静脉曲张 A.超声引导下穿刺门静脉(箭示穿刺针); B.导丝顺穿刺针入门静脉(箭示导丝); C.门静脉造影(箭示门静脉); D.曲张静脉显影(箭示曲张静脉); E.释放弹簧圈栓堵曲张静脉(箭示弹簧圈释放); F.门静脉显影下诱导RUPS-100穿刺系统经肝静脉穿刺门静脉(箭示RUPS-100穿刺门静脉); G.直导丝刺入门静脉并植入导丝(箭示直导丝刺入门静脉); H.释放支架并造影示曲张静脉完全栓堵(箭示曲张静脉完全栓堵) (PV:门静脉)
表2 病例组TIPS前后肝脏血管情况(±s,n=47)

表2 病例组TIPS前后肝脏血管情况(±s,n=47)
病例组门静脉内径(mm)流速(cm/s)脾静脉内径(mm)流速(cm/s)术前14.31±2.4911.15±4.4712.56±3.1215.75±6.62术后1周10.34±1.62∗38.71±11.58∗9.39±2.85∗27.61±11.57∗术后1个月9.65±1.84∗33.25±12.43∗#8.83±2.45∗24.42±9.87∗术后1年10.73±2.21∗28.72±9.66∗#△8.91±3.64∗22.58±10.93∗#F值5.676.425.916.54P值0.01<0.001<0.001<0.001病例组下腔静脉流速(cm/s)肠系膜上静脉流速(cm/s)肝动脉流速(cm/s)RI术前8.51±3.7311.79±3.6385.21±11.420.47±0.22术后1周16.71±8.82∗18.21±7.86∗48.51±19.82∗0.62±0.14∗术后1个月18.83±6.82∗19.68±11.52∗51.84±19.53∗0.59±0.21∗术后1年16.42±9.66∗17.25±9.84∗67.23±22.95∗#△0.51±0.17#△F值6.745.485.215.69P值<0.0010.010.010.01
注:*:与术前比较,P<0.05;#:与术后1周比较,P<0.05;△:与术后1个月比较,P<0.05
表3 对照组TIPS前后肝脏血管情况(±s,n=35)
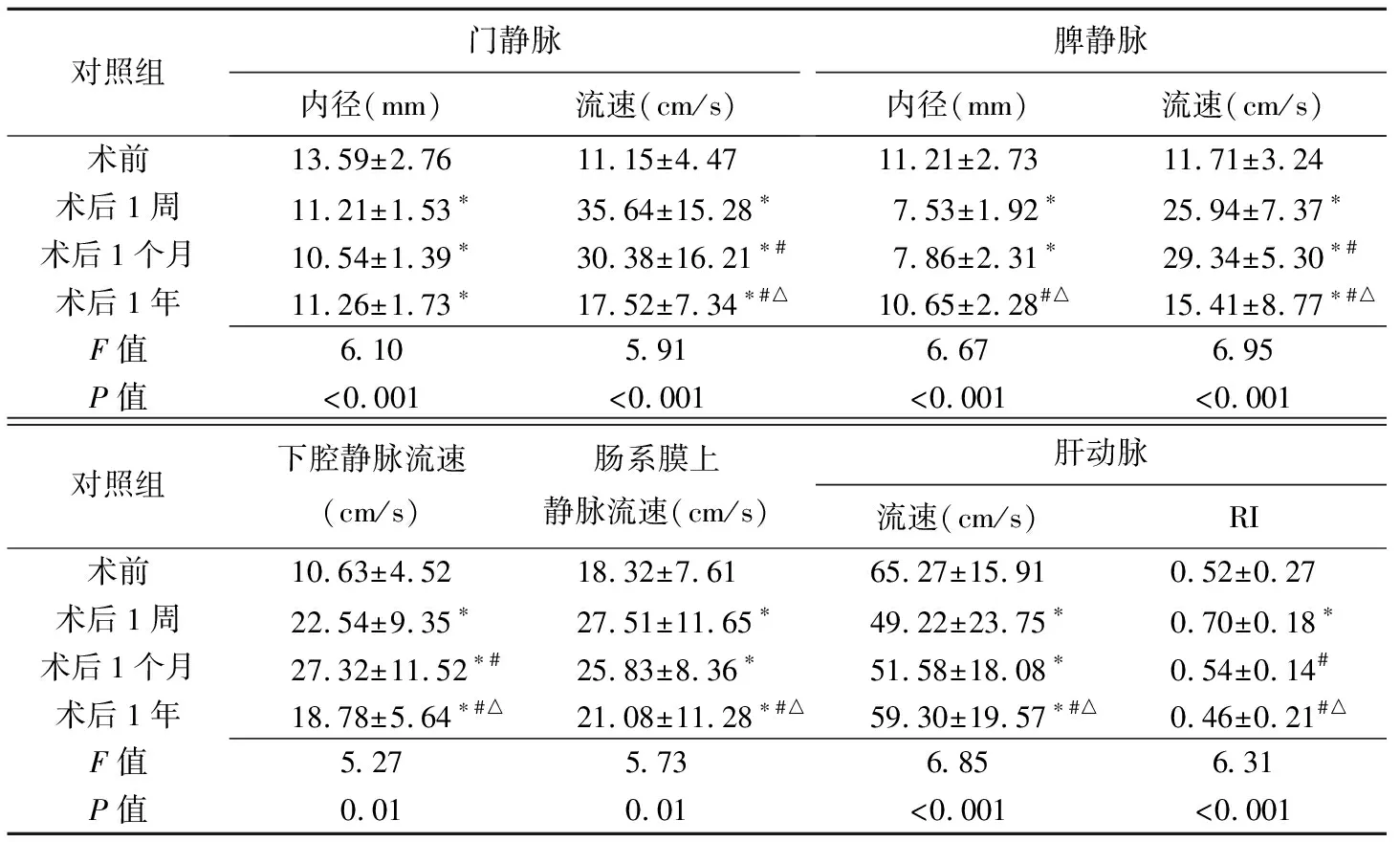
表3 对照组TIPS前后肝脏血管情况(±s,n=35)
对照组门静脉内径(mm)流速(cm/s)脾静脉内径(mm)流速(cm/s)术前13.59±2.7611.15±4.4711.21±2.7311.71±3.24术后1周11.21±1.53∗35.64±15.28∗7.53±1.92∗25.94±7.37∗术后1个月10.54±1.39∗30.38±16.21∗#7.86±2.31∗29.34±5.30∗#术后1年11.26±1.73∗17.52±7.34∗#△10.65±2.28#△15.41±8.77∗#△F值6.105.916.676.95P值<0.001<0.001<0.001<0.001对照组下腔静脉流速(cm/s)肠系膜上静脉流速(cm/s)肝动脉流速(cm/s)RI术前10.63±4.5218.32±7.6165.27±15.910.52±0.27术后1周22.54±9.35∗27.51±11.65∗49.22±23.75∗0.70±0.18∗术后1个月27.32±11.52∗#25.83±8.36∗51.58±18.08∗0.54±0.14#术后1年18.78±5.64∗#△21.08±11.28∗#△59.30±19.57∗#△0.46±0.21#△F值5.275.736.856.31P值0.010.01<0.001<0.001
注:*:与术前比较,P<0.05;#:与术后1周比较,P<0.05;△:与术后1月比较,P<0.05
超声具有操作简便、直观等特点[9],且实时引导可提高穿刺准确率[10]。本研究病例组47例均在超声引导下穿刺门静脉成功。术前评估穿刺方向及角度、确定穿刺路径及导丝下行路线,确保导丝进入门静脉后可顺利下行至主干及曲张静脉,有助于后续门静脉及曲张静脉造影及引导穿刺分流道。本研究中对照组分流道穿刺失败4例,原因在于肝动脉与门静脉空间相对位置并不恒定,穿刺具有一定盲目性;即使穿刺针进入门静脉,也可能由于折角等因素致导丝下行困难,尤其脾脏切除患者多伴门静脉血栓,盲穿时穿刺针到达门静脉无落空感或针道出血,难以判断针尖位置,导致错过导丝入路。本研究中,病例组门静脉均直接显影,分流道穿刺成功率显著高于对照组,分流道穿刺次数、穿刺时间及手术时间均低于对照组,且术中出血率亦显著降低(P均<0.05)。
TIPS可在降低门静脉高压的同时栓塞曲张静脉,从而降低曲张静脉再出血的风险,部分患者复发出血可能与曲张静脉栓塞不完全有关[11]。本研究随访期内2组分流道失效和肝性脑病发生率差异无统计学意义,但病例组术后无复发出血患者,可能与手术方式有关:病例组在保持门静脉高压下对曲张静脉造影更为完全,更易发现尚处于发展阶段的早期曲张静脉,栓塞可更彻底;而对照组先行分流道穿刺并门体分流,门静脉压力迅速下降,可使部分尚处于发展早期的曲张静脉闭缩而致漏诊,后期随着体循环及门静脉压力逐步回升,可能再次出血。
本研究中2组术后1周门静脉及脾静脉内径回缩、流速增加,下腔静脉流速增加,提示TIPS可短期内有效降低门静脉压力;肝动脉流速减低、RI增高,可能与肝动脉“缓冲器效应”有关[12-13]。TIPS后门静脉高速血流多未入肝,而血管活性物质浓度下降,引起肝动脉流速降低,导致肝脏缺血加重,肝细胞缺血缺氧坏死,进一步引发肝脏损害[12]。后期随着体循环自身平衡代偿等因素影响,分流道血流逐渐下降,肝动脉血流量逐步回升,以保障肝脏血供。本研究中2组术后门静脉流速减低、肝动脉流速增加及RI降低,也支持上述观点。
本研究中,病例组虽均成功穿刺,但大样本穿刺可能引起胆瘘及感染风险,且本研究随访期较短,有关术后长期分流道闭塞及曲张静脉复发率仍需加大样本量并长期随访研究。超声引导下门静脉穿刺并导引TIPS的成功率较高,但仍与操作者经验有关。选择靶血管既要避开伴行肝动脉,又要远离肝门,同时把握肝脏动度迅速下针,以确保穿刺成功。超声引导下经皮经肝门静脉穿刺并造影可解决既往间接造影图像不清晰、分流道穿刺靶目标不明确的问题;在门静脉直接显影基础上导引TIPS联合PTVE,不仅提高了分流道穿刺的准确率和成功率,同时对曲张静脉的栓塞更为彻底、完全,在缩短手术时间、提高手术成功率的同时,也降低了术后并发症发生风险。