产前超声联合MRI诊断胎儿先天性食管闭锁
2018-07-18雷雯婷许金枝
安 鹏,张 敏,王 瑜,冯 伟,雷雯婷,许金枝,张 贤
(湖北医药学院附属襄阳市第一人民医院超声影像科,湖北 襄阳 441000)
先天性食管闭锁(congenital esophageal atresia, CEA)是罕见消化道畸形,多因基因突变、病毒及环境影响等致未能分化为正常的消化管道或部分消化管道缺失,导致胎儿完全不能摄取营养,约占胎儿期畸形的1/3 000~1/4 000[1]。本文回顾性分析31胎CEA胎儿的资料,并与31胎产后正常胎儿对比,探讨产前超声、MRI诊断胎儿CEA的临床应用价值。
1 资料与方法
1.1 一般资料 回顾性分析2012年8月—2017年4月经引产、出生后手术或影像学检查(X线或CT)证实的31胎CEA胎儿(CEA组)的资料,均为单胎,孕妇年龄20~42岁,平均(31.3±6.7)岁,孕周24~31周,平均(27.48±2.11)周,首次妊娠23例,多次妊娠8例,孕妇均无畸形胎儿孕产史;调阅同期31胎产后正常胎儿(正常对照组)的资料,均为单胎,孕妇年龄24~43岁,平均(33.4±6.9)岁,孕周24~32周,平均(28.12±2.29)周,首次妊娠26例,多次妊娠5例,孕妇均无畸形胎儿孕产史。2组间孕妇年龄(t=-1.504,P=0.143)、孕周(t=-1.267,P=0.215)、妊娠情况(χ2=0.876,P=0.349)差异均无统计学意义。
1.2 仪器与方法
1.2.1 产前超声 采用GE Voluson E8和GE Voluson 730彩色超声诊断仪,具备三维成像及胎儿心脏诊断功能,凸阵探头,频率分别为3.0~5.5 MHz和5.0~8.0 MHz。按照国际妇产科超声协会(international society ultrasound in obsterics and gynecology, ISUOG)提出的标准化切面扫查胎儿及附属物[2]。测量胎儿双顶径(biparietal diameter, BPD)、头围(head circumference, HC)、腹围(abdominal circumference, AC)、股骨长(femur length, FL)、羊水深度(amniotic fluid deep, AFD)、胎盘厚度,计算脐动脉峰谷比(systolic pressure / diastolic pressure, S/D)、胎儿吞咽指数及羊水指数(amniotic fluid index, AFI),估算胎儿体质量(estimated fetal weight, EFW),EFW(g)=1.07×BPD3+0.3×AC2×FL[3-4];同时多切面扫查分析心脏及周围大血管结构,可选择胎儿心脏模式,重点扫查气管、食管周边、胸腔、心包、心房室、心室流入或流出道、主动脉弓、降主动脉、肺动静脉、腔静脉及动脉导管,观察是否存在食管凹陷、盲袋或食管离断等情况。
1.2.2 产前MRI 采用GE Signa Excite 1.5T MR扫描仪,相控阵心脏或体部线圈,行胎儿矢状位、冠状位及轴位扫描。嘱孕妇仰卧,平静呼吸,扫描序列及参数:单次激发快速自选回波序列,TE 60~90 ms,TR 1 800~2 500 ms,层厚5~6 mm,层间距0.5~1.0 mm,视野24 cm×24 cm~40 cm×40 cm,矩阵224×224,NEX 0.5。
1.3 联合诊断 产前超声发现胎儿HC、AC、AFI、S/D、吞咽指数、EFW异常并胃泡持续72 h不显示(间隔72 h复查)时提示存在CEA可能,进一步行MRI;如发现胎儿食管凹陷、盲袋或食管离断征象,即诊断为CEA。
1.4 统计学分析 采用SPSS 19.0统计分析软件。计量资料以±s表示,计数资料以百分率表示。采用配对样本t检验比较CEA组与正常对照组间胎儿及附属物产前超声各测量指标的差异及孕妇年龄、孕周的差异;采用χ2检验比较2组间孕妇妊娠情况的差异。P<0.05为差异有统计学意义。
2 结果
31胎CEA中,引产26胎(26/31,83.87%),其中2胎宫内死亡引产,24胎因宫内发育迟缓、胎儿窘迫或合并其他畸形后家属要求引产;活产5胎(5/31,16.13%),其中手术治疗3胎(3/31,9.68%),预后良好,保守治疗2胎(2/31,6.45%),分别于出生后2周、1个月死亡。Cross分型为Ⅰ型CEA 14胎(14/31,45.16%);Ⅱ型CEA 4胎(4/31,12.90%);Ⅲ型CEA 13胎(13/31,41.94%),其中Ⅲa型8胎(8/31,25.81%),Ⅲb型5胎(5/31,16.13%)。
CEA组31胎中,产前超声联合MRI检出21胎(图1),产前诊断阳性率为67.74%(21/31)。CEA组胎儿HC、AC、S/D、吞咽指数、AFI、EFW与正常对照组间差异均有统计学意义(P均<0.05),而BPD、FL、AFD、胎盘厚度与正常对照组间差异均无统计学意义(P均>0.05),见表1、2。
CEA组胎儿合并其他畸形情况见表3。CEA合并心血管系统畸形最常见(23/31,74.19%),包括右心室双出口8例、法洛四联症6例、大动脉转位5例、心内膜垫缺损2例及房间隔缺损2例。
表1 CEA组与正常对照组BPD、HC、AC、FL、S/D比较(±s,n=31)
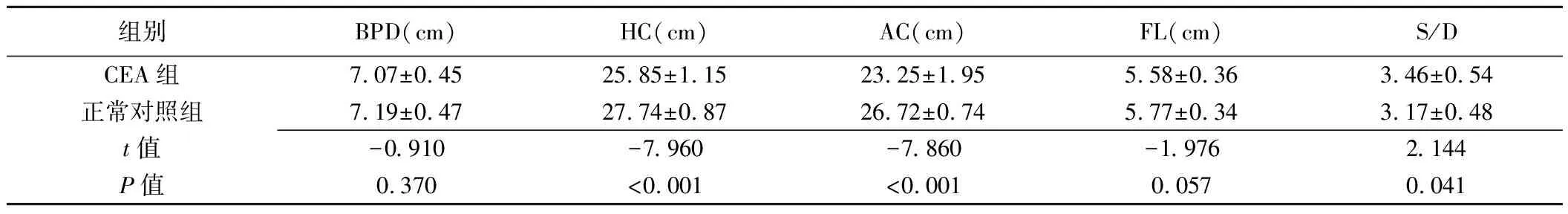
表1 CEA组与正常对照组BPD、HC、AC、FL、S/D比较(±s,n=31)
组别BPD(cm)HC(cm)AC(cm)FL(cm)S/DCEA组7.07±0.4525.85±1.1523.25±1.955.58±0.363.46±0.54正常对照组7.19±0.4727.74±0.8726.72±0.745.77±0.343.17±0.48t值-0.910-7.960-7.860-1.9762.144P值0.370<0.001<0.0010.0570.041
表2 CEA组与正常对照组AFD、AFI、EFW、吞咽指数及胎盘厚度比较(±s,n=31)

表2 CEA组与正常对照组AFD、AFI、EFW、吞咽指数及胎盘厚度比较(±s,n=31)
组别AFD(cm)AFI(cm)EFW(g)吞咽指数胎盘厚度(cm)CEA组7.94±1.4123.16±6.051 233.38±169.468.58±2.422.51±0.42正常对照组7.55±1.2615.76±2.131 534.59±162.5816.38±8.042.69±0.37t值1.2015.890-6.716-5.306-1.740P值0.239<0.001<0.001<0.0010.090

表3 CEA胎儿合并畸形情况(n=31)
3 讨论
随着产前超声、MRI技术的发展及Ⅲ级产前筛查的推广,产前可诊断约79.02%的胎儿畸形[5]。胎儿期食管多关闭,尚未形成如成人食管的管道状结构,仅通过产前超声不能直接诊断CEA胎儿,但可通过“胃泡持续72 h不显示(间隔72 h复查)、羊水过多及食管旁盲袋”高度疑诊CEA。
CEA胎儿出生后唾液无法下咽,呼吸时易溅入支气管导致吸入性肺炎,进而引发呼吸窘迫甚至窒息,较典型临床症状包括口腔分泌物增加,甚至出现白沫、血沫,吸痰后复见伴呼吸困难、紫绀或窒息,喂水后反复呕吐、呛咳或即喂即吐等。CEA按解剖结构可分为5型(即Cross分型):Ⅰ型CEA食管有2个盲端,分为近端和远端,不合并食管气管瘘,本组中此型占45.16%(14/31);Ⅱ型CEA食管近端与气管相通,合并食管气管瘘,盲端在远端,本组此型占12.90%(4/31);Ⅲ型食管盲端在近端,远端合并食管气管瘘,本组中占41.94%(13/31),此型依据食管远端与近端的距离分2种亚型,距离≥2 cm为Ⅲa型,<2 cm则为Ⅲb型,其中Ⅲa型CEA胎儿出生后食管手术治疗困难,而Ⅲb型CEA相对更易于手术治疗;Ⅳ型CEA食管两端均与气管相通,合并为2处气管食管瘘;Ⅴ型CEA食管全程通畅,但食管前壁与气管相通,合并为食管气管瘘。本研究未见Ⅳ型及Ⅴ型CEA,可能与样本量较小有关。研究[6]报道,在胚胎发育初期气管、食管均起始于原始前肠,原始前肠背侧和腹侧分别分化为食管和气管,胚胎8周内如出现前肠分化异常,即可形成CEA。食管闭锁、胃泡塌陷可致胎儿生长发育不良,国外学者[7]认为中晚孕期CEA胎儿较正常胎儿每天减少2 g蛋白质摄入;本研究发现CEA胎儿HC、AC明显小于正常胎儿,间接支持这一观点。本研究中,CEA组与正常对照组间BPD差异无统计学意义,原因可能为胎儿头部形状可呈圆形、椭圆形、方圆形等,BPD标准化切面测量难免存在客观差异,胎头位置低下时还存在声影声衰减、伪像干扰或盆骨组织干扰,对BPD进行对比分析不存在实际临床意义。胎儿钙质吸收主要由胎盘脐带供应。研究[8]报道,中晚孕期CEA胎儿FL不会出现明显缩短。本研究2组间FL差异无统计学意义,与既往研究结果相符。CEA导致消化道不同程度缺失、闭锁,胎儿无法吞咽并汲取羊水内营养,加之胎儿泌尿排泄功能未受影响,羊水量可进行性增加,致使AFI升高。本研究CEA组胎儿AFI明显高于正常对照组。由于胎儿体位不断变化,易形成月牙状、扇形、分隔状羊水切面,超声测量AFD存在主观性及误差。本研究CEA组与正常对照组间AFD差异无统计学意义。国外研究[9]报道,晚孕期CEA胎儿胎盘厚度菲薄,与过度吸收胎盘营养有关。但本研究发现中晚孕期CEA胎儿与正常胎儿胎盘厚度差异无统计学意义,与既往研究结果有所不同,可能为母体供养充裕胎盘优势发育所致。
CEA合并心血管等其他畸形发生率可达60%[10]。本研究中,CEA胎儿中合并心血管系统畸形者占74.19%(23/31),CEA组与正常对照组间S/D存在统计学差异,可能与此有关。超声对疑诊CEA胎儿体表及脏器各层面逐步仔细扫查,有利于发现包括心脏、胃肠、颅脑、双肾及神经系统等多系统合并畸形。
既往研究[11]报道,仅32%的CEA可在产前明确诊断。通过产前超声仅能对提出疑诊CEA,而非明确诊断。疑诊征象中,羊水过多属非特异性征象,若羊水过多合并持续性胃泡不显示,可高度疑诊CEA,但仅33.3%~49.5%的CEA胎儿同时出现这两种征象[12]。此外,虽然CEA胎儿羊水过多发生率接近54%,但这种征象的存在取决于CEA的类型,当CEA胎儿存在气管食管瘘时,通过瘘道可形成1条羊水通路或“食管盲袋”,使羊水充盈胸腹腔甚至胃腔,而并不表现为羊水过多,Ⅰ型CEA胎儿几乎均存在羊水过多,其中85%存在胃泡不显示征象,而在伴有气管食管瘘的Ⅱ、Ⅲ、Ⅵ、Ⅴ型CEA胎儿中,仅46.3%存在羊水过多,其中25%存在胃泡不显示征象[13],临床又以Ⅲ型CEA最为常见,因此产前明确诊断率较低。
对于超声疑诊CEA胎儿进一步行MRI筛查对产前诊断具有重要意义。与超声相比,MRI更易显示食管凹陷或离断,同时可避免超声的技术缺陷,如气体、骨组织对超声成像的干扰等。Salomon等[14]报道,MR连续序列扫描下,79%的CEA可见食管凹陷、盲袋。本组67.74%(21/31)CEA胎儿MRI可见食管凹陷、盲袋或食管离断。
总之,产前诊断CEA始终是一项挑战,气管食管瘘可掩盖“羊水过多”征象,发现胃泡消失、羊水过多、疑似异常羊水通路或食管旁盲袋隐现时,应结合产前超声、MRI进行综合分析。
