p53对绝经后HR阳性、HER-2阳性术后乳腺癌患者内分泌药物疗效的预测价值
2018-07-17霍明鸣
闫 石 霍明鸣 庞 慧 李 焱 蔡 莉
乳腺癌是全球女性最常见的恶性肿瘤之一,其在分子水平上呈现高度异质性。根据2015年St.Gallen国际专家共识,HR阳性、HER-2阳性乳腺癌被定义为:HER-2过表达或扩增,ER和/或PR≥1%[1]。内分泌治疗在HR阳性、HER-2阳性的乳腺癌中占有重要的地位。基础研究表明,HR阳性、HER-2阳性患者会对他莫昔芬(Tamoxifen,TAM)发生原发耐药[2]。芳香化酶抑制剂(Aromatase inhibitor,AI)是该类型患者内分泌治疗的首选药物,但是,在临床工作中仍有很多绝经后HR阳性、HER-2阳性乳腺癌患者服用TAM,目前关于预测TAM及AI治疗疗效的研究并不多。近期研究表明,p53蛋白过表达能够预测绝经后HR阳性术后乳腺癌患者对AI治疗的敏感性[3]。p53基因可以抑制肿瘤细胞的增长,阻滞细胞周期及促进细胞凋亡,被认为是目前最重要的抑癌基因之一[4]。本研究分析了p53蛋白表达对绝经后HR阳性、HER-2阳性术后乳腺癌患者内分泌药物疗效的预测作用。
1 资料与方法
1.1 一般资料
回顾性分析2005年1月—2011年12月在哈尔滨医科大学附属肿瘤医院治疗的172例绝经后HR阳性、HER-2阳性术后乳腺癌患者的临床病例资料。患者均为女性,年龄48~75岁,中位年龄56岁,其中有2例患者接受药物性卵巢去势,其他均为绝经后患者。患者一般情况包括肿瘤大小、淋巴结状态、组织学分级、病理分期、p53状态、ER表达、PR表达、是否口服内分泌药物、是否化疗、是否放射治疗和是否靶向治疗,详细临床病理特征见表1。患者中有84例接受AI治疗(AI组),有88例接受TAM治疗(TAM组)。
纳入标准:患者为乳腺癌根治术后,免疫组织化学染色显示HR阳性、HER-2阳性,辅助内分泌治疗期间规律服用AI或TAM药物,Karnofsky行为状态评分≥80分。排除随访病例资料不完整者,酗酒、药物成瘾或者精神异常者。所有研究材料均得到患者许可并签署知情同意书,且已经通过医学伦理委员会的批准。
1.2 免疫组织化学检测p53蛋白表达
172例乳腺癌标本经免疫组织化学SP法检测癌组织中ER、PR、HER-2、p53蛋白的表达情况。免疫组织化学染色结果由本院2位资深的病理科医师分别单独判定。免疫组化流程:(1)脱蜡,水化,PBS洗三次;(2)电炉煮沸抗原修复,冷却至室温,PBS洗三次;(3)3%双氧水室温下孵育,PBS洗三次;(4)滴加正常山羊血清封闭液,室温孵育20 min;(5)滴加一抗,室温静置30 min。一抗使用抗体分别为ER抗体(ab3577,Abcam,Cambridge,MA,USA,浓度1∶500),PR抗体(ab2765,Abcam,Cambridge,MA,USA,浓度1∶500),HER-2抗体(ab16662,Abcam,Cambridge,MA,USA,浓度1∶200),p53抗体(ab131442,Abcam,Cambridge,MA,USA,浓度1∶200),4℃冰箱过夜,PBS洗三次;(6)滴加二抗,室温静置30 min,PBS洗三次;(7)滴加辣根酶标记的链霉卵白素工作液,室温下孵育,PBS洗三次;(8)将DAB显色试剂A、B等量混合,自来水冲洗10 min;(9)苏木素复染10~20 s;(10)脱水、透明、封片、镜检。
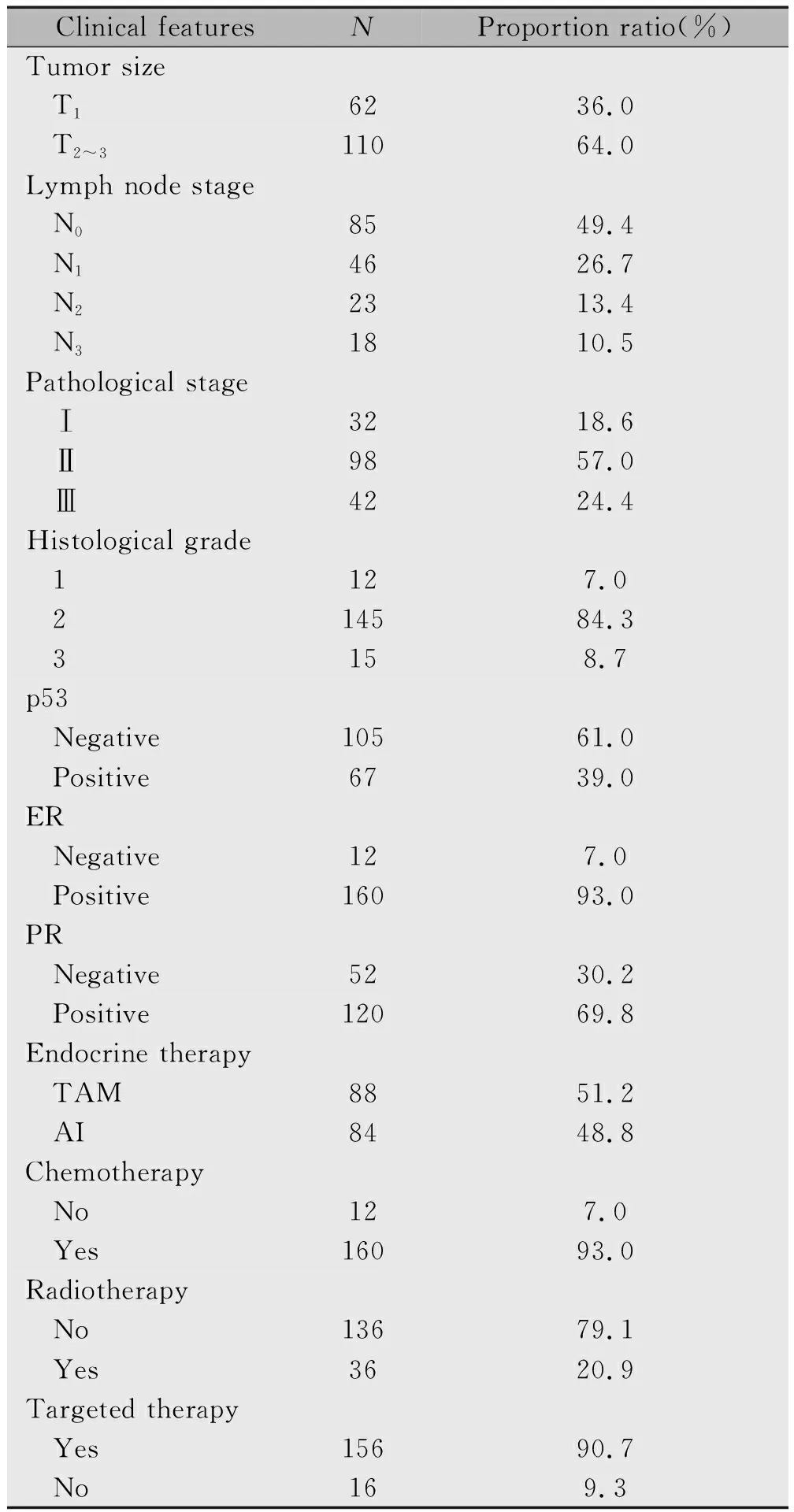
表1 172例乳腺癌患者的临床病理特征分析
Note:AI stands for aromatase inhibitor and TAM stands for Tamoxifen.
1.3 结果判读标准
激素受体(ER、PR)判读标准[5]:激素受体为肿瘤细胞核着色,着色细胞百分比≥1%为阳性,<1%为阴性。p53判读标准[6]:p53着色部位也是细胞核,癌细胞核内着黄棕色>10%为p53阳性,≤10%为阴性。HER-2判读标准[7]:细胞质和/或细胞膜着棕黄色为HER-2阳性细胞,阳性细胞计数百分比<25%为1+,25%~75%为2+,≥75%为3+,观察不到着色或着色很弱为阴性。以阴性和1+判断为HER-2无扩增,3+为HER-2有扩增,2+则加做FISH检测确定HER-2是否扩增。
1.4 随访
患者开始口服内分泌药物的时间为随访起始时间,采用查询电子病历及结合电话方式进行随访,随访截止日期为2016年4月11日。中位随访时间为68个月(4~131个月)。
1.5 统计学分析
应用SPSS 21.0统计学软件进行统计分析,利用卡方检验分析p53与乳腺癌临床病理特征之间的关系,并运用Kaplan-Meier法、Log-rank检验、Cox回归模型进行生存分析,P<0.05为差异有统计学意义。Cox多因素分析变量赋值见表2。

表2 Cox多因素分析变量的赋值表
2 结果
2.1 p53蛋白表达与不同临床病理特征之间的关系
p53蛋白表达与肿瘤大小、淋巴结状态、组织学分级、ER及PR表达均无关(P>0.05)(表3)。
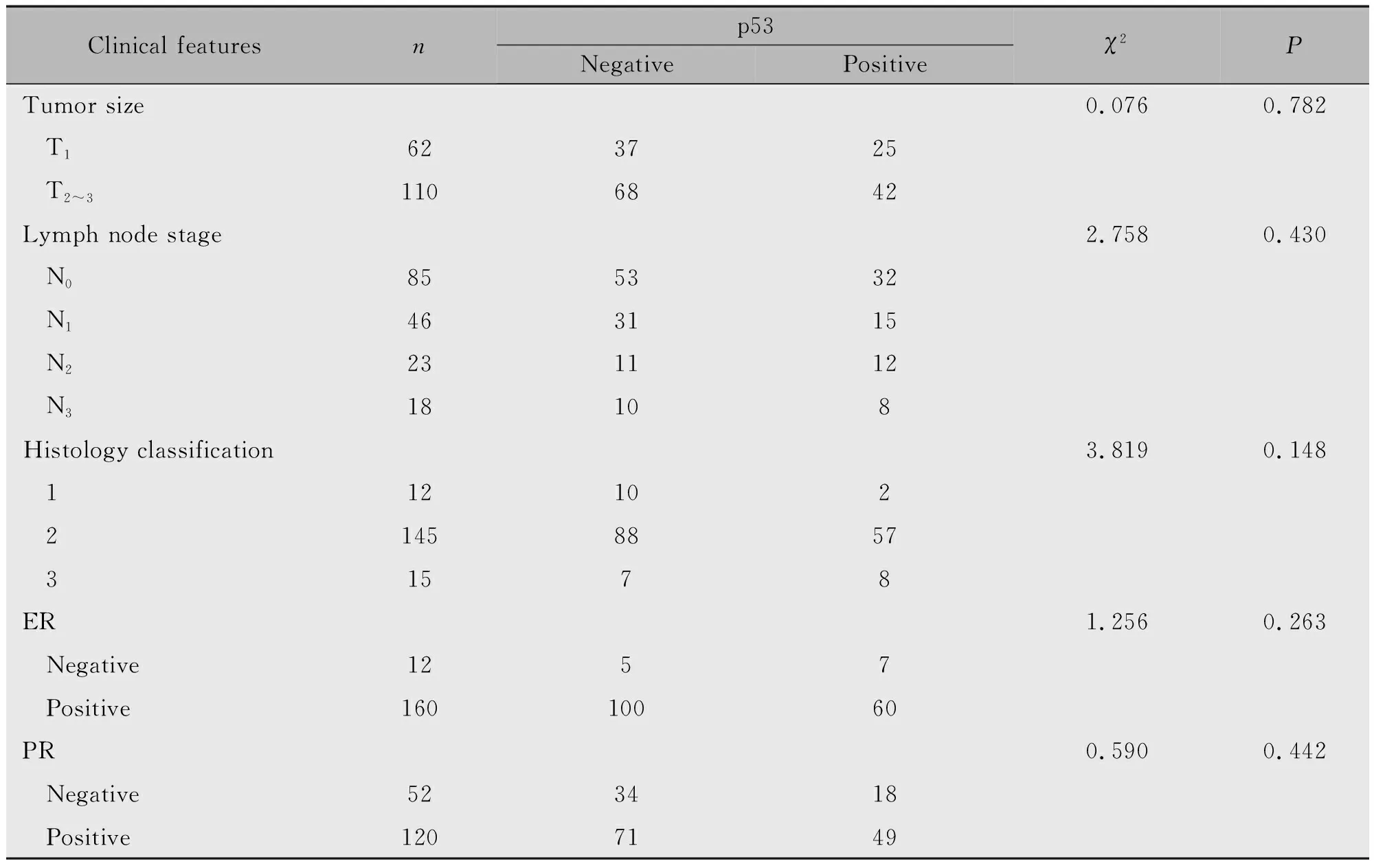
表3 172例乳腺癌患者临床病理特征与p53蛋白表达之间的关系
2.2 p53与患者DFS的关系
应用Log-rank检验进行单因素分析,结果显示淋巴结状态、是否放射治疗与乳腺癌患者的DFS有关(P<0.05),将两者纳入Cox多因素分析,结果显示淋巴结状态是乳腺癌的独立预后因素(表4)。p53蛋白表达与乳腺癌患者的DFS无关(图1a)。
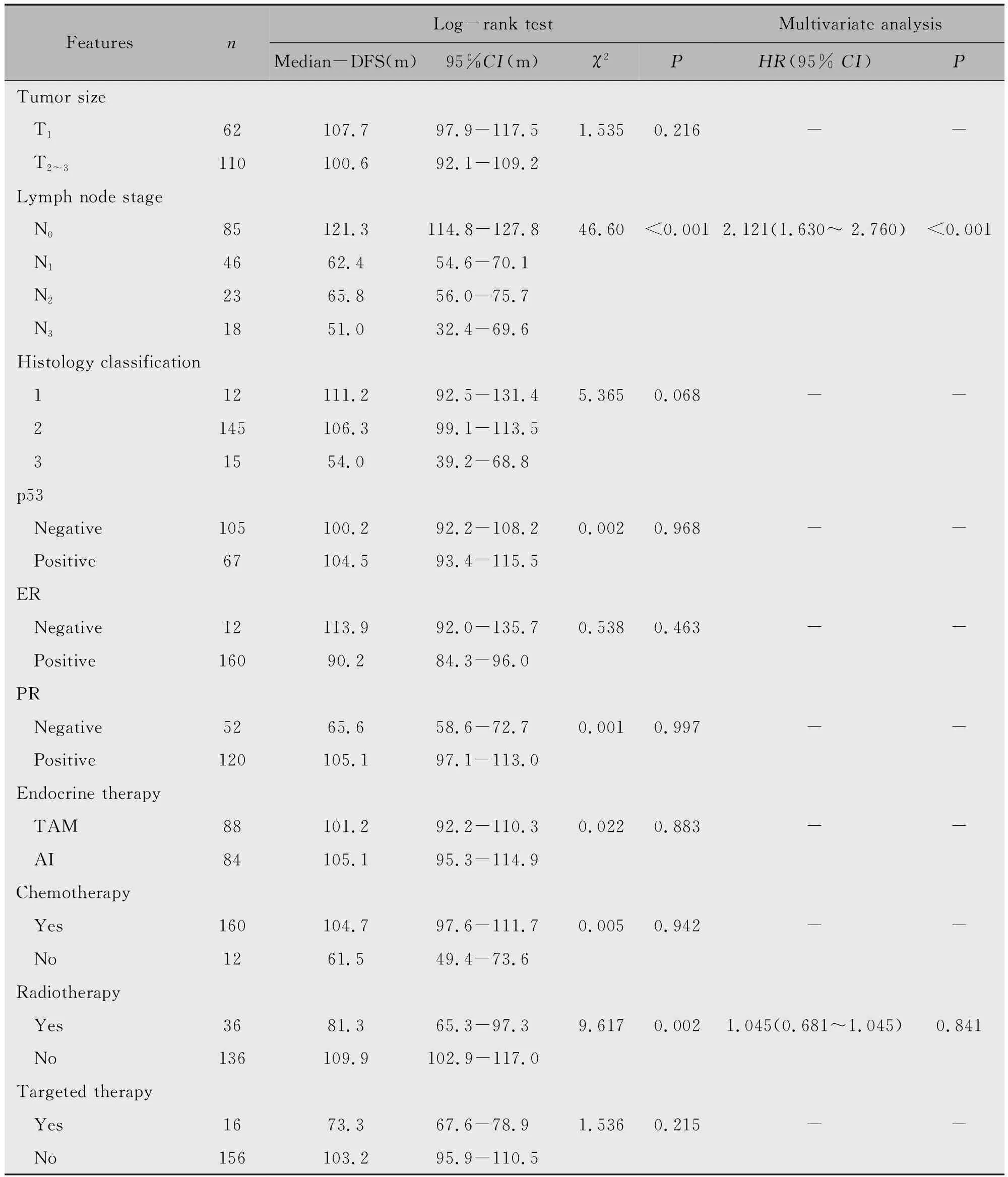
表4 172例乳腺癌患者DFS的单因素和多因素分析
Note:AI stands for aromatase inhibitor,TAM for Tamoxifen and DFS for disease-free survival.
2.3 p53在亚组分析中的结果
亚组分析显示:口服TAM组患者中,p53阳性者的DFS优于p53阴性者(图1b);口服AI组患者中,p53阴性者DFS优于p53阳性者(图1c)。
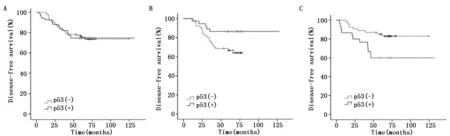
图1 p53蛋白表达与绝经后HR阳性、HER-2阳性术后乳腺癌患者无病生存(DFS)的关系Figure 1 The relationship between p53 protein expression and disease free survival(DFS)in postmenopausal breast cancer patients with HR-positive and HER-2-positiveNote:A.Comparison of DFS curves between p53-negative and p53-positive in 172 patients with breast cancer(χ2=0.002,P=0.968);B.Comparison of DFS curves between p53- negative and p53-positive in 88 patients of oral TAM(χ2=4.695,P=0.030);and C.comparison of DFS curves between p53-negative and p53-positive in 84 patients of oral AI(χ2=5.995,P=0.014).
3 讨论
内分泌治疗在激素受体阳性乳腺癌患者的治疗中有着重要地位。有临床试验表明,对于绝经后早期或者复发转移性乳腺癌患者的内分泌治疗,第3代AI(阿那曲唑、来曲唑、依西美坦)的疗效优于TAM[8]。因此,AI成为绝经后乳腺癌患者内分泌治疗的金标准[9-10],尤其在绝经后的HR阳性、HER-2阳性术后乳腺癌患者中,应用AI类药物内分泌治疗几乎成为了一种“习惯”。尽管基础研究显示HR阳性、HER-2阳性的患者对于TAM原发耐药[2],但是,目前在临床工作中由于患者的经济条件、药物的不良反应等因素的影响,导致部分绝经后患者仍然口服TAM内分泌治疗。TAM耐药与HER-2基因表达状态之间的关系已得到广泛探讨,实验室细胞水平的研究已经明确HER-2过度表达与TAM耐药相关[2],但在临床试验研究中并没有得出一致性的结论。近期关于内分泌耐药机制的研究很多,但是关于内分泌药物治疗疗效的预测因素尚未确定[11]。本研究回顾性分析了p53蛋白表达对绝经后HR阳性、HER-2阳性术后乳腺癌患者的预后及对内分泌疗效的预测作用,发现在绝经后HR阳性、HER-2阳性术后乳腺癌患者中,淋巴结转移可以作为乳腺癌的独立预后因素,p53蛋白表达不是乳腺癌的独立预后因素,并且,亚组分析显示,在口服TAM组患者中,p53阳性者的DFS优于p53阴性者(χ2=4.695,P=0.030),而在口服AI组的患者中,p53阴性者的DFS优于p53阳性者(χ2=5.995,P=0.014)。由此推测,p53蛋白阳性表达是TAM有效治疗的预测因子,而p53蛋白阴性表达是AI有效治疗的预测因子。
关于p53基因的研究近几年很多,大约有1/3的乳腺癌患者出现p53基因突变[12],其突变发生在肿瘤细胞核,p53免疫组织化学染色常用于标记其突变状态[13]。正常情况下,野生型的p53是抑癌基因,能够监视和控制细胞基因的完整性,抑制肿瘤的发生和发展,而突变型p53是显性癌基因,不仅失去了抑制肿瘤的功能,而且能诱发乳腺细胞的转化和癌变,使癌细胞无限的增殖,其阳性表达能够作为乳腺癌重要的预后标志物和预测因子[14-19]。p53在维持基因组稳定、控制细胞周期和诱导细胞凋亡方面有着重要的作用[20],p53可编码一种核磷酸化蛋白,该蛋白可调节细胞的生长和分化。p53突变能够导致其所编码蛋白的功能丧失,失去诱导细胞周期阻滞和细胞凋亡发生的作用[21]。李志华等[22]对乳腺癌组织p53表达与新辅助化疗疗效相关性进行的Meta分析也显示,p53能够作为乳腺癌新辅助化疗疗效敏感性的指标。Kai等[23]的研究显示,p53可作为预测激素敏感型复发转移性乳腺癌对第3代AI耐药的关键因子。通过全基因组分析可以发现p53突变与AI耐药之间呈显著正相关[24]。另有研究结果显示,p53蛋白过表达能够预测激素受体阳性早期绝经后乳腺癌对AI治疗的敏感性[4],这一生物标志物可能被用作筛查口服AI患者获益的一种工具[25]。以上这些研究均表明,p53基因及p53蛋白对于AI治疗的敏感性可能具有一定的预测作用。此外,有关乳腺癌细胞酶联免疫吸附实验的结果显示,p53表达与TAM耐药相关[26]。目前,关于p53与TAM治疗疗效之间的相关性还有待进一步深入研究。
另外,本研究随访的是2005年—2011年在本院治疗的绝经后HR阳性、HER-2阳性乳腺癌患者,样本量较少,有待进一步扩大样本量。另外当时抗HER-2靶向药物价格昂贵,患者使用率低,存在一些治疗局限性。随着曲妥珠单抗等靶向药物相继纳入医保,越来越多的患者能够接受正规治疗,我们期待能分析出更可靠的结果。
综上所述,本研究结果提示p53蛋白阳性表达是TAM有效治疗的预测因子,而p53蛋白阴性表达是AI有效治疗的预测因子;需要进一步扩大样本量,延长随访时间,并且,每一种内分泌治疗药物与p53表达状态之间的关系均值得深入研究,以便进一步提高内分泌治疗疗效。
