乳酸链球菌素对腹泻小鼠盲肠菌群结构及脂代谢的影响
2018-07-16贺美玲王纯洁贾知锋斯木吉德吉米斯敖日格乐
贺美玲 王纯洁 贾知锋 斯木吉德 吉米斯 刘 波 陈 浩 超 克 敖日格乐*
(1.内蒙古农业大学动物科学学院,呼和浩特 010018;2.内蒙古农业大学兽医学院,呼和浩特 010018)
通过摄入益生菌可平衡动物肠道内菌群结构,通过研究益生菌的代谢产物[如乳酸链球菌素(Nisin)]对肠道微生物多样性和脂代谢的影响[1],可以帮助人们深入了解益生菌的代谢产物对肠道菌群和肥胖症的影响。肥胖症是由能量摄入和代谢不平衡所引起的一种慢性疾病,其一直影响着动物的胴体品质[2]。近年来,研究发现,肠道菌群与肥胖存在密切的相关性,而脂代谢的紊乱严重影响了肠道菌群的结构[3]。据研究发现,肠道微生物群落对于处理膳食多糖是必不可少的,并发现与无菌饲养相比,正常饲养使小鼠体内脂肪量增加60%,胰岛素含量减少[4]。金属肽酶含血小板反应蛋白1(ADAMTS1)是调控脂肪干细胞分化成脂肪细胞的关键因子。高脂饮食以及糖皮质激素类药物会下调ADAMTS1的分泌,最终导致脂肪的增加[5]。乳酸乳球菌可用于治疗炎症性肠病、溃疡性结肠炎、腹泻、乳糜泻、变态反应和口腔黏膜炎等[6-7]。致病性大肠杆菌(E.coli)可引起多种疾病的发生,如腹泻及败血症等[8]。致病性E.coliO1是犊牛腹泻病最常见的病原菌之一[9]。目前,抗生素广泛应用于治疗人类及家畜腹泻病,而抗生素的滥用使细菌耐药性增加[10-11]。据研究,Nisin在治疗小鼠腹泻方面有望替代抗生素,Nisin对家畜脂代谢十分重要[12]。本试验通过致病性E.coliO1构建小鼠腹泻模型,然后对腹泻小鼠灌胃Nisin,研究Nisin对腹泻小鼠盲肠菌群结构以及血清、空肠、回肠与脑组织中ADAMTS1、总胆固醇(TC)和胰岛素(INS)含量的影响,以期为研究Nisin这类益生菌代谢产物对肠道菌群和脂代谢的影响奠定基础。
1 材料与方法
1.1 试验材料
受试菌:牛源致病性E.coliO1和Nisin均由内蒙古农业大学动物生产学实验室从奶牛直肠粪样中分离提取纯化[13]。
抗生素:氨苄青霉素(ampicillin)购自葵花药业集团湖北武当有限公司;盐酸环丙沙星(ciprofloxacin)购自吉林省百年六福堂药业有限公司。
1.2 试验动物
7~9周龄无特定病原体(SPF)级小鼠,雌雄各占1/2,体重(20±2) g,购自内蒙古医科大学实验动物中心。小鼠饲养在恒定温度[(22±2) ℃]和湿度[(55±5)%]的环境中,饲喂SPF级饲料[14]。
1.3 试验方法
1.3.1试验分组及给药方案
选择7~9周龄SPF级50只小鼠(雌雄各占1/2),随机分成5组,分别为空白对照组、阴性对照组、环丙沙星组、氨苄青霉素组及Nisin组。除空白对照组腹腔注射灭菌生理盐水(0.2 mL/只)外,其余各组小鼠均连续3 d腹腔注射致病性E.coliO1悬液(2.50×1011CFU/mL)0.2 mL/只构建小鼠腹泻模型[15]。连续注射3 d后,各组小鼠灌服对应试验药品(给药方案见表1),连续灌服15 d,2次/d(08:00、16:00),每次0.3 mL,在第15天灌胃2 h后对小鼠进行样品采集。

表1 试验分组情况及给药方案
每只动物单次所用药量需用0.3 mL蒸馏水配合灌服。
The dose of each animal used a single dose of 0.3 mL of distilled water in conjunction with gavage.
1.3.2样品采集
在试验期间每天称小鼠体重,在第15天灌胃2 h后,每组取7只小鼠,脱臼处死,通过眼眶采血,分离血清并保存;在无菌操作台中对每只小鼠进行消毒处理后,打开小鼠腹腔分别称取0.5 g盲肠内容物以及空肠、回肠和脑组织并迅速置于无菌无酶的2.5 mL离心管中,然后放入-80 ℃超低温冰箱保存备用。
1.3.3指标测定
将空肠、回肠与脑组织进行研磨后,分别称取0.1 g各加900 μL的磷酸盐缓冲液(PBS),制备成组织匀浆液,混匀并离心保留上清液,放入-80 ℃超低温冰箱保存备用。对血清、空肠、回肠及脑组织采用酶联免疫吸附测定(ELISA)法检测ADAMTS1、TC和INS的含量,按照说明书操作,试剂盒均购自北京诚林生物科技有限公司。
将装有盲肠内容物的离心管放入干冰中送往北京诺禾致源生物信息科技有限公司,对细菌341F(5′-CCTACGGGNGGCWGCAG-3′)、805R(5′-GACTACHVGGGTATCTAATCC-3′)16r RNA V3~V4区进行扩增测序。详细步骤见参考文献[17]。利用barcode区分样品序列,将各组样本序列过滤后,进行Alpha多样性及菌群结构分析,Alpha多样性指数包括丰富度指数(Chao1指数、ACE指数)、多样性指数(Simpson指数、Shannon指数)、覆盖率(Coverage指数)。利用Mothur软件对每组样品的操作分类单元(OTU)进行聚类分析,其代表了组间样品的丰度[18]。
1.4 数据统计
用Excel 2016处理数据,采用SAS 9.0统计软件对数据进行单因素方差分析,P<0.05为有显著性差异,认为具有统计学意义。
2 结果与分析
2.1 Nisin对小鼠体重的影响
由表2可知,1~5 d阶段,Nisin组小鼠的体重显著高于空白对照组和阴性对照组(P<0.05)。在6~10 d阶段,Nisin组小鼠的体重显著高于其他各组(P<0.05),其他各组之间无显著差异(P>0.05)。在11~15 d阶段,Nisin组小鼠的体重显著高于阴性对照组、环丙沙星组及氨苄青霉素组(P<0.05),与空白对照组差异不显著(P>0.05)。上述结果说明Nisin能有效缓解感染E.coliO1对小鼠体重的影响。
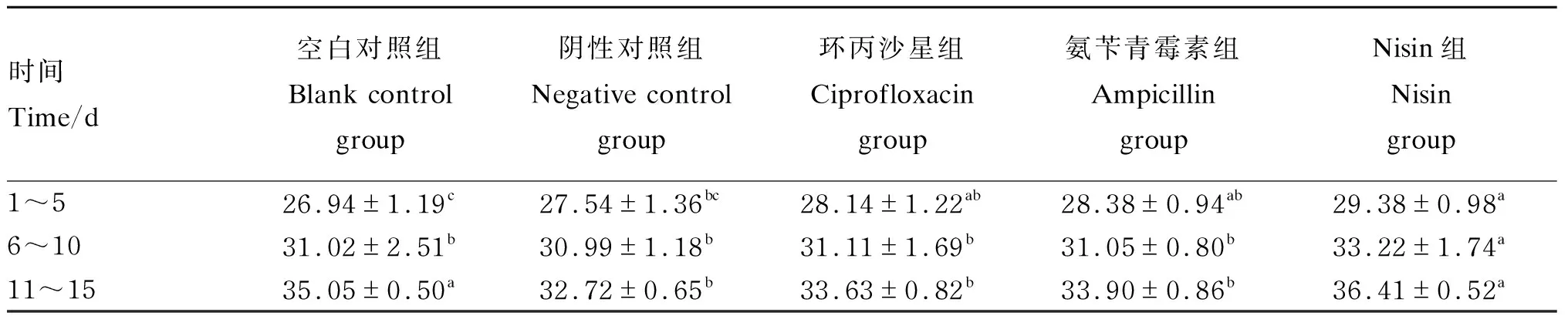
表2 Nisin对小鼠不同阶段体重的影响
同行数据肩标不同小写字母表示差异显著(P<0.05)。下表同。
Values in the same row with different lower case letter superscripts are significantly different (P<0.05). The same as below.
2.2 Nisin对小鼠血清、空肠、回肠与脑组织中ADAMTS1含量的影响
由表3可知,在血清中,Nisin组小鼠ADAMTS1的含量显著低于空白对照组和阴性对照组(P<0.05);在空肠中,Nisin组小鼠ADAMTS1的含量显著低于阴性对照组(P<0.05),显著高于环丙沙星组和氨苄青霉素组(P<0.05);在回肠中,Nisin组小鼠ADAMTS1的含量显著低于其他各组(P<0.05);在脑组织中,Nisin组小鼠ADAMTS1的含量显著低于空白对照组和阴性对照组(P<0.05),显著高于环丙沙星组(P<0.05)。

表3 Nisin对小鼠血清、空肠、回肠与脑组织中ADAMTS1含量的影响
2.3 Nisin对小鼠血清、空肠、回肠与脑组织中TC含量的影响
由表4可知,在血清中,Nisin组TC的含量高于阴性对照组、环丙沙星组和氨苄青霉素组,低于空白对照组,但差异均未达显著水平(P>0.05);在空肠中,Nisin组TC的含量与空白对照组差异不显著(P>0.05),但显著高于其他各组(P<0.05);在回肠中,Nisin组TC的含量显著高于环丙沙星组(P<0.05);在脑组织中,Nisin组TC的含量显著低于氨苄青霉素组(P<0.05),显著高于其他各组(P<0.05)。
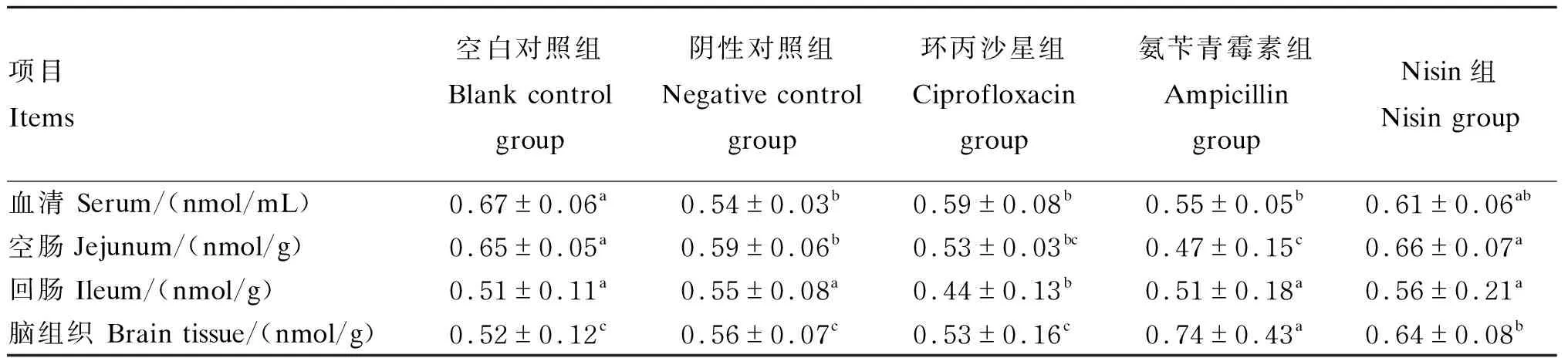
表4 Nisin对小鼠血清、空肠、回肠与脑组织中TC含量的影响
2.4 Nisin对小鼠血清、空肠、回肠与脑组织中INS含量的影响
由表5可知,在血清中,Nisin组和空白对照组INS的含量显著高于其他各组(P<0.05),且以Nisin组的含量最高;在空肠中,氨苄青霉素组INS的含量显著低于其他各组(P<0.05),阴性对照组INS的含量显著高于其他各组(P<0.05);在回肠中,空白对照组INS的含量显著高于其他各组(P<0.05),Nisin组INS的含量显著低于其他各组(P<0.05);在脑组织中,空白对照组中INS的含量显著高于其他各组(P<0.05),环丙沙星组的INS含量显著低于其他各组(P<0.05)。
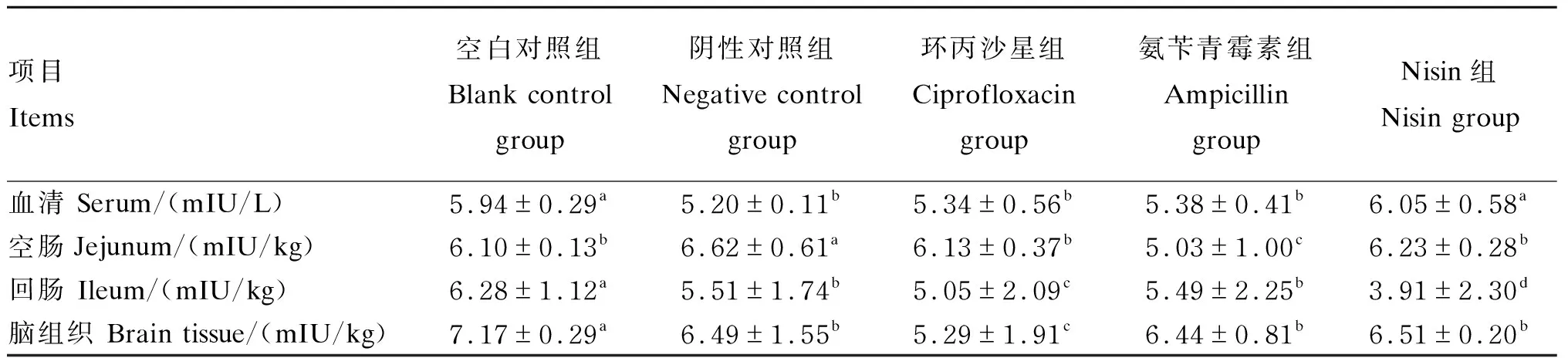
表5 Nisin对小鼠血清、空肠、回肠与脑组织中INS含量的影响
2.5 Nisin对小鼠盲肠菌群多样性的影响
由表6可知,在各组盲肠内容物样品中,菌群OTU数量最多的是空白对照组(1 652.75),其次是Nisin组(1 507.75),最小是氨苄青霉素组(930.0),说明Nisin组和空白对照组盲肠中菌群丰度很高,并且各组间存在差异。在盲肠内容物样品中,Nisin组的菌群Alpha多样性指数中的ACE指数(1 417.25)、Chao1指数(1 378.45)和Shannon指数(7.56)均显著高于阴性对照组(ACE指数为969.54,Chao1指数为340.29,Shannon指数为6.63)(P<0.05),Simpson指数(0.003 3)显著低于阴性对照组(0.017 4)(P<0.05)。这表明Nisin组小鼠中盲肠菌群多样性高于阴性对照组。Nisin组Shannon指数在5个组中最大,Simpson指数在5个组中处在较低水平,说明Nisin组小鼠盲肠菌群多样性在5个组中处在较高水平。各组盲肠内容物菌群的Coverage指数均在9.7以上,因此,样品测序质量较高,未被检测到的可能性极低。
利用Mothur软件对各组样品进行注释。通过对各组间小鼠盲肠内容物的16S rRNA V3~V4区测序,根据物种注释结果,各组在门水平上的物种相对丰度见图1。Nisin组中疣微菌门(Verrucomicrobia)、蓝细菌门(Cyanobacteria)、拟杆菌门(Bacteroidetes)及厚壁菌门(Firmicutes)为优势菌门。阴性对照组中放线菌门(Actinobacteria)、芽单胞菌门(Gemmatimonadetes)、变形菌门(Proteobacteria)及拟杆菌门为优势菌门。环丙沙星组中厚壁菌门、放线菌门、纤线杆菌纲(Ktedonobacteria)(未定门)及Coriobacteriia(未定门)为优势菌门。氨苄青霉素组中脱铁杆菌门(Deferribacteres)及厚壁菌门为优势菌门。空白对照组中拟杆菌门、厚壁菌门及Saccharibacteria为优势菌门。

表6 各组小鼠盲肠内容物中菌群OTU数量及Alpha多样性指数
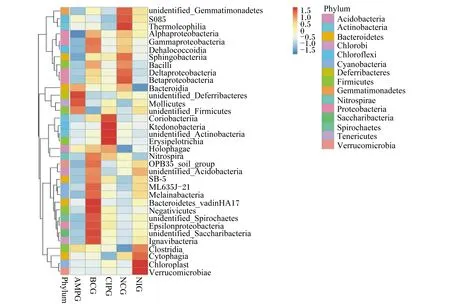
AMPG:氨苄青霉素组 ampicillin group;BCG:空白对照组 blank control group;CIPG:盐酸环丙沙星组 ciprofloxacin group;NCG:阴性对照组 negative control group;NIG:Nisin组 Nisin group;Phylum:门。
图1各组物种相对丰度聚类图
Fig.1Cluster of relative abundances of species in groups
2.6 Nisin对小鼠盲肠菌群构成的影响
5组盲肠内容物样品中在门水平上排名靠前的4种菌群所占比例见表7。Nisin组中厚壁菌门所占比例显著高于其他各组(P<0.05),拟杆菌门所占比例显著低于其他各组(P<0.05)。这说明Nisin有利于增加小鼠盲肠中厚壁杆菌门的数量,降低拟杆菌门的数量。

表7 在门水平上各组小鼠盲肠内容物中菌群构成
3 讨 论
动物肠道内生存着大量的细菌,一旦肠道生物屏障中的微生态系统失衡,就会导致大量致病菌(如大肠杆菌等)入侵和定植[19]。此外,肠道也是动物吸收营养物质的重要场所,摄入过多的食物后体内脂肪开始堆积[20]。肠道菌群在调节能量代谢过程中起到非常重要的作用,调整菌群的失衡可使体重、血清TP含量和空腹血糖水平显著下降[21]。给无菌小鼠定植肠道菌群后,其消耗高脂高糖食物的量显著增加,由此说明肠道菌群可显著增强小鼠的消化能力,从而使小鼠获取食物能量的能力加强[22]。肠道内致病菌和益生菌(如双歧杆菌、乳酸杆菌等)数量的变化是肠道健康的重要指标[23]。Yassour等[24]认为,抗生素对肠道菌群的影响机制还未清晰,但抗生素可显著影响人类及动物肠道菌群的多样性。同时,人类及动物肠道中存在着的大量细菌可帮助分解难以消化的食物。把正常小鼠的肠道菌群移植给无菌小鼠,在摄食量未增加的情况下,无菌小鼠的体脂含量显著增加,同时一些与脂代谢相关的因子的含量也发生了改变,这些改变也许是因为肠道菌群影响宿主对食物中能量的吸收所致[25]。ADAMTS1控制脂肪分化和监管脂肪平衡的关键分子[5]。研究发现,成熟的脂肪细胞会正常分泌ADAMTS1[26-27]。目前,对小鼠肥胖症的研究主要是通过检测小鼠血液中相关因子的信号通路和相关蛋白的表达量以及通过高通量检测肠道菌群的结构谱来进行的[28]。具有高的ADAMTS1含量的小鼠,它们体内的脂肪存储量比野生小鼠的脂肪存储要小[29-30]。ADAMTS1能够阻止糖皮质诱导的脂肪分化[31]。研究表明,通过降低脂肪组织中ADAMTS1的含量可导致小鼠脂肪组织重量增加、INS敏感性下降及脂代谢紊乱,这一发现与ADAMTS1在肥胖小鼠中的表达下调及ADAMTS1的表达量与人体的身体质量指数(BMI)呈负相关的结果相一致[32]。肥胖常导致脂代谢紊乱,其机制是由于内脏脂肪堆积,促进糖异生,高含量的INS使食欲增加,加重胆固醇代谢紊乱,促进肥胖加重[33]。研究发现,食用含乳酸球菌食物后,人体血液中高密度脂蛋白的含量显著升高[34],但是食用含乳酸杆菌食物后,人体血液中高密度脂蛋白的含量显著降低[35]。在饲粮中添加微生物菌种可提高猪的生产性能和自身免疫力,在改善营养物质代谢等方面效果显著[36]。乳酸发酵的乳酸乳球菌最近被评估为潜在的益生菌[37]。本试验中,益生菌的代谢产物Nisin能缓解小鼠体重的增加,降低小鼠血清中TC的含量,从而达到改善小鼠肠道菌群结构及脂代谢紊乱的效果,这说明Nisin有降低患心脑血管病的危险的作用[38-39];同时,Nisin能降低回肠中INS的含量,对调节脂代谢合成具有重要意义,这一结果与Xu等[40]所得结果一致。研究发现,肥胖与拟杆菌门及厚壁菌门相对丰度的改变存在关系,饮食治疗前,肥胖者与苗条者比较,其肠道中拟杆菌门的数量非常少,但厚壁菌门数量较多,饮食治疗后,肥胖者出现了肠道中拟杆菌门数量增加、厚壁菌门数量减少的现象[25]。
本研究中,与阴性对照组相比,Nisin可使小鼠血清、空肠、回肠和脑组织中ADAMTS1含量显著降低,血清、空肠和脑组织中TC的含量增加,回肠中INS的含量降低,导致小鼠体重增加;Nisin使小鼠盲肠内容物中厚壁菌门的数量增加,拟杆菌门的数量降低,说明Nisin可调节小鼠盲肠菌群构成;Nisin使小鼠盲肠内容物菌群的ACE、Chao1、Shannon指数显著增加,Simpson指数显著降低,说明Nisin可提高小鼠盲肠菌群多样性。此外,阴性对照组小鼠盲肠内容物菌群的ACE指数、Chao1指数、Shannon指数最低较空白对照组显著降低,Simpson指数较空白对照组显著升高,说明E.coliO1可破坏小鼠肠道微生物的动态平衡,使小鼠盲肠菌群多样性显著降低,这一结果与李艺等[41]所得结果相似。
综上所述,一方面,Nisin通过降低血清、空肠、回肠和脑组织中ADAMTS1的含量和回肠中INS的含量,增加血清、空肠和脑组织中TC的含量,使小鼠体重增加;另一方面,Nisin通过增加小鼠肠道内容物中菌群的多样性,增加厚壁菌门和蓝细菌门的数量,降低拟杆菌门的数量,调整盲肠菌群结构。可见,Nisin很可能是通过改变小鼠肠道固有菌群结构使小鼠体重及激素分泌发生变化。
4 结 论
Nisin可提高盲肠菌群多样性,降低血清、回肠和脑组织中ADAMTS1的含量和回肠中INS的含量,增加血清、空肠和脑组织中TC的含量,从而影响腹泻小鼠盲肠菌群结构及脂代谢。
