热休克蛋白70在牦牛胃中的分布和表达
2018-07-16杨晓晴何俊峰刘鹏刚
杨晓晴 崔 燕 何俊峰 杨 雪 刘鹏刚 廖 博 李 慧 孙 娟
(甘肃农业大学动物医学院,兰州 730070)
热休克蛋白70(heat shock protein,HSP70)是机体在不良因素刺激下产生的一类特殊应激蛋白,普遍存在于自然界生物体内,具有调节细胞增殖分化、抗凋亡、抗应激及参与免疫应答等多种重要生理功能[1-3]。近年来,HSP70在胃肠道的研究为胃肠道疾病的治疗提供了重要的线索和依据,成为人们关注的热点。目前,国内外有关HSP70在胃中的研究主要集中于大鼠[4]、小鼠[5]、猪[6]及人[7]等单胃动物,其在反刍动物胃中的分布及表达量尚不清楚。牦牛(Bosgrunniens)是生活在我国青藏高原地区的反刍动物,采食较为粗糙的牧草,这对胃黏膜损伤较大[8]。研究发现,HSP70作为胃肠黏膜细胞的分子伴侣,对胃肠黏膜细胞有重要的保护作用[9]。因此,本试验采用免疫组化及蛋白质免疫印迹(Western blotting, WB)法检测HSP70在牦牛各胃的分布特征及表达量的差异性变化,旨在进一步探究HSP70对牦牛胃的保护作用,为牦牛胃的新陈代谢及生理机能研究提供理论基础。
1 材料与方法
1.1 试验材料
2016年9月从青海西宁屠宰场选择8头健康成年(3~5岁)牦牛,雌雄各占1/2,体重为(600~900) kg。经颈动脉放血处死后,迅速剪切瘤胃、网胃、瓣胃及皱胃组织,去掉内容物后用无菌生理盐水冲洗干净。一部分组织样品浸于4%的多聚甲醛磷酸盐缓冲液(pH 7.3)中,以备制作石蜡切片;另一部分组织样品快速放入液氮中,待后期移至-80 ℃保存,用于提取蛋白质。
1.2 试验方法
1.2.1组织学方法及免疫组化法检测HSP70在牦牛各胃的分布
将固定好的组织样品制成石蜡切片,切片厚度为4 μm。用以下3种方法对其进行染色:1)嗜银染色(Gordon sweet),观察并定位皱胃组织中的内分泌细胞。2)阿利新蓝-过碘酸-雪夫(Alcian blue-periodic acid-Schiff,AB-PAS)染色,进一步观察并定位皱胃组织中的分泌细胞。3)使用HSP70兔多克隆抗体(英国Abcam公司)按1∶1 000稀释后,进行免疫组化切片染色,具体方法参照SP试剂盒说明书进行。用磷酸盐缓冲液(PBS)(0.01 mol/L)代替一抗作阴性对照,苏木精复染,酒精梯度脱水,封片,用Olympus-DP71型光学显微系统观察其阳性反应并拍照。
1.2.2WB法检测HSP70在牦牛各胃的表达量
将蛋白质样品调为同一浓度后,按各比例分别加入4×十二烷基硫酸钠(SDS)的上样缓冲液,100 ℃水浴10 min,使蛋白质变性后放入4 ℃保存。待分离胶和浓缩胶制好后加样,每孔蛋白质样品上样量为15 μL,进行SDS-聚丙烯酰胺凝胶电泳,当电泳至分离胶与浓缩胶交界处时更换电压,电压由原来的80 V切换为150 V。电泳结束后,根据Marker条带切下目的蛋白所处的胶冰浴转膜至醋酸纤维素(PVDF)膜。将转膜后的PVDF膜放入5%脱脂牛奶中,室温封闭2.5 h。一抗HSP70兔多克隆抗体(英国Abcam公司)用脱脂奶粉按1∶1 000稀释,将封闭后的PVDF膜放入一抗4 ℃孵育过夜。次日用吐温-磷酸盐缓冲液(PBST)洗10min,重复3次;将二抗羊抗兔免疫球蛋白G(IgG)(bs-0295G-HRP,北京博奥森生物技术有限公司)用脱脂奶粉按1∶1 000稀释后,PVDF膜放入二抗孵育1.5 h。ECL曝光液(碧云天生物技术公司)(A液、B液体积比为1∶1避光混匀)滴加在PVDF膜上,暗室显影30 s后用X光胶片曝光、显影、定影。胶片晾干后用扫描仪采集图片。用β肌动蛋白(β-actin)做内参。通过ImageJ软件分析WB条带表达量。
1.3 数据分析
分别选取牦牛不同胃组织的HSP70免疫组化切片各10张,每张切片随机选取10个视野(1 000×),采用Image-Pro plus 6.0软件测定HSP70阳性反应物的积分光密度值。数据采用SPSS 19.0软件对各试验组数据进行单因素方差分析,试验数据用平均值±标准误(mean±SE)表示,P<0.01时判为差异极显著,P>0.05时判为差异不显著。
2 结 果
2.1 牦牛皱胃的组织学特点
嗜银染色结果表明,牦牛皱胃腺体间含有大量嗜银细胞分布,且这些嗜银细胞显色强弱不同,有一定的差异。内分泌细胞具较强的嗜银性,呈黑褐色;壁细胞嗜银性次之,呈棕黄色;主细胞无嗜银性,不着色(图1-A)。
AB-PAS染色结果发现,皱胃腺体间的一些内分泌细胞呈深红色,壁细胞呈淡红色,主细胞呈蓝色(图1-B)。
2.2 HSP70在牦牛各胃的分布
免疫组化结果显示,在牦牛瘤胃、网胃、瓣胃,HSP70仅在黏膜上皮细胞层表达,呈棕黄色。其中,角质层细胞呈强阳性表达,基底层、颗粒层和棘细胞层的部分细胞呈中等阳性反应,部分细胞不表达(图1-C、图1-D、图1-E);在皱胃,HSP70不仅在黏膜表面上皮细胞有表达,胃腺间的内分泌细胞及壁细胞也呈阳性表达(图1-F)。阳性反应主要集中在细胞的胞质和胞核。积分光密度值分析发现,HSP70在牦牛皱胃的阳性反应最强,瘤胃次之,网胃较低,瓣胃最低,各胃之间表达量的差异极显著(P<0.01)(表1)。
2.3 HSP70在牦牛各胃的表达量
WB检测结果显示,HSP70在牦牛瘤胃、网胃、瓣胃和皱胃均有表达(图2)。采用ImageJ软件分析发现,HSP70表达量在牦牛各胃间差异极显著(P<0.01),皱胃最高,瘤胃次之,网胃较低,瓣胃最低(表2)。
3 讨 论
1987年学者在犬胃黏膜首次发现了一类能被铬盐染色的细胞,随后研究发现这些细胞具有共同的特征,即在苏木精-伊红(HE)染色中很难辨认,而经嗜银染色后观察这些嗜银细胞呈黑褐色或棕黄色,反差较强极易辨认,学者推测此类细胞为内分泌细胞[10]。牦牛作为反刍动物,前胃(瘤胃、网胃、瓣胃)具有机械消化的作用,唯有皱胃腺体间含有大量的分泌细胞,具有真正消化意义的胃。因此,本试验采用嗜银染色,对牦牛皱胃腺体间细胞进行了鉴定,发现牦牛皱胃腺体间也存在有大量嗜银细胞。其中,内分泌细胞呈黑褐色,壁细胞呈棕黄色,而主细胞却无嗜银现象。这与双峰驼胃底腺的研究结果[11]相似。此外,该染色鉴别了牦牛皱胃腺体间的分泌细胞,为后期观察免疫组化阳性细胞类型奠定了基础。
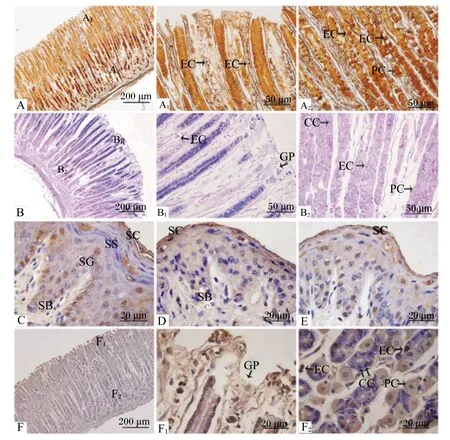
A、A1、A2分别为皱胃、皱胃胃小凹、皱胃腺体,嗜银染色;B、B1、B2分别为皱胃、皱胃胃小凹、皱胃腺体,AB-PAS染色;C、D、E分别为瘤胃、网胃、瓣胃,免疫组化染色;F、F1、F2分别为皱胃、皱胃胃小凹、皱胃腺体,免疫组化染色。EC:内分泌细胞;PC:壁细胞;GP:胃小凹;CC:主细胞;SC:角质层;SG:颗粒层;SS:棘层;SB:基底层。
A, A1and A2was the abomasum, the gastric pit of abomasum and the gland of abomasum, respectively, Gordon sweet staining; B, B1and B2was the abomasum, the gastric pit of abomasum and the gland of abomasum, respectively, AB-PAS staining; C, D and E was the rumen, the reticulum and the omasum, respectively, immunohistochemistry staining; F, F1and F2was the abomasums, the gastric pit of abomasum and the gland of abomasum, respectively, immunohistochemistry staining. EC: endocrine cell; PC: parietal cell; GP: gastric pit; CC: chief cell; SC: stratum corneum; SG: stratum granulosum; SS: stratums pinosum; SB: stratum basale.
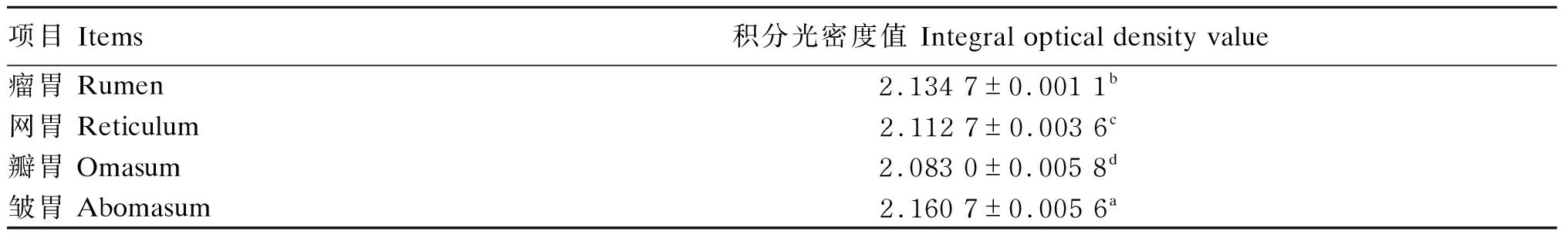
图1 牦牛胃的组织学与免疫组化检测
同列数据肩标不同字母表示差异极显著(P<0.01)。下表同。
In the same column, values with different letter superscripts mean significant difference (P<0.01). The same as below.
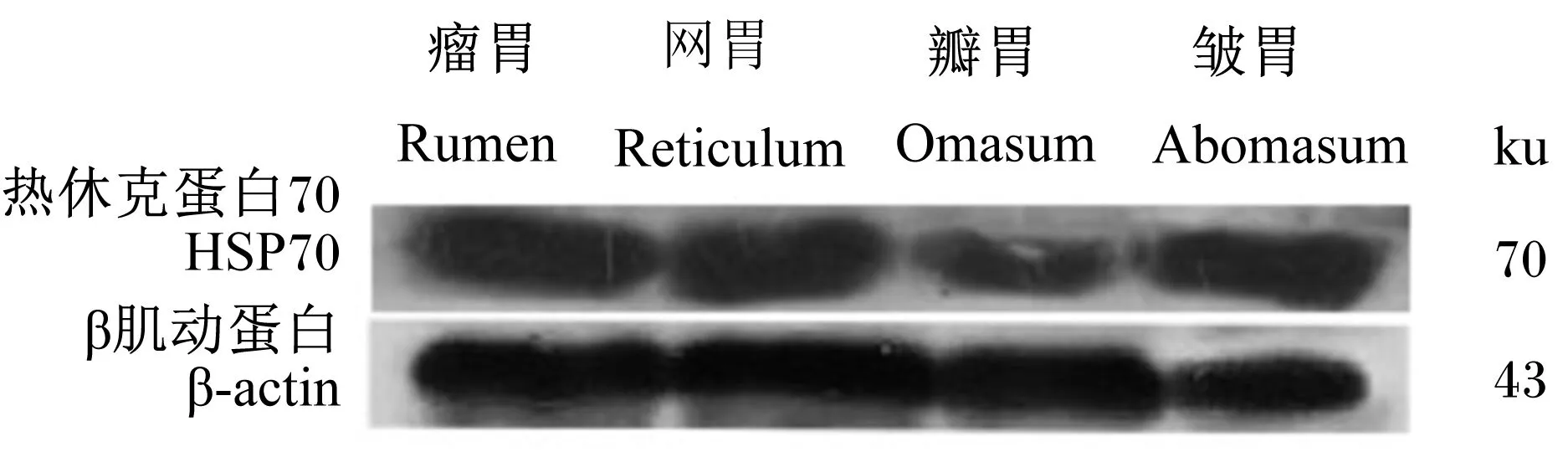
图2 HSP70在牦牛胃的表达

项目 ItemsHSP70 表达量 Expression of HSP70瘤胃 Rumen3.440 1±0.022 1b网胃 Reticulum3.170 6±0.119 4c瓣胃 Omasum2.710 5±0.035 1d皱胃 Abomasum3.796 7±0.151 1a
牦牛采食较为粗糙的饲草,对前胃黏膜上皮有较强的刺激损伤作用,而胃肠黏膜上皮作为机体内增殖分化及凋亡最快的组织,细胞的损伤修复较快[12-13]。研究发现,在同一组织中,不同细胞发生增殖分化及凋亡的周期过程并不同步[14]。Alwajeeh等[4]和Omar等[5]研究表明,HSP70抑制鼠胃组织细胞的凋亡,对胃具有重要的保护作用。研究发现,正常生理条件下HSP70在人、小鼠、大鼠胃黏膜的表达量较低,当机体受到损伤刺激后,表达量呈显著升高[15-18]。本试验采用免疫组化法及WB法研究发现,在牦牛前胃,HSP70在角质层呈强阳性反应,推测可能与抑制胃黏膜细胞过度凋亡、加速细胞修复和保护胃黏膜有关;HSP70在基底层、颗粒层和棘细胞层的部分细胞中等阳性反应,部分细胞不表达。这种现象可能与细胞发生增殖分化及凋亡周期的过程不同步有关。更值得关注的是,本试验还发现,在牦牛前胃,HSP70表达量在瘤胃最高,网胃次之,瓣胃最低。牦牛瘤胃作为反刍动物第1胃,是抵抗食物刺激的第1道防线,黏膜角质化程度最高,损伤最大[19]。由此作者推测,HSP70在牦牛前胃的表达量差异可能与胃黏膜的损伤程度有关。这与Donnelly等[15]、Silva等[16]研究结果相似,即损伤刺激越严重,HSP70表达量越高。
已有研究证实,胃内分泌细胞不仅自身具有分泌功能,还参与调控其他分泌细胞的分泌功能,它分泌的组胺对壁细胞分泌胃酸起着至关重要的调节作用,刺激胃酸的分泌[20-21]。Wada等[22]研究发现,大鼠胃酸可以诱导胃黏膜热休克蛋白72(HSP72)的表达,从而降低胃酸对胃黏膜的损伤。当胃内pH异常,酸碱平衡失调时,是导致胃溃疡的主要诱因,此时,胃可能通过自身机制诱导HSP70表达,用于维持胃内酸碱平衡,增强溃疡的愈合[23-24]。Arora等[25]研究发现,在小鼠胃溃疡损伤时,内源性抗氧化酶升高及脂质过氧化导致HSP70上调,来保护胃黏膜。Marruchella等[6]研究发现,HSP70在猪食道黏膜上皮细胞表达,起到保护食道黏膜不受损伤的作用。本试验经免疫组化法和WB法检测后结果发现,在牦牛皱胃,HSP70不仅黏膜表面上皮细胞有表达,腺体间的内分泌细胞及壁细胞也呈阳性表达。作者推测,这可能与保护皱胃胃黏膜免受损伤、调控胃内分泌细胞及壁细胞的分泌功能有关,起到保护胃黏膜,调节胃内环境的酸碱平衡,促进食物消化吸收的作用;而HSP70表达量在皱胃显著高于前胃,结合免疫组化结果推测,这种高表达可能与HSP70在皱胃广泛的阳性分布有关。值得思考的是,本试验还发现,HSP70在皱胃壁细胞中未见阳性反应,其原因有待进一步探索研究。
4 结 论
① 牦牛皱胃腺体间含有大量分泌细胞。
② HSP70在牦牛前胃角质层细胞呈强阳性反应,基底层、棘层及颗粒层部分细胞呈中等阳性表达,部分细胞不表达。
③ 皱胃阳性反应分布范围较广,不仅黏膜上皮细胞有表达,腺体间内分泌细胞及壁细胞也呈阳性反应。
④ HSP在牦牛4个胃均表达,其中皱胃表达量最高,瘤胃次之,网胃较低,瓣胃最低。
