腺相关病毒与生物素葡聚糖胺顺行标记小鼠皮质脊髓束的比较
2018-07-16孙玉慧
王 坚,孙玉慧
(苏州大学 神经科学研究所, 江苏 苏州 215123)
皮质脊髓束(corticospinal tract,CST)是脊髓中重要的调控运动功能的神经传导束[1]。CST神经轴突起源于体感运动皮质第五、六层的锥体神经元,其轴突终末广泛存在于不同脊髓节段的神经元群体中,支配到脊髓灰质的中间神经元及α运动神经元等[2-4]。生物素葡聚糖胺(biotinylated dextran amine,BDA)是一种双向神经示踪剂,其生物学性状稳定,转运距离远,可长时保存,是研究CST轴突结构和连续性最常用的工具[5]。腺相关病毒(adeno associated virus,AAV)为单链DNA病毒,感染效率高,安全性好,感染神经元后可快速、长期、稳定地表达目的蛋白,广泛应用于神经环路的研究[6-7]。AAV病毒载体若经过改造,同时实现对被感染神经元的基因操作和形态学示踪,对于研究损伤后的轴突再生将是一种非常便捷的工具。AAV与BDA对于小鼠CST轴突的示踪效果是否存在差别,目前尚不清楚。本研究通过比较二者对小鼠CST的标记效果,探讨AAV作为顺行神经示踪剂用于脊髓损伤后的CST轴突再生及相关环路研究的优势。
1 材料与方法
1.1 材料
1.1.1实验动物:SPF级雌性C57BL/6成年小鼠共30只,质量20~22 g[上海斯莱克实验动物公司生产许可证号:SCXK(沪)2013-0018]。饲养于苏州大学实验动物中心,所有实验操作均严格按照苏州大学动物管理委员会要求执行。
1.1.2实验试剂:BDA(10 000 MW,10%)、驴抗羊Alexa Fluor 488-IgG(H+L)抗体(Invitrogen公司);AAV8-CAG-GFP-2A(和元生物技术股份有限公司,滴度1 013 GC/mL);TSA plus cyonine3 system试剂盒(Perkin Elmer公司);羊抗鼠GFP抗体(Abcam公司)。
1.2 方法
1.2.1实验动物分组及处理:将小鼠分为正常组和脊髓损伤组。脊髓损伤方法:4%水合氯醛(0.2 mL/20 g)麻醉小鼠,切除T8节段椎板充分暴露脊髓,显微手术刀完全切断T8脊髓。依次缝合肌肉、筋膜、表皮,并消毒。术后1周每天肌肉注射1×104U 青霉素钠。每天排尿两次。正常组和脊髓损伤组(损伤后4周)分别立体定位注射AAV和BDA。立体定位注射方法:以小鼠大脑Bregma点为原点,在距离中线1.5 mm的左侧大脑皮质(-1.5), AP方向坐标(单位mm):0/-1.5,-0.5/-1.5,-1.0/-1.5打3个孔,微量注射器以深度0.5 mm向各个孔注射0.6 μL AAV或BDA。
1.2.2组织冰冻切片:注射AAV或BDA两周后,水合氯醛麻醉小鼠,4%多聚甲醛灌注并后固定,经20%、30%蔗糖溶液梯度脱水,OCT包埋。颈段及胸段脊髓组织分别进行冠状面和矢状面冰冻切片,切片厚度为30 μm。
1.2.3免疫组织化学染色:AAV注射组小鼠组织切片经1% Triton X-100通透30 min,2% BSA封闭1 h,羊抗鼠GFP抗体(1∶500)4 ℃孵育过夜后,驴抗羊Alexa Fluor 488-IgG(H+L)二抗(1∶1 000)室温孵育1 h,Mounting Medium封片。BDA注射组,组织切片经4% PFA后固定,0.3% H2O2和50%乙醇的混合溶液孵育10 min,0.1 mol/L甘氨酸孵育10 min,含0.5% blocking reagent的封闭液孵育30 min。Strepavidin-HRP (1∶500) 4 ℃孵育过夜,含Tyramide (1∶250) 的放大液室温孵育5 min,Mounting Medium封片。激光共聚焦显微镜(Zeiss公司,LSM 700)采集免疫组化图像。使用ImageJ软件统计CST轴突束(bundle)区域及周围轴突分支(branch)的荧光强度,减去背景荧光强度后,以CST轴突束区域的荧光强度作为参照(100%),计算轴突束及轴突分支的相对荧光强度(%)。
1.3 统计学分析
2 结果
2.1 AAV及BDA对于正常小鼠脊髓颈段的CST示踪效果的比较
在小鼠脊髓颈段,AAV和BDA均能够清晰地标记到向尾端投射的紧密的CST轴突束(图1A,B;图2A,B)以及轴突分支(图1a1,b1,a2,b2;图2a1,b1)。AAV和BDA对于CST轴突束的示踪效果没有显著差异,而AAV标记的轴突分支的相对荧光强度显著高于BDA标记的轴突分支(图1C;图2C)。
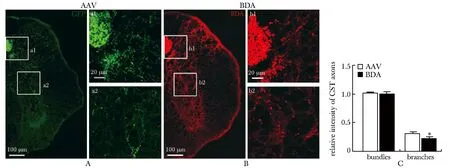
A:CST axons traced by AAV, a1-a2.high magnification of boxed areas in A; B:CST axons traced by BDA, b1-b2.high magnification of boxed areas in B; C:quantification of relative fluorescence intensity of CST axons;*P<0.05 compared with AAV
图1AAV及BDA标记正常小鼠颈段冠状面CST轴突的比较


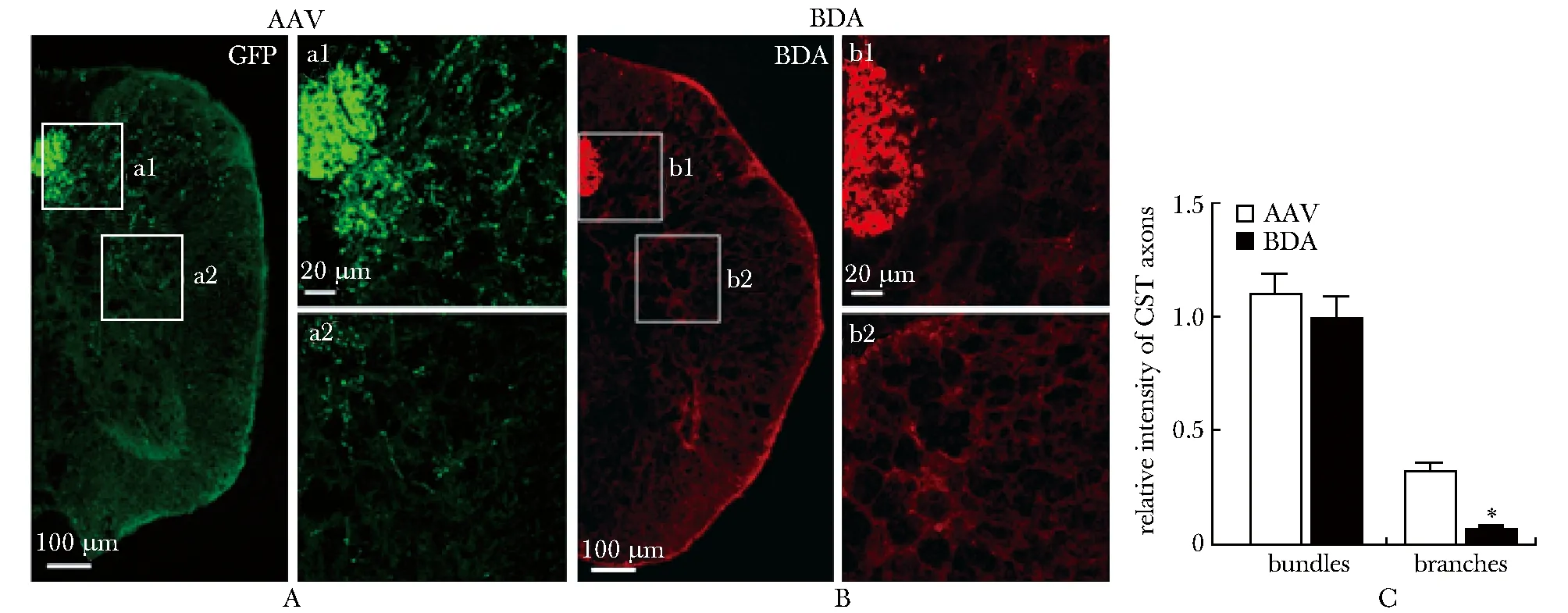
A:CST axons traced by AAV, a1.high magnification of boxed area in A; B:CST axons traced by BDA, b1.high magnification of boxed area in B; C:quantification of relative fluorescence intensity of CST axons;*P<0.05 compared with AAV
图2AAV及BDA标记正常小鼠颈段矢状面CST轴突的比较

2.2 AAV及BDA对于正常小鼠脊髓胸段的CST示踪效果的比较
同样地,在脊髓胸段AAV和BDA均能够清晰地标记到紧密的CST轴突束向尾端投射(图3A,B;图4A,B)以及相应的轴突分支(图3a1,a2,b1,b2;图4a1,b1)。AAV和BDA对CST轴突束的示踪效果相似,而AAV标记到的轴突分支的相对荧光强度显著高于BDA标记的轴突分支(图3C;图4C),这一现象在冠状面切片中更为明显(图3C)。
2.3 AAV及BDA对于脊髓损伤小鼠脊髓胸段的CST示踪效果的比较
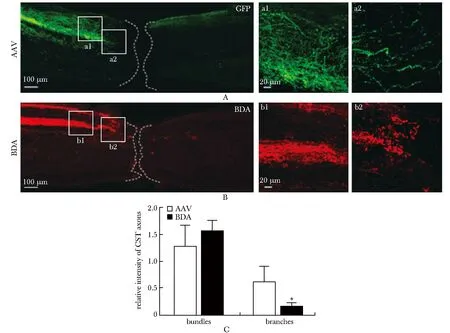
在脊髓损伤小鼠中, AAV及BDA同样都能够标记到脊髓胸段的CST轴突束和分支(图5A,B),AAV及BDA标记的CST轴突均停止于损伤区域边缘头端,损伤的神经轴突前段均可见清晰的回缩小泡(图5a2,b2)。与BDA相比,AAV不但能够标记到经典的紧密的CST轴突束(图5A),而且标记到了更广泛的轴突分支(图5C)。
A:CST axons traced by AAV, a1-a2.high magnification of boxed areas in A; B:CST axons traced by BDA, b1-b2.high magnification of boxed areas in B; C:quantification of relative fluorescence intensity of CST axons;*P<0.001 compared with AAV


A:CST axons traced by AAV, a1.high magnification of boxed area in A; B:CST axons traced by BDA, b1.high magnification of boxed area in B; C:quantification of relative fluorescence intensity of CST axons;*P<0.05 compared with AAV

A:CST axons traced by AAV, a1-a2.high magnification of boxed areas in A; B:CST axons traced by BDA, b1-b2.high magnification of boxed areas in B; C:quantification of relative fluorescence intensity of CST axons;*P<0.05 compared with AAV
图5AAV及BDA标记脊髓损伤小鼠胸段矢状面CST轴突的比较

3 讨论
多年来,BDA广泛应用于CST轴突的顺行示踪和脊髓损伤后CST轴突再生的研究。BDA可被神经元及其突起摄取,主要以扩散的方式在轴浆中运输抗生物素蛋白(亲和素avidin或链霉亲和素streptavidin),与BDA中的生物素反应可进行显色[8-9]。BDA与多种荧光示踪剂和各种免疫组织化学技术相结合,可满足光学显微镜及电镜下观察的要求。同时,BDA注射到动物体内后仍面临被自体代谢掉的问题,在体内存留时间不能过长。
绿色荧光蛋白(green fluorescence protein, GFP)及其突变体的发现促使腺相关病毒在神经环路的研究中发挥重要的作用[10]。本研究采用的AAV8-CAG-GFP-2A病毒可高效感染小鼠体感运动皮质的锥体神经元,并长期稳定表达GFP蛋白,相较于BDA可在生物体内存留更长时间,能满足对实验动物长期监测的需求。通过分子生物学方法改造AAV病毒载体,可在神经示踪的同时,在特定类型神经元中特异性导入或干扰目的基因表达[11];结合Cre-LoxP系统可实现在特定神经元中的基因敲除[12];向神经元中引入ChR2 (channelrhodopsin2)、 NpHR(halorhodopsin)等光敏感蛋白,可通过光遗传学调控神经元活动[13-14];采用新型跨突触AAV病毒可追踪CST下游的神经元或神经核团[15]。BDA作为单纯的神经示踪剂不具备这些优势。
本研究比较AAV和BDA的示踪效果,发现二者在正常小鼠及脊髓损伤小鼠脊髓中对CST轴突束的示踪效果一致,而AAV相较于BDA能够标记到更多向灰质中投射的CST轴突分支。AAV表达的GFP蛋白在神经轴突中的转运能力强于BDA在轴突中的扩散能力,可能是导致AAV标记的CST轴突分支更加清晰和广泛的原因。未来进一步对AAV8-CAG-GFP-2A病毒载体进行改造,可实现基因表达/功能调控和神经示踪的双重功能。因此,AAV作为替代BDA的一种新型神经示踪剂,对小鼠CST的形态学及局部神经环路的研究具有更大的优势。
