白藜芦醇诱导前列腺癌细胞凋亡的实验研究
2018-07-16李金贵
李金贵,刘 川,万 华 ,吴 克,翟 超,黄 飚
(1.成都天府新区人民医院 泌尿外科,四川 成都 610213;2.重庆医科大学附属第二医院 泌尿外科,重庆 400010)
前列腺癌是男性泌尿系统最常见的恶性肿瘤之一,近年发病率上升并呈年轻化的趋势[1]。目前,临床上治疗前列腺癌多采用外科手术联合全身放疗法,但存在价格昂贵、风险性高、易耐受、毒副作用大等劣势,且研究发现,放疗法对于前列腺癌患者5年生存率并没有显著影响[2]。因而,从毒小价优的天然产物中寻找一种能有效抑制前列腺癌疾病进展的活性成分具有重要的现实意义。白藜芦醇是一种生物活性很强的天然多酚类物质,存在于桑树、花生、藜芦、朝鲜槐等多种植物中,具有抗氧化、抗微生物和抗炎等功效[3]。研究表明,白藜芦醇对体外培养的多种人类肿瘤细胞均存在一定的抑制作用,如肝癌、胃癌、乳腺癌、结肠癌等[4-5]。本研究以前列腺癌PC-3细胞为研究对象,探讨白藜芦醇对其凋亡的影响,并探讨其潜在机制,为揭示白藜芦醇的抗肿瘤活性及临床应用提供理论依据。
1 材料与方法
1.1药品白藜芦醇购于中国药品生物制品检定所,加入二甲基亚砜溶解至浓度为1 mol/L作为母液,经0.22 μm的微孔滤膜过滤后,避光保存于4 ℃冰箱中,于使用前用细胞培养基稀释至各工作浓度。
1.2细胞株前列腺癌PC-3细胞购于武汉普诺赛生命科技有限公司,所用培养基为含10%胎牛血清的RPMI 1640培养基,细胞于37 ℃、5% CO2及饱和湿度下培养,每隔2~3 d胰酶消化并传代,定时更换培养液。
1.3试剂与主要仪器RPMI 1640培养基、胎牛血清、胰酶均购自美国Gibco公司;MTT粉末、Hoechst 33258染液购自上海碧云天生物技术研究所;兔抗大鼠Bax、Bcl-2、Caspase-3、Caspase-9一抗购自美国CST公司;RIPA裂解液、Trizol提取液、BCA试剂盒、PVDF膜均购自美国Thermo公司;辣根过氧化物酶标记的山羊抗兔二抗购自武汉博士德公司;SYBR MasterMix、反转录试剂盒购自日本Takara公司;超微量核酸蛋白测定仪购自英国BioDrop公司;高内涵成像分析系统购自美国PerkinElmer公司;电泳槽、电泳仪、凝胶成像分析仪购自美国Bio-Rad公司;CO2培养箱、MK3型酶标仪、实时荧光定量PCR仪均购自美国Thermo公司。
1.4MTT法检测细胞增殖抑制率取对数生长期的PC-3细胞,胰酶消化后,调整细胞浓度至5×107个/L,每孔100 μL分别接种于两块96孔板中。待细胞完全贴壁后,弃去培养液。分别配制终浓度为0(对照组)、15、30、60、90 μmol/L的白藜芦醇溶液,每孔加入100 μL,同时设置空白组,除不加细胞悬液外其余同药物组,每组设置6个复孔。于培养箱中分别培养24、48 h后,每孔加入5 mg/mL的MTT液10 μL,避光孵育4 h后,每孔加入DMSO液150 μL,室温下振荡10 min,然后于酶标仪450 nm波长处测定各孔的吸光度值(A值),并计算细胞增殖抑制率:抑制率/%=(A药物组-A空白组)/(A对照组-A空白组)×100%。
1.5Hoechst 33258荧光染色检测细胞凋亡情况前列腺癌PC-3细胞经胰酶消化后,调整细胞浓度为5×107个/L接种至96孔板内,细胞培养24 h后,分别加入0、15、30、60、90 μmol/L的白藜芦醇溶液100 μL,每组设置6个复孔,于培养箱中继续培养24 h。取出96孔板,弃去培养液,加入PBS液洗涤3次,然后每孔加入Hoechst 33258染液100 μL,于37 ℃避光孵育30 min;孵育完成后,弃去孔内染液,PBS洗2次后,采用高内涵筛选系统检测各组细胞的凋亡情况。
1.6Western-blotting法检测细胞凋亡相关蛋白表达取对数生长期的PC-3细胞,胰酶消化后,调整细胞浓度至5×108个/L,以每孔1.5 mL接种至6孔板中,细胞培养24 h后,分别加入0、15、30、60、90 μmol/L的白藜芦醇溶液100 μL干预24 h。药物干预完成后弃去培养液,PBS洗2次,加入1 mL RIPA液裂解细胞,收集于EP管中,在4 ℃、12 000 r/min条件下离心15 min,取上清液制备细胞蛋白提取液,BCA试剂盒法测定细胞总蛋白含量。制备分离胶和浓缩胶,蛋白上样,SDS-PAGE凝胶电泳至溴酚蓝跑出分离胶后,将蛋白转移至PVDF膜上,5%脱脂奶粉室温下封闭1 h,根据目的蛋白分子量裁剪条带,分别加入稀释后的一抗(Bax,1:500;Bcl-2,1∶1 000;Caspase-3,1∶1 000;Caspase-9,1∶1 000),4 ℃孵育过夜。次日用TBST液洗涤条带4次,每次10 min,加入二抗室温下孵育4 h,TBST液洗4次,每次10 min,之后进行ECL显影。应用Image J软件分析条带灰度值,根据目的蛋白和内参蛋白对应灰度值的比值计算蛋白相对表达水平。
1.7RT-PCR检测细胞凋亡相关基因mRNA表达细胞处理及药物干预方法同1.6。干预完成后弃去培养液,PBS洗2次,加入一定量Trizol试剂提取组织总RNA,检测含量合格后按反转录试剂盒操作要求将RNA逆转录成cDNA,PCR反应扩增Bax、Bcl-2、Caspase-3、Caspase-9基因产物,以β-actin基因为内参。引物由深圳华大基因公司合成,序列(见表1)。
表1基因引物序列

基因基因序列(5’-3’)扩增长度(bp)Bax上游GTTTCATCCAGGATCGAGC138下游GATCATCCTCTGCAGCTCCBcl-2上游TGTGTGGAGAGCGTCAACAG237下游TCCACAAAGGCGTCCCAGCCaspase-3上游AGAGCTGGACTGCGGTATTGAG179下游GAACCATGACCCGTCCCTTGCaspase-9上游GCAAGACAACTCGAGCCTG134下游CATTCTTCTCTCTGTGCTTGATCGβ-actin上游CATCCTGCGTCTGGACCTGG159下游TAATGTCACGCACGATTTCC

2 结果
2.1白藜芦醇对前列腺癌PC-3细胞增殖抑制率的影响与对照组相比,不同浓度的白藜芦醇干预前列腺癌PC-3细胞24 h、48 h后,细胞增殖水平均受到不同程度的抑制,且剂量从15 μmol/L起即有统计学差异(P<0.05或P<0.01)。同时,白藜芦醇对该细胞的增殖抑制率呈明显的剂量依赖性,但同浓度下药物干预48 h与干预24 h比较,并没有统计学差异(P>0.05,见表2)。
2.2白藜芦醇对前列腺癌细胞凋亡形态的影响Hoechst 33258荧光染色结果发现,对照组前列腺癌系PC-3细胞发出均匀的蓝色荧光,细胞形态正常,分布均匀,荧光呈暗色,说明无明显的凋亡特征;在白藜芦醇干预细胞24 h后,随着药物干预浓度的增加,同一视野下细胞数目明显减少,细胞透亮,部分细胞核碎裂,核固缩,呈现典型的凋亡形态学特征(见图1)。


白藜芦醇浓度(μmol/L)干预24 h(%)干预48 h(%)0(对照组)001511.7±1.5∗17.2±2.2∗3022.4±3.1∗∗27.5±3.8∗∗6043.7±5.2∗∗42.4±6.8∗∗9048.6±7.1∗∗48.9±7.0∗∗
与对照组比较,*P<0.05,**P<0.01。

A:对照组;B:15 μmol/L组;C:30 μmol/L组;D:60 μmol/L组;E:90 μmol/L组。图1 不同浓度白藜芦醇对前列腺癌细胞凋亡形态的影响(×100)
2.3白藜芦醇对前列腺癌细胞凋亡相关蛋白表达的影响与对照组比较,白藜芦醇干预24 h后,前列腺癌系PC-3细胞促凋亡蛋白Bax、Caspase-3、Caspase-9表达均显著上升(P<0.05或P<0.01),而抗凋亡蛋白Bcl-2表达显著下降(P<0.05或P<0.01),Bax/Bcl-2比例显著上升(P<0.05或P<0.01),均呈现出明显的剂量依赖性(见图2,表3)。

图2 各组前列腺癌PC-3细胞凋亡相关蛋白表达结果

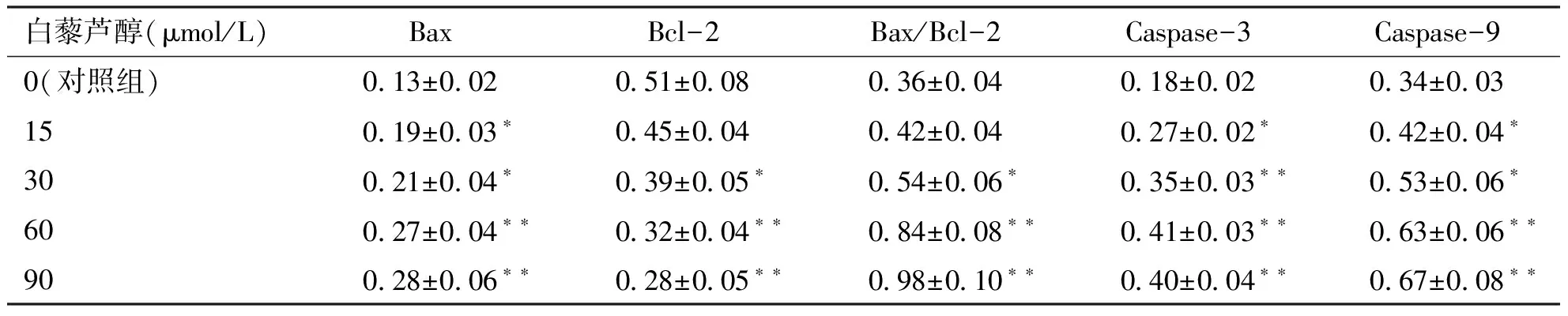
白藜芦醇(μmol/L)BaxBcl-2Bax/Bcl-2Caspase-3Caspase-90(对照组)0.13±0.020.51±0.080.36±0.040.18±0.020.34±0.03150.19±0.03∗0.45±0.040.42±0.040.27±0.02∗0.42±0.04∗300.21±0.04∗0.39±0.05∗0.54±0.06∗0.35±0.03∗∗0.53±0.06∗600.27±0.04∗∗0.32±0.04∗∗0.84±0.08∗∗0.41±0.03∗∗0.63±0.06∗∗900.28±0.06∗∗0.28±0.05∗∗0.98±0.10∗∗0.40±0.04∗∗0.67±0.08∗∗
与对照组比较,*P<0.05,**P<0.01。
2.4白藜芦醇对前列腺癌PC-3细胞凋亡相关基因mRNA表达的影响与对照组比较,白藜芦醇(30、60、90 μmol/L)干预24 h后,细胞促凋亡因子Bax表达上升而抗凋亡因子Bcl-2表达下降(P<0.05或P<0.01),Bax/Bcl-2间的平衡被完全打破(P<0.01);而白藜芦醇浓度从15 μmol/L起,凋亡执行因子Caspase-3、Caspase-9表达即较对照组显著上升(P<0.05或P<0.01),展现其良好的促前列腺癌细胞凋亡的效果(见表4)。
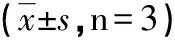

白藜芦醇(μmol/L)BaxBcl-2Bax/Bcl-2Caspase-3Caspase-90(对照组)1.00±0.011.00±0.001.00±0.001.01±0.011.00±0.01151.24±0.210.86±0.091.44±0.151.47±0.20∗1.55±0.14∗301.87±0.27∗0.72±0.09∗2.60±0.25∗∗2.02±0.22∗∗1.98±0.23∗60 2.24±0.34∗∗0.54±0.07∗∗4.13±0.47∗∗2.51±0.33∗∗2.27±0.37∗∗90 2.32±0.36∗∗0.53±0.06∗∗4.32±0.44∗∗2.58±0.04∗∗2.41±0.35∗∗
与对照组比较,*P<0.05,**P<0.01。
3 讨论
前列腺癌是人类特有的疾病,具有发病率高、死亡率大的特点,其发病率排名全球癌症第5位,男性死亡率则仅次于肺癌[6]。白藜芦醇属于多酚类化合物,具有抗肿瘤、抑制血小板聚集、调节免疫、抗炎、保护心血管等生物学作用[7]。临床研究表明,白藜芦醇联合化疗药物在治疗肝癌、肺癌、乳腺癌等多种晚期恶性肿瘤患者时疗效显著,具有很好的临床应用前景[8]。本研究旨在探讨白藜芦醇对前列腺癌PC-3细胞凋亡的影响,为其在前列腺癌的临床治疗提供实验依据。
细胞凋亡是细胞为维持稳定的内部环境,由基因控制的自主有序的死亡,在细胞衰老、肿瘤的发生中起重要作用[9]。目前,诱导肿瘤细胞凋亡是抗肿瘤研究的热点,也是评价抗肿瘤药物有效性的重要参考指标。本研究显示,白藜芦醇能显著抑制前列腺癌系PC-3细胞增殖,并能导致细胞的核碎裂、固缩、聚集,诱导细胞凋亡,且呈浓度依赖性,说明白藜芦醇有良好的抑制前列腺癌细胞生长的作用。
Bcl-2家族是目前公认与凋亡密切相关的基因,主要包括抗凋亡因子Bcl-2和促凋亡因子Bax等。Bcl-2主要是通过抗氧化或抑制氧自由基产生来阻止细胞凋亡,Bax则是能通过线粒体途径而诱导细胞凋亡,Bax/Bcl-2间的平衡能决定细胞凋亡是否发生[10]。Bax、Bcl-2蛋白能在线粒体完整性的基础上通过激活Caspase家族来调节细胞凋亡的发生[11]。Caspase家族相关蛋白的激活是诱发凋亡的直接效应物,Caspase-3和Caspase-9则是Caspase家族中最关键的成员[12]。其中,Caspase-9起始于Caspase,主要参与细胞凋亡的启动,而Caspase3则是细胞凋亡过程中最关键的执行者之一[13]。本研究检测了白藜芦醇对前列腺癌PC-3细胞Bax、Bcl-2、Caspase-3、Caspase-9蛋白和mRNA表达的影响,结果发现,白藜芦醇能显著上调促凋亡因子Bax而下调抗凋亡因子Bcl-2蛋白和mRNA的表达,打破Bax/Bcl-2间的平衡;同时,上调凋亡执行因子Caspase-3、Caspase-9蛋白和mRNA的表达,从而诱导前列腺癌细胞的凋亡。
综上,本研究结果显示,白藜芦醇能诱导前列腺癌细胞凋亡,其作用机制可能与破坏Bax/Bcl-2平衡,上调Caspase-3、Caspase-9表达有关。本研究阐明了白藜芦醇诱导前列腺癌细胞凋亡的部分机制,为其治疗该疾病的临床应用提供了实验依据,但其更多潜在的抗肿瘤活性及作用机制仍有待进一步研究。
