酶解对白果浊汁稳定性及色泽的影响
2018-07-14范柳萍徐学碗
倪 洋 范柳萍 徐学碗
(1. 江南大学食品学院,江苏 无锡 214122;2. 江苏港城中药养生有限公司,江苏 泰州 225321 )
白果浊汁饮料属于一种淀粉质植物蛋白饮料,由于淀粉糊化后易老化,饮料在生产过程中和货架存放期内易出现析水分层、胶凝结块和沉淀的现象。目前,工业上常用的方法是利用淀粉酶和糖化酶对原料里的淀粉进行酶解处理[1]24。利用淀粉酶酶解植物原料中的淀粉制备植物蛋白饮料已经有很多研究,比如史银银[2]利用中温α-淀粉酶、中性蛋白酶和糖化酶酶解白果淀粉制备白果饮料;杨婧曦[3]使用α-淀粉酶、果胶酶、β-淀粉酶和糖化酶酶解白果中淀粉研制白果饮料;Zhang等[4]利用响应面优化α-淀粉酶和蛋白酶的酶解条件制备白果浊汁;贾可华[5]18-19应用淀粉酶酶解大麦淀粉制备乳浊液;姜绍通[6]28以板栗为原料采用淀粉酶酶解板栗淀粉制备板栗饮料,潘丽军等[7]用中温α-淀粉酶、葡萄糖糖化酶酶解原料紫薯,与苹果汁进行复配制得紫薯复合饮料等等。这些研究很多只是把淀粉酶酶解淀粉作为一种手段,通过优化酶解条件以充分酶解淀粉,然后过滤或者离心得到酶解液,研究对象主要集中在复配稳定剂对于植物蛋白饮料稳定性方面,但是忽略了由于淀粉酶解导致体系物理性质改变,并且过滤和离心工序会损失很多营养物质。同时淀粉被充分酶解后,饮料中的还原糖含量比较高,由于植物蛋白饮料属于中性饮料,灭菌条件为121 ℃,20 min。含有丰富还原糖和蛋白质的体系在高温和长期贮存的条件下容易发生美拉德反应[8]。在高强度的灭菌条件下,淀粉高度酶解的饮料其颜色变化会很大,影响感官。淀粉被酶解后饮料体系中像黏度、Zeta电位等物理性质也会发生很大改变,这些物理性质与饮料体系的稳定性有很大的关联性。
目前,白果浊汁饮料稳定性的研究主要集中在复配稳定剂方面,很少单独研究淀粉的酶解程度对饮料体系稳定性的影响。本试验通过酶解工序制备淀粉不同酶解程度的白果浊汁,分析不同酶解程度白果浊汁的稳定性,并结合酶解后黏度、电位和粒径等物理性质的变化阐明白果浊汁中淀粉酶解与体系稳定性的关系,以期为白果饮料的工业生产提供酶解条件和理论依据。
1 材料与方法
1.1 材料与试剂
白果:大佛指,购于江苏泰州;
中温α-淀粉酶:酶活2 000 U/mL,无锡杰能科酶试剂有限公司;
糖化酶:酶活1 200 U/g,东京化成工业株式会社。
1.2 仪器与设备
均质机:AH-2010型,安拓思纳米技术(苏州)有限公司;
紫外分光光度计:UV-2600型,日本岛津公司;
流变仪:DHR-3型,美国沃特世公司;
激光粒度分析仪:S3500型,美国Microtrac公司;
多角度粒度与高灵敏度Zeta电位分析仪:Nano Brook Omni型,美国布鲁克海文仪器公司;
高精度分光测色仪:UltraScan Pro1166型,美国Hunterlab公司。
1.3 方法
1.3.1 白果浊汁制备工艺 根据Zhang等[4]的浊汁制备工艺修改为:
原料白果→挑选→清洗→去壳、去内种皮→预煮糊化→胶体磨→过200目筛→酶解→均质→杀菌→白果浊汁
预煮糊化:白果放入0.2% Na2CO3的沸水中加热20 min,将白果中的淀粉充分糊化,同时热处理还可以去除氰化物以及部分银杏酚酸。
胶体磨:按照料液比1∶10 (g/mL)的比例,用胶体磨研磨5 min。
酶解:中温α-淀粉酶和糖化酶共同作用。
均质:均质压力为40 MPa,均质2次。
灭菌:灭菌条件为121 ℃,20 min。
1.3.2 酶解的正交优化 在前期单因素试验的基础上,选择中温α-淀粉酶添加量、糖化酶添加量和酶解温度作为试验因素,固定料液比1∶10 (g/mL)、酶解时间60 min,以DE值作为指标,进行三因素三水平的正交优化。正交试验因素水平见表1。
1.3.3 不同酶解程度白果浊汁的制备 取5份相同体积的白果浆液,在优化后的酶解条件下,分别进行10,30,60,90,120 min的酶解,酶解结束后立即灭酶灭菌,得到淀粉不同酶解程度的白果浊汁。
1.3.4 还原糖含量的测定 采用3,5-二硝基水杨酸比色法[6]12。

表1 正交试验因素水平表Table 1 Factor levels of orthogonal experiment
1.3.5 总固形物含量的测定 吸取5 mL样品,在105 ℃下烘干至恒重[5]20,称重,计算总固形物含量。
1.3.6 DE值的计算 DE值为葡萄糖当量,是还原糖占糖浆干物质的比重[9],按式(1)计算DE值。
(1)
式中:
c——DE值,%;
m1——还原糖含量,mg/mL;
m2——总固形物含量,mg/mL。
1.3.7 悬浮稳定性的测定 根据Sims等[10]的方法修改如下:取10 mL 饮料,于3 000 r/min离心10 min,取上清液用去离子水稀释100倍,以去离子水作为参照,于660 nm处测定离心前后的吸光值。按式(2)计算悬浮稳定性。
(2)
式中:
c——悬浮稳定性,%;
A1——浊汁离心后的吸光度;
A2——浊汁离心前的吸光度。
1.3.8 流变性质的测定 利用流变仪进行测定。取适量白果浊汁样品加入流变仪平板上,间距设为0.100 mm,剪切速率为0~100 s-1,用40 mm的2°锥板模具于(25.0±0.1) ℃下测量白果浊汁流变性质[11]。
1.3.9 粒径的测定 用激光粒度分析仪进行测定。在室温下吸取一定量的白果浊汁至去离子水中测定白果浊汁的粒径,记录平均粒径D50、体积平均粒径D[4,3]和面积平均粒径D[3,2][1]36[12]。
1.3.10 Zeta电位的测定 根据赵光远等[13]的方法修改如下:将样品用去离子水稀释100倍,震荡混匀后放入电极中利用Zeta电位仪测量电位。
1.3.11 贮藏试验 将灭菌后的白果浊汁放置于4 ℃冰箱中,让淀粉加速老化,2 d后观察浊汁稳定性。
1.3.12 色差的测定 以未酶解的白果浊汁作为对照,利用高精度激光测色仪测量不同酶解时间白果浊汁灭菌前后的L、a、b值,按式(3)计算△E。L值表示亮度,a值代表红绿偏向,b值代表有色物质的黄蓝偏导率;△E为色差,计算公式见式(3)。△E数值越高则表明试验原料的颜色变化越大[10,14]。
(3)
式中:
△E——色差;
△L——L样-L标;
△a——a样-a标;
△b——b样-b标。
1.4 数据处理
采用SPSS 17.0统计分析软件对数据进行统计分析,利用Origin 9.0进行绘图。
2 结果分析
2.1 酶解工艺的优化
白果中含有66%的淀粉(干基)[2]31,淀粉的酶解对浊汁饮料的稳定起着至关重要的作用。淀粉处于糊化状态,有利于淀粉酶的酶解,因此充分糊化白果中的淀粉很有必要,20 min 的蒸煮可以使得淀粉充分糊化。同时由于白果中含有一定的有毒物质(主要为氰化物和银杏酚酸),通过Na2CO3浸泡结合加热处理可以有效去除氰化物和部分银杏酚酸,白果浊汁饮料中的银杏酚酸含量小于2015版《中国药典》限定的10 mg/kg。
由表2可以看出,3个因素对酶解效率影响的顺序为:酶解温度>α-淀粉酶添加量>糖化酶添加量,其中酶解温度为65 ℃的试验组比60,70 ℃的效率高,α-淀粉酶添加量越多酶解效率越高。表3表明,α-淀粉酶添加量和酶解温度对酶解效率有显著影响,而糖化酶添加量对酶解效率没有显著影响。所以综合极差及方差分析结果最优方案为:A3B3C2,即α-淀粉酶添加35 U/g·果肉,糖化酶添加60 U/g·果肉,酶解温度为65 ℃。在此条件下,酶解的效率最高,经过验证实验DE值为(55.63±0.56)%。
2.2 酶解时间对白果浊汁稳定性的影响
不同酶解程度白果浊汁的稳定性情况见表4和图1。
由表4可知,随着酶解时间的延长,DE值和可溶性固形物持续增长,而悬浮稳定性是先增加后稳定再下降。由于淀粉酶和糖化酶对浊汁中的淀粉持续酶解,大分子的淀粉被酶解成还原糖和糊精,使得DE值以及可溶性固形物的含量增加,酶解120 min后DE值可以达到70%以上。悬浮稳定性值越大代表饮料越稳定[2]28,因此从悬浮稳定性数据可知,浊汁稳定性在酶解前30 min不断升高,随后在30~60 min时较稳定,60 min后开始下降,图1也可以看见相似的现象,说明一定时间内酶解淀粉有助于提高浊汁的稳定性,但是酶解时间过长反而会降低浊汁的稳定性。
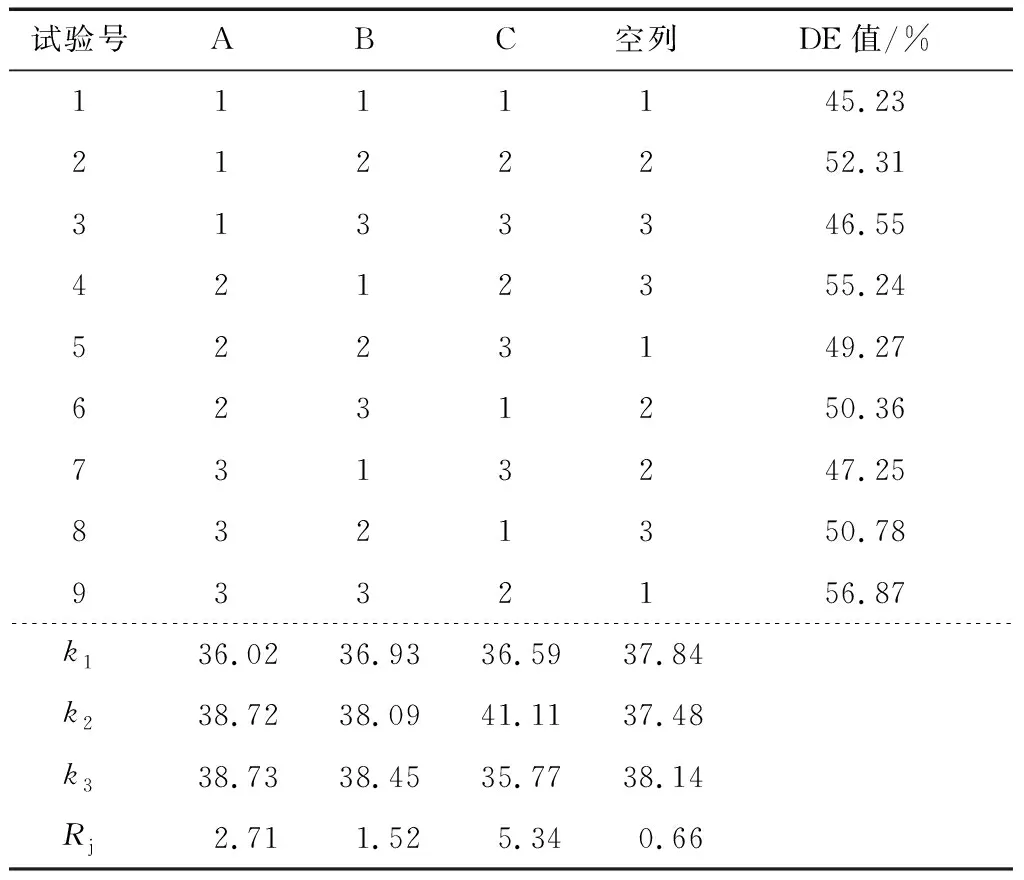
表2 正交试验设计和结果Table 2 The orthogonal experiment design and results
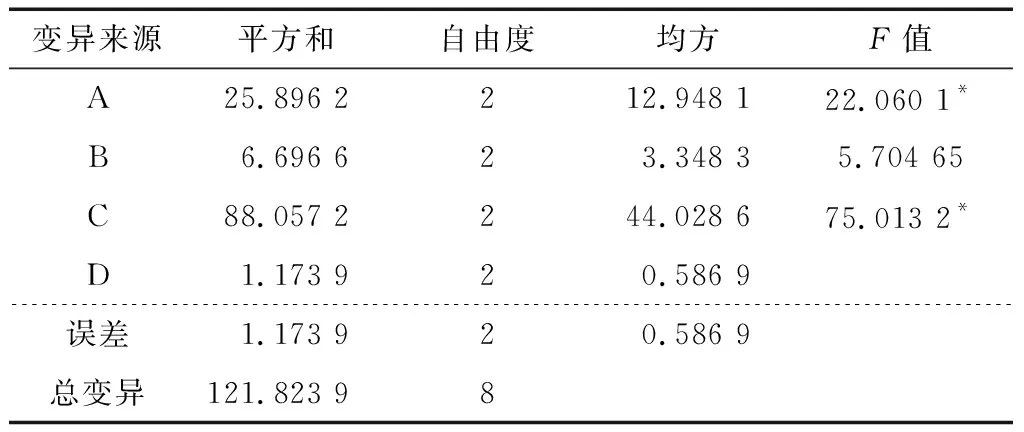
表3 方差分析结果†Table 3 Results of variance analysis
† *表示F检验有显著差异;**表示F检验有极显著差异,F0.05(2,2)=19.0;F0.01(2,2)=99.0。
表4不同酶解时间下白果浊汁DE值、可溶性固形物
和悬浮稳定性†
Table 4 DE value, soluble solid and suspension stability of ginkgo cloudy juice under different enzymatic hydrolysis time(n=3)

酶解时间/minDE值/%可溶性固形物/Brix悬浮稳定性/%1020.21±1.16a5.52±0.12a22.18±1.20c3040.59±0.68b6.10±0.09b25.36±0.62d6055.47±1.37c6.45±0.15c24.52±0.94d9065.82±0.83d6.62±0.11cd21.51±1.32b12073.34±1.26e6.80±0.10d18.38±0.53a
† 同列不同字母表示显著差异(P<0.05)。
将白果浊汁放置在4 ℃环境下,使得体系加速不稳定。由于是浊汁饮料,含有丰富的淀粉、蛋白和纤维等大颗粒物质。它们有些不溶于水,是以悬浮的状态存在于浊汁体系中,悬浮在饮料中的物质越多,说明浊汁的体系越稳定。从图1可以看出,不同酶解时间(即不同酶解程度)的白果浊汁具有不一样高度的上清液和悬浮物。随着酶解的进行悬浮物高度先升高,然后不变,60 min后悬浮物高度下降。尤其酶解120 min的白果浊汁,悬浮物大部分已经沉入瓶底,浊汁此时很不稳定。说明酶解30~60 min(DE值为40%~55%)的白果浊汁有较好的稳定性。

图1 于4 ℃放置2 d后不同酶解时间白果浊汁 的悬浮物高度Figure 1 The height of suspended particles of ginkgo juice after 2 days in the 4 ℃ stored
2.3 酶解时间对白果浊汁黏度的影响
由图2可知,随着剪切速率的增加,不同酶解时间下白果浊汁的表观黏度均逐渐减小,白果浊汁表现出剪切变稀的假塑性流体特征[15]。酶解10 min的浊汁对比未酶解的浊汁,其黏度迅速下降,当酶解时间进一步增加,白果浊汁的黏度缓慢下降,最后趋于不变。可能是白果浊汁中淀粉等链状大分子物质在水溶液中相互缠绕、连接,形成三维网状结构,增加了分子间的作用力,会使得浊汁的黏度比较大[1]33-34。当淀粉酶和糖化酶加入浊汁后,体系中大分子链状的淀粉可能迅速被切断,三维网状结构难以维持,浊汁的黏度也迅速下降,当酶解继续进行,淀粉含量降低,浊汁黏度也会进一步降低,最后随着淀粉的完全酶解,浊汁黏度变的很小。

图2 不同酶解时间下白果浊汁的黏度Figure 2 The viscosity of ginkgo cloudy juice under different hydrolysis time
浊汁经过酶解后其流变性质发生很大改变,表观黏度的变化是最宏观的体现[16]。由于黏度的降低会使得一些不溶大颗粒物质在重力作用下沉入瓶底,如图1中酶解120 min 的白果浊汁其大部分的悬浮物质都已经沉入瓶底。
2.4 酶解时间对白果浊汁Zeta电位的影响
由图3可知,白果浊汁Zeta电位的绝对值随着酶解时间的延长先迅速升高然后又缓慢降低。当Zeta电位的绝对值>30 mV,说明体系比较稳定,颗粒间的静电排斥力比较大,颗粒不容易吸附[17]。酶解30,60 min 时白果浊汁Zeta电位的绝对值都大于30 mV,说明此时白果浊汁中微粒间有较大的排斥力,不容易相互吸附。当酶解时间超过60 min,浊汁体系Zeta电位的绝对值又缓慢下降。原因可能是在酶解刚开始的时候,浊汁体系中的链状淀粉高分子被切断,被淀粉分子包裹的果胶、蛋白等一些带电物质暴露在体系中,使得Zeta电位迅速下降[18]。随着酶解的进一步进行,大量的淀粉被酶解,体系黏度进一步降低,使得其他颗粒之间更容易接触吸附,从而导致Zeta电位又缓慢上升。

图3 不同酶解时间下白果浊汁的Zeta电位Figure 3 Zeta potential of ginkgo cloudy juice under different hydrolysis time
不同酶解时间的白果浊汁表现出不同的Zeta电位,酶解时间长的白果浊汁Zeta电位的绝对值相对较小,同时体系黏度很低,使得白果浊汁中一些蛋白、果胶等带电的颗粒更容易吸附在一起,从而进一步引起浊汁体系的不稳定。因此,并非酶解时间越长越好。
2.5 酶解时间对白果浊汁粒径的影响
D[4,3]可以反映白果浊汁体系中大颗粒的变化,D[3,2]可以反映白果浊汁中小颗粒的变化,D50表示的是中位粒径[1]36。由图4可知,随着酶解时间的延长,D[4,3]的增长趋势比D[3,2]大的多,同时D50的变化趋势和D[4,3]的相似,说明白果浊汁粒径变化的主要原因来源于大颗粒物质的增加。可能由于酶解后体系的黏度很快降低,同时当酶解30 min以后,Zeta电位绝对值随着酶解的增加而降低,使得体系中蛋白和果胶等大分子物质更容易吸附在一起,导致体系粒径的增大。
结合表4可知,浊汁体系中的可溶性固形物随着酶解时间的延长不断增加,说明淀粉被酶解成糊精和一些小分子糖类溶入浊汁中。由试验结果可知,浊汁体系的粒径随着酶解的进行反而增加,这并不利于浊汁饮料的稳定性,但另一方面如果白果浊汁中淀粉不进行酶解,经过加热糊化后,淀粉会很快老化,浊汁口感粗糙,放置一段时间就会整体出现分层现象,因此淀粉的酶解是有必要的。但随着淀粉被酶解,浊汁体系中的黏度、粒径、Zeta电位都会变化,它们之间会相互影响,相互作用,并且由图1可知并不是酶解时间越长饮料就越稳定。

图4 不同酶解时间下白果浊汁的粒径Figure 4 Particle size of ginkgo cloudy juice under different hydrolysis time
2.6 酶解及灭菌对白果浊汁色泽的影响
由图5可知,灭菌前浊汁的△E值随着酶解时间的延长逐渐增大,说明酶解时间对浊汁色泽有一定的影响。相同酶解时间下浊汁灭菌前后的△E值变化很大,说明灭菌工艺显著影响浊汁的色泽。△E值是指总色差的大小,当△E值在3以下认为色差在可接受范围,与对照样品的颜色相差比较小;当△E值大于3,视觉上可以分辨出颜色的差别[14]。酶解60 min以上的白果浊汁灭菌后的△E值都显著大于3,说明此时白果浊汁的色泽变化可以被肉眼所观察,呈现一种暗黄色。含有丰富的淀粉、还原糖以及蛋白质的体系在高温和长期贮储时容易发生美拉德反应[8]。白果浊汁经过淀粉酶酶解后产生大量的还原糖,在121 ℃的灭菌高温下与蛋白质、氨基酸等物质很容易发生美拉德反应,使得颜色变暗,酶解时间越长还原糖的含量越多,浊汁的颜色变化越深。因此,浊汁中淀粉的酶解程度对浊汁色泽也有很大的影响。
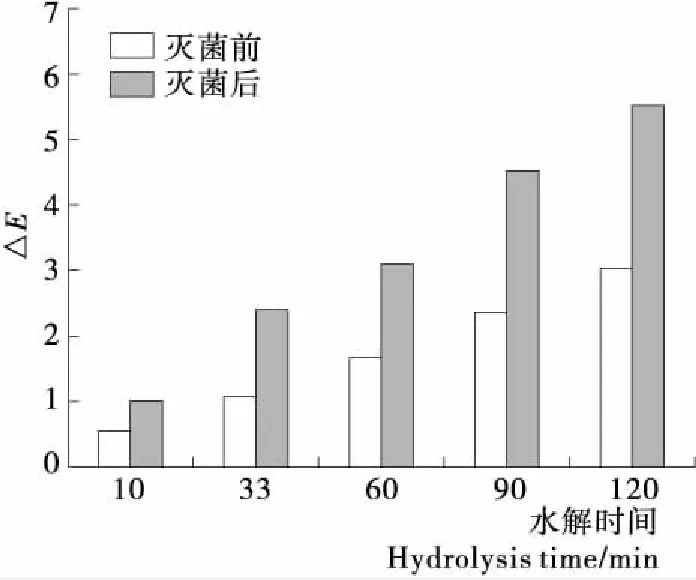
图5 不同酶解时间白果浊汁灭菌前后的色差变化Figure 5 The change of color of ginkgo cloudy juice under different hydrolysis time
3 结论
白果浊汁经过酶解处理以后,整个体系的黏度、电位、粒径等物理性质均会发生显著变化,这些变化会直接影响白果浊汁的稳定性。研究表明当酶解DE值为40%~55%时,白果浊汁具有较好的稳定性。同时,酶解时间过长会影响浊汁色差。本研究为白果浑浊型饮料的加工生产提供了一定的理论依据。
虽然酶解工艺可以影响白果浊汁的稳定性,但是仅仅依靠酶解并不能长期稳定白果浊汁饮料。因此为保证白果浊汁饮料的长期稳定,还需要进一步研究酶解和稳定剂、均质等工艺的结合,寻找出更高效、更经济、更稳定的工艺方法。
