DC-CIK细胞诱导宫颈癌细胞凋亡的研究
2018-07-13韦玮陈心秋
韦玮,陈心秋
(1.广西省柳州市工人医院 妇产科,广西 柳州 545005;2.广西医科大学附属肿瘤医院妇瘤科,广西 南宁 530021)
宫颈癌在女性生殖器官类癌症中占首位,宫颈癌的治愈率低,死亡率高,发病率呈年轻化[1-3]。树突状细胞(dendritic cells,DC)-细胞因子激活的杀伤细胞(cytokine induced killer,CIK)混合生物免疫疗法作为肿瘤生物治疗中最成熟、应用最广的治疗方法,能激活患者自身的免疫系统辨别和杀伤肿瘤细胞,可改善患者的生活质量,延长生存期[4-6]。本文从分子机制探讨DC-CIK细胞对宫颈癌细胞(Hela)杀伤及凋亡的影响。
1 材料与方法
1.1 主要试剂
肝素钠(美国Sigma公司),标准胎牛血清(美国 Gibco公司),1640培养液(美国Gibco公司),二甲基亚砜(dimethyl sulphoxide,DMSO)(美国Sigma公司),CCK-8、RNA 提 取试剂盒及RNA逆转录试剂盒(美国Invitrogen公司),Annexin V/PI凋亡检测试剂盒,粒细胞巨噬细胞刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)、干扰素-γ(Interferonγ,IFN-γ)、白介素-2(Interleukin-2,IL-2)、白介素-1α(Interleukin-1α,IL-1α)、白介素-4(Interleukin-4,IL-4)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)及CD3单克隆抗体(北京同立海源公司),CD8-PE、CD40-FITC、CD3-PITC、CD8-PerCP及CD56-PE抗体(美国Abcam公司),甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、Bcl-2、Bax及 c-myc引物(上海生工生物工程股份有限公司)。
1.2 方法
1.2.1Hela细胞的培养Hela细胞购于中国科学院上海细胞库,于10%胎牛血清和1%抗生素的1640培养基,37℃、5%二氧化碳CO2、95%相对湿度培养箱中培养。
1.2.2CIK细胞的培养选取2015年9月于广西省柳州市工人医院妇科、肿瘤科未做任何治疗的宫颈癌患者58例。每位患者取静脉血80 ml,加肝素钠200μl。取50 ml淋巴细胞分离液,分装10支离心管,每管加8 ml血液,3 000 r/min离心20 min。离心后吸每管上层血清至50 ml离心管,吸取中间层细胞至另一个50 ml离心管中,补加生理盐水至50 ml,计数并离心(5 000 r/min离心5 min)。取5×107个细胞用于DC细胞的培养,剩余细胞用于CIK细胞的培养,计作第0天,加入IFN-γ(1 000 u/ml)、腺嘌呤核苷三磷酸和20%自体血清。第1天补加IL-2(300 u/ml)、IL-1α(100 u/ml)及CD3单克隆抗体(50 ng/ml),之后根据细胞的数量补加培养基进行扩增。第7天与DC细胞共培养。
1.2.3DC细胞的培养DC细胞的铺板密度为5×107个/ml,铺6孔板,2 ml/孔,计作第0天,加入 GM-CSF(1 000 u/ml)和 IL-4(500 u/ml),第 3 天补加DC培养液2 ml,第5天加入抗原,第6天加入TNF-α(500 u/ml)。
1.2.4DC-CIK细胞的培养第8天用巴氏管收集铺板密度1×107个/ml的DC细胞与1×109数量级的CIK细胞混合共培养,据细胞的数量补加培养基进行扩增,培养的DC-CIK于第10天做微生物检测,培养第14天用于实验。
1.2.5DC细胞表型检测收集5×106个/ml的DC细胞,悬于5 ml磷酸盐缓冲溶液(phosphate buffer saline,PBS),1 000 r/min离心10 min,洗去血清,以PBS调浓度至1×106个/ml,1.5 EP管分装,分别加入20μl CD8-PE、CD40-FITC,均为鼠抗人单抗,以相应同型抗体为对照,4℃标记30 min,3 ml PBS 1 000 r/min离心10 min,冲洗2次,最后以PBS重悬调浓度至1×106个/ml,用流式细胞仪(FACSria,美国BD公司)检测。
1.2.6CIK细胞表型检测收集铺板密度5×106个/ml的CIK细胞,悬于5 ml PBS,1 000 r/min离心10 min,洗去血清,以PBS调浓度至1×106个/ml,1.5 EP管分装,分别加入20μl CD3-PITC、CD8-PerCP及CD56-PE一抗,4℃孵育30 min后,PBS洗涤细胞,1 000 r/min离心10 min,冲洗2次,用PBS重悬细胞调浓度至1×106个/ml,用流式细胞仪检测。
1.2.7CCK-8选取生长状态良好的对数生长期Hela细胞,胰酶消化细胞后,接种于96孔板,接种细胞浓度为5×104个/(100μl·孔),将96孔板放入37℃、5%CO2饱和湿度的细胞培养箱中,细胞贴壁培养过夜。分别将100μl 1640完全培养基、培养至第5天的 DC 细胞 [l×105个 /(100μl·孔)]、第 7天的CIK细胞[l×105个/(100μl·孔)]和联合培养生长 3 d的 CIK-DC 细胞 [l×105个 /(100 ul·孔)]接种于铺有靶细胞的96孔板,即实验分组为Hela组、Hela+DC组、Hela+CIK组及Hela+CIK-DC组。培养箱内继续培养24 h,拿出孔板加入CCK-8试剂20μl/孔,培养箱内孵育2 h,用酶标仪(SpectraMax M4,美国Molecular Devices公司)在450 nm处检测每孔光密度(optical delnsity,OD)值,取3个平行复孔的平均值。
1.2.8逆转录聚合酶链反应(reverse transcriptionpolymerase chain reaction,RT-PCR)按照 RNA 提取试剂盒说明书提取Hela细胞、CIK细胞和DC-CIK共培养24 h Hela细胞的RNA,并检测RNA含量。样品OD260/OD280比值在1.8~2.0,纯度较好。逆转录反应体系 :2×TS Reaction Mix(10μl),TransScript RT/RI Enzyme Mix(1μl),Anchored Oligo(dT)18(1μl),Total RNA(500μg),RNase-free Water to 20μl(美国赛默飞世尔科技公司)。PCR反应条件:94℃预变性5 min,94℃变性30 s,58℃退火30 s,72℃延伸45 s,共30个循环后,72℃再延伸1 min。琼脂糖凝胶电泳检测目的RNA表达。采用凝胶成像系统(SA-1000,美国Alpha Innotech公司)进行拍照并分析。GAPDH上游引物:5-GAAGGTGAAGGTCGGAGTC-3,下游引物:5-GAAGATGGTGATGGGATTTC-3;c-myc上 游引物:5-CAGGACTGTATGTGGAGCGGTTTC-3,下游引 物:5-TGCTGTCGTTGAGCGGGTAG-3;Bax上 游引物:5-GTGCACCAAGGTGCCGGAAC-3,下游引物:5-TCAGCCCATCTTCTTCCAGA-3;Bcl-2上游引物:5-CGACGACTTCTCCCGCCGCTACCGC-3,下游引物:5-CCGCATGCTGGGGCCGTACAGTTCC-3。
1.2.9Annexin V/PI双染取处于对数生长期的Hela细胞,消化重悬细胞后接种于6孔板中,按5×104个/ml的密度培养于2 ml 1640培养液中。待细胞贴壁后加入培养的DC-CIK细胞1×106个培养24 h。倒掉悬浮的DC-CIK细胞,胰蛋白酶适宜时间消化细胞后加入1640培养液(10% PBS)终止消化并离心收集细胞。用PBS洗涤细胞反复离心(2 000 r/min离心5 min)2次,离心后重悬细胞计数,实验需5×105个细胞。每管按顺序依次加入500μl的Binding Buffer,5μl Annexin V-FITC 和 5μl PI涡旋混匀后。室温下避光反应15 min。用流式细胞仪检测。
1.3 统计学方法
数据分析采用SPSS 17.O统计软件。计数资料以例表示,组间比较用χ2检验;计量资料以均数±标准差(±s)表示,用t检验或方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 DC、CIK细胞的形态学观察
外周血中分离出的单个核细胞贴壁2 h,细胞呈圆形并贴壁,加入IL-4和GM-CSF后细胞形态不规则,悬浮细胞增多,细胞表面有毛刺样突起生成,且细胞体积变大后开始悬浮生长,分布均匀,具有典型的树突状突起。显微镜下可见单个核细胞在细胞因子的刺激下,细胞体积开始增加,细胞核逐渐变大,培养至第5天的CIK细胞集落开始聚集生长,后逐渐成簇状克隆生长。见图1。
2.2 DC细胞的CD8、CD40的阳性表达
流式细胞仪检测DC细胞第0和7天时的细胞表面分子CD8和CD40,第0天时CD8的阳性表达率为1.59%,CD40的阳性表达率为2.54%。相对于第0天,第7天时CD8的阳性表达率为21.62%,CD40的阳性表达率为76.67%。第0与7天的CD8与CD40阳性表达率比较,差异有统计学意义(χ2=19.555和11.833,均P=0.000),第7天时CD8和CD40的阳性表达率升高。见图2。
2.3 CIK细胞的CD3、CD8及CD58的阳性表达
流式细胞仪检测CIK细胞第0和14天时的细胞表面分子CD3、CD8及CD56,第0天时CD3的阳性表达率为37.06%,CD8的阳性表达率为26.36%,CD56的阳性表达率为14.29%。第14天时CD3的阳性表达率为86.85%,CD8的阳性表达率为82.69%,CD56的阳性表达率为47.65%。第0与14天的CD3、CD8及CD56阳性表达率比较,差异有统计学意义(χ2=52.113、63.985和 26.028,均P=0.000),第14天时CIK细胞的细胞表面分子CD3、CD8和CD56阳性表达率升高。见图3。
2.4 DC-CIK细胞对Hela细胞存活率的影响
Hela组、Hela+DC组、Hela+CIK组、Hela+DC-CIK组的细胞存活率比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较,经LSD-t检验,Hela+DC组与Hela组细胞存活率比较,差异无统计学意义(P>0.05),说明DC细胞不具有肿瘤细胞杀伤能力;Hela+CIK组与Hela组细胞存活率比较,差异有统计学意义(t=22.504,P=0.002),Hela+CIK组比Hela组下降39.72%;Hela+DC-CIK组与Hela组细胞存活率比较,差异有统计学意义(t=34.045,P=0.001),Hela+DC-CIK组比Hela组下降58.40%。见附表和图4。

图1 显微镜下观察DC、CIK细胞的形态(×100)

图2 流式细胞仪检测DC细胞表面分子CD8和CD40的表达
2.5 DC-CIK细胞对Hela细胞凋亡的影响
Hela组凋亡率为(5.9±3.8)%,与Hela组相比,Hela+DC-CIK组凋亡增加了4.12倍,其凋亡率为(22.0±3.8)%,两组比较,差异有统计学意义(t=7.851,P=0.001)。见附表和图5。
2.6 DC-CIK细胞对Hela细胞Bax/Bcl-2 mRNA比值的影响
Hela组、Hela+DC组、Hela+CIK组、Hela+DCCIK组的Bax/Bcl-2 mRNA比值比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较,经LSD-t检验,Hela+DC-CIK组与Hela组的Bax/Bcl-2 mRNA比值比较,差异有统计学意义(t=8.314,P=0.010)。Hela+DC-CIK 组为 Hela组的(3.49±0.08)倍。见附表和图6。
2.7 DC-CIK细胞对Hela细胞c-myc mRNA表达水平的影响
Hela组、Hela+DC组、Hela+CIK组、Hela+DCCIK组的c-myc mRNA水平比较,经方差分析,差异有统计学意义(P<0.05)。Hela+CIK组、Hela+DCCIK组与Hela组相比c-myc mRNA表达升高,但Hela+DC-CIK组升高更明显。Hela+DC-CIK组与Hela组c-myc mRNA水平比较,差异有统计学意义(t=22.079,P=0.000),Hela+DC-CIK组增加了60.72%。见附表和图7。

图3 CIK细胞表面分子CD3、CD8和CD56的表达

附表 4组细胞各试验指标比较
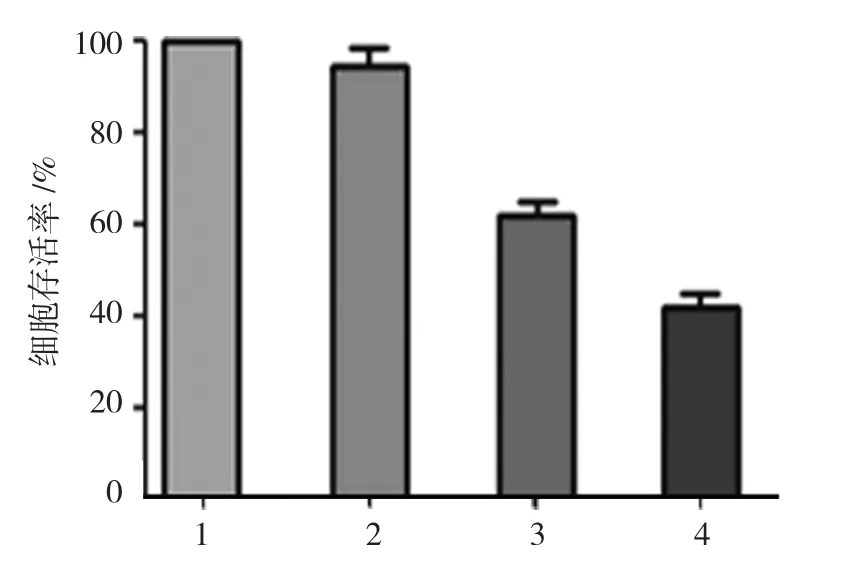
图4 DC-CIK细胞对Hela细胞存活率的影响

图5 DC-CIK细胞对Hela细胞凋亡的影响

图6 DC-CIK细胞对Hela细胞Bax/Bcl-2 mRNA比值的影响

图7 DC-CIK细胞对Hela细胞c-myc mRNA表达水平的影响
3 讨论
DC细胞是机体内具有提呈抗原作用的细胞,成熟的DC细胞表面具有丰富的抗原呈递分子,DC细胞具有激活T淋巴细胞免疫应答和抵制肿瘤细胞免疫逃逸机制的作用。CIK细胞分泌的抗体与肿瘤细胞表面分子结合,具有较强的杀伤肿瘤细胞的能力,同时具有自然杀伤细胞的非主要组织相容性复合体限制性杀瘤优点和T淋巴细胞强大的抗瘤活性,CIK细胞在体外经因子诱导,扩大培养后回输到癌症患者体内,显著提高其免疫活性,也明显增强其抗肿瘤效果。DC细胞和CIK细胞分别通过不同因子的诱导后共培养,获得的DC-CIK细胞兼顾DC细胞的抗原递呈能力和CIK细胞杀瘤能力,发挥高效的抗肿瘤作用。
目前,DC-CIK细胞在其他癌症的治疗中已经取得较满意的效果。DC细胞与CIK细胞共培养后可有效抑制裸鼠肺腺癌移植瘤组织中血管内皮生长因子、基质金属蛋白酶及Bcl-2的表达,从而抑制裸鼠肺腺癌移植瘤的生长[7]。DC-CIK免疫细胞治疗可以提高固体癌的化疗疗效以及降低其副作用。在非小细胞肺癌的治疗中,与单纯化疗相比,DC-CIK联合化疗治疗晚期非小细胞肺癌不仅安全有效还可以提高缓解率,延长生存期,改善患者的生活质量[8]。临床上DC-CIK对恶性黑色素瘤、乳腺癌、胃癌、肠癌及食管癌患者有较好的临床疗效,并能有效增强患者的免疫功能,改善患者的生活质量,提高生存期[9-12]。因此,本研究通过生物学实验探讨DC-CIK细胞对宫颈癌细胞Hela存活率及凋亡的影响,为临床上DC-CIK细胞治疗宫颈癌提供理论依据。
本研究发现,DC-CIK细胞与Hela细胞共培养后,Hela细胞的存活率下降,经Annexin V-FITC/PI双染流式细胞仪检测后DC-CIK共培养的Hela细胞凋亡和坏死细胞百分比增加。研究表明乳腺癌干细胞抗原负载的DC与CIK细胞作用后诱乳腺癌细胞凋亡,其发生机制与Bcl-2蛋白超家族蛋白表达有关[13]。因此本文进一步检测了DC-CIK细胞与Hela细胞共培养后Hela细胞促凋亡蛋白Bax和抗凋亡蛋白Bcl-2的变化,结果表明Bax蛋白的mRNA水平升高,而Bcl-2蛋白的mRNA水平降低。c-myc基因是一种可异位基因,也是一种可调节基因。c-myc基因作为癌基因具有双重作用,不仅参与细胞增殖还参与细胞凋亡,c-myc基因与正调节的生长因子协同促进细胞增殖,而与具有负调控的生长抑制基因如Fas、Fasl及Bas结合后可加速细胞凋亡,在癌症的发生发展中发挥重要的作用[14]。宫颈癌细胞中c-myc基因高表达,因此本文进一步检测DC-CIK细胞与Hela细胞共培养后Hela细胞中c-myc基因的影响,RT-PCR结果表明DC-CIK与Hela细胞共培养后Hela细胞内c-myc mRNA水平增加60.72%。本研究表明DC-CIK可通过提高Hela细胞Bax/Bcl-2的比值和c-myc的表达诱导Hela细胞凋亡,这只是DC-CIK细胞诱导Hela细胞凋亡的1个机制,DC-CIK细胞也可能通过释放其他因子来杀伤Hela细胞,或者通过其他信号通路诱导Hela细胞凋亡,其还有待进一步研究探索。
