雷公藤内酯醇抑制TNF-α表达对小鼠溃疡性结肠炎的影响*
2018-07-13张海峰张彬周国雄陈卫昌
张海峰,张彬,周国雄,陈卫昌
(1.南通大学附属医院,江苏 南通 226001;2.苏州大学附属第一医院,江苏 苏州 215006)
肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)是溃疡性结肠炎(ulcerative colitis,UC)主要促炎因子。研究表明,TNF-α在UC血清、局部组织中的表达明显升高[1-7]。雷公藤内酯醇(Triptolide,TL)是从中药雷公藤中分离的二萜内酯化合物,具有抗炎、免疫调节作用[8-17]。本实验应用TL治疗UC小鼠,观察治疗前后小鼠的病情变化,以及TL与疾病的相关性,进一步明确TL是否对UC有疗效,以及是否与抑制TNF-α的表达有关。
1 材料与方法
1.1 材料
选择4~6周龄SPF级雌性BALB/c小鼠80只,由南通大学动物实验中心提供,在南通大学动物实验中心动物房按常规方式喂养。葡聚糖硫酸钠(dextran sulfate sodium salt,DSS)(美国 MP Biomedicals公司),TL(中国南京泽郎医药科技有限公司),Trizol抽提RNA试剂(美国Invitriogen公司),PCR试剂盒(日本TaKaRa公司),TNF-α多克隆抗体(兔抗小鼠,美国Abcam公司),二抗(北京中杉金桥生物技术有限公司)。本实验已通过南通大学附属医院医学伦理委员会审批。
1.2 方法
1.2.1动物模型的复制按STEVCEVA[18]和张艳丽等[19]的方法复制DSS实验动物模型,除空白对照组外,其他组小鼠饮用5% DSS溶液(5g DSS溶于100 ml蒸馏水)7 d。
1.2.2实验分组将80只雌性BALB/c小鼠随机分为空白对照组、生理盐水组、丙二醇组、地塞米松组、美莎拉嗪组,以及TL 1、2、3组8组,分笼饲养,每笼10只。空白对照组:不予任何处理;生理盐水组:DSS模型复制成功后腹腔注射生理盐水0.2 ml/次,1次/d;丙二醇组:腹腔注射20%丙二醇0.2 ml/次,1次/d;地塞米松组:地塞米松0.1 mg/(kg·d)溶于生理盐水中腹腔注射;美沙拉嗪组:美沙拉嗪20~30 mg/kg溶于水中经胃管注入,3次/d;TL 1组:TL溶于20%丙二醇,腹腔注射药量为0.20 mg/(kg·d);TL 2组:TL溶于20%丙二醇,腹腔注射药量为0.40 mg/(kg·d);TL 3组:TL溶于20%丙二醇,腹腔注射药量为 0.60 mg/(kg·d)。
1.2.3疾病活动指数(disease activity index,DAI)评分各组从第1天开始,每日观察、记录小鼠的一般情况,包括精神、活动、饮食、体重变化,同时观察小鼠的大便性状及便血情况,分析治疗前后结肠病变的变化。参照MURANO等[20]的标准进行DAI评分(见表1)。DAI=(体重下降分数+大便性状分数+便血分数)/3。大便性状分数分为:①正常大便,可成型颗粒样大便;②松散便,不与肛门相黏的糊状粪便或半成形不黏肛便;③稀便,黏于肛门的水样便。大便隐血检测采用传统联苯胺法。
1.2.4大体形态学评分模型复制成功后第8天,采用颈椎脱臼法处死各组小鼠,分离整段结肠组织并纵行剖开结肠,预冷生理盐水冲洗清洁数次,用滤纸滤干,大头针展开平铺,固定结肠组织。用肉眼观察结肠黏膜炎症及溃疡发生情况,参照EKSTROM等[21]的标准进行评分:黏膜无损害计0分,黏膜充血计1分,溃疡面积<25%受损面积计2分,溃疡面积占25%~50%受损面积计3分,溃疡面积>50%受损面积计4分。将病变明显肠段分为3部分:一部分用4%甲醛固定,送病理科,行苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色;一部分于 -80℃条件下保存,留做逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR); 另一部分提取蛋白,留做Western blot检测。

表1 DAI评分标准
1.2.5结肠病理组织学观察及评分取病变组织常规石腊包埋、切片、HE染色,参照BOIRIVANT等[22]的标准行盲法评分,由2位病理科医师分别双盲阅片,结果取均值进行评分。组织学评分标准:正常计0分;极低白细胞浸润、<10%高倍视野(high power field,HPF)计1分;少量白细胞浸润、10%~25% HPF计2分;中量白细胞浸润、25%~50% HPF,同时伴血管密集和肠壁增厚计3分;大量白细胞浸润、>50% HPF、血管高度密集、隐窝变形、扭曲计4分。
1.2.6酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)收集血液,3 000 r/min离心 10 min,将血清与红细胞分离;3 000 r/min离心30 min取上清,3 000 r/min离心10 min去除颗粒和聚合物。操作步骤:在室温下平衡20 min后从铝箔袋中取出所需板条,设置标准品孔和样本孔,标准品孔加入不同浓度的标准品50μl/孔;样本孔先加待测样本10μl,再加样本稀释液40μl;空白孔不加。除空白孔外,标准品孔和样本孔中加入辣根过氧化物酶标记的检测抗体100μl/孔,用封板膜封住反应孔,37℃水浴锅或恒温箱温育60 min。弃液体,吸水纸上拍干,每孔加满洗涤液,静置1 min,甩去洗涤液,吸水纸上拍干,如此重复洗板5次。每孔加入底物A、B各50μl,37℃避光孵育15 min。每孔加入终止液50μl,15 min内在450 nm波长处测定各孔的OD值。结果判断:绘制标准曲线,在Excel工作表中,以标准品浓度作横坐标,对应OD值作纵坐标,绘制出标准品线性回归曲线,按曲线方程计算各样本浓度值。
1.2.7RT-PCR取适量病变组织提取总RNA,逆转录合成cDNA,行PCR扩增。TNF-α正向引物:5’-CCTCAGGAACGGGACTCGAA-3’,反向引物:5’-ATGTACACCAAGTCGGTAGCACCA-3’,扩增片段长度86 bp;内参照β-actin正向引物:5’-GAGACCTTCAACACCCCAGC-3’,反向引物:5’-CCACAGGATTCCATACCCAA-3’,扩增片段长度446 bp。PCR反应条件:95℃预变性2 min,95℃变性15 s,58℃退火25 s,72℃延伸35 s,共循环45次,于每个循环的72℃时采集荧光数值。为检测每个反应的特异性,循环结束后分析熔解曲线,分析条件为95℃、15 s,60℃、60 s,95℃、15 s。为消除样本、逆转录和PCR反应的差异,以目的基因TNF-α 和β-actin mRNA含量的比值作为评价目的基因表达水平的指标。
1.2.8Western blot检测提取总蛋白,用紫外分光光度法测定总蛋白浓度,行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,蛋白上样量20μl/孔。在垂直电泳槽中电泳后转膜至硝酸纤维素膜上,5% TBST封闭4 h,加入稀释的TNF-α一抗(工作浓度1∶2 500)4℃孵育过夜;TBST洗膜10 min/次,共5次,加入稀释的二抗(工作浓度1∶5 000)孵育2 h,用增强化学发光荧光试剂显影。以β-actin(47 kDa)为内参照,用凝胶成像分析系统处理数据,以TNF-α(17 kDa)与内参照的灰度比值作为蛋白的相对表达量。
1.3 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料用均数±标准差(±s)表示,比较采用重复测量设计的方差分析或单因素方差分析,组间两两比较用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 实验动物观察
各组小鼠从开始处理后7 d内每天固定时间评估各组小鼠DAI评分,采用重复测量设计的方差分析,结果:①不同时间的DAI评分有差别(F=37.841,P=0.000);②各组 DAI评分有差别(F=55.512,P=0.000);③各组DAI评分变化趋势有差别(F=29.662,P=0.000)。空白对照组小鼠精神状态、活动、饮食等一般情况良好,大便性状正常,体重逐步增加。生理盐水组、丙二醇组小鼠模型复制成功后第1、2天开始饮食减少、活动能力下降,毛色无光泽、体重减少,同时排便次数逐渐增多,大便性状发生改变(软便、稀糊状、水样便等);第3、4天大便隐血或出现暗红色、鲜红色血便。进一步两两比较经LSD-t检验,生理盐水组、丙二醇组小鼠DAI评分与空白对照组比较,差异有统计学意义(t=22.368和24.526,均P=0.000)。TL 2、3组,以及地塞米松组、美莎拉嗪组在复制模型的同时给予相应治疗后,各组小鼠精神状态好转,活力明显增加,饮食及体重较生理盐水组、丙二醇组下降幅度减少,毛色有改善,便血或大便隐血情况明显好转,部分大便形态逐渐恢复为软便或者固体便;TL 2、3组,以及地塞米松组、美莎拉嗪组小鼠DAI评分与生理盐水组比较,差异有统计学意义(t=9.226、8.880、7.582和8.006,均P=0.000);TL 2、3组,以及地塞米松组、美莎拉嗪组小鼠DAI评分与丙二醇组比较,差异有统计学意义(t=11.228、10.663、10.002和 9.445, 均P=0.000)。结果显示,TL与地塞米松、美莎拉嗪有类似效应,能改善UC小鼠的一般情况。见表2。
表2 各组小鼠不同时间DAI评分比较(n=10,分,±s)

表2 各组小鼠不同时间DAI评分比较(n=10,分,±s)
组别 1 d 2 d 3 d 4 d 5 d 6 d 7 d空白对照组 0.000±0.000 0.000±0.000 0.000±0.000 0.000±0.000 0.000±0.000 0.000±0.000 0.000±0.000生理盐水组 0.292±0.213 0.417±0.154 1.083±0.661 2.167±0.563 3.000±0.642 3.750±0.345 4.002±0.560丙二醇组 0.333±0.000 0.333±0.000 1.000±0.356 2.292±0.602 2.917±0.345 3.708±0.452 4.120±0.602地塞米松组 0.292±0.118 0.292±0.118 0.500±0.436 0.917±0.556 1.617±0.427 2.083±0.345 2.475±0.330美沙拉嗪组 0.292±0.118 0.302±0.120 0.625±0.336 1.017±0.502 1.717±0.489 2.223±0.405 2.575±0.410 TL 1 组 0.250±0.236 0.333±0.178 0.708±0.415 1.542±0.469 2.417±0.345 3.375±0.415 3.875±0.173 TL 2 组 0.250±0.154 0.333±0.178 0.416±0.345 1.325±0.575 1.708±0.603 2.308±0.547 2.917±0.345 TL 3 组 0.333±0.000 0.333±0.000 0.483±0.167 1.417±0.569 1.867±0.793 2.217±0.631 2.767±0.272
2.2 各组小鼠结肠大体形态学评分比较
空白对照组、生理盐水组、丙二醇组、地塞米松组、美沙拉嗪组,以及TL 1、2、3组小鼠结肠大体形态学评分分别为(0.300±0.100)、(3.206±0.306)、(3.022±0.282)、(1.826±0.168)、(1.968±0.204)、(2.632±0.282)、(2.202±0.228)和(2.060±0.202)分,经方差分析,差异有统计学意义(F=30.360,P=0.000)。空白对照组大部分小鼠结肠黏膜无充血、糜烂及溃疡,少部分结肠黏膜见少许散在充血。生理盐水组、丙二醇组小鼠直肠及近肛侧结肠黏膜弥漫性充血、水肿,伴多发性糜烂、浅表溃疡,部分溃疡表面有坏死组织;近口侧结肠充血水肿、散在糜烂,无明显溃疡形成。地塞米松、美莎拉嗪治疗组,以及TL 2、3组小鼠近肛侧结肠黏膜轻、中度充血,水肿,糜烂形成较生理盐水组、丙二醇组明显减少,部分散在浅溃疡;近口端结肠病变不明显。进一步两两比较经LSD-t检验,空白对照组与生理盐水组、丙二醇组小鼠结肠大体形态学评分比较,差异有统计学意义(t=25.532和25.731,均P=0.000);TL 2组与生理盐水组、丙二醇组小鼠结肠大体形态学评分比较,差异有统计学意义(t=7.442和6.396,均P=0.000);TL 3组与生理盐水组、丙二醇组小鼠结肠大体形态学评分比较,差异有统计学意义(t=8.840和7.844,均P=0.000)。TL能减轻UC小鼠结肠炎症。见图1。
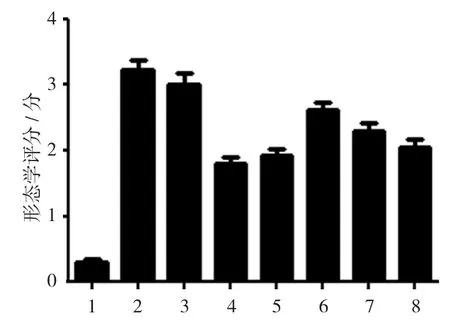
图1 各组小鼠结肠大体形态学评分比较(n=10,±s)
2.3 各组小鼠结肠病理组织评分比较
空白对照组、生理盐水组、丙二醇组、地塞米松组、美沙拉嗪组,以及TL 1、2、3组小鼠结肠病理组织评分分别为(0.750±0.100)、(3.562±0.326)、(3.488±0.302)、(1.666±0.192)、(1.802±0.224)、(2.808±0.282)、(2.020±0.222)和(1.862±0.206)分,经方差分析,差异有统计学意义(F=22.358,P=0.000)。HE染色结果显示,空白对照组小鼠结肠上皮结构、腺体结构完整无破坏,黏膜无糜烂及溃疡形成,部分黏膜下层可见少量中性粒细胞浸润;生理盐水组、丙二醇组小鼠结肠黏膜上皮结构破损,见糜烂及溃疡形成,黏膜及黏膜下层可见大量的淋巴细胞和单核细胞、少量中性粒细胞浸润,固有层腺体变形、排列紊乱,部分破坏;地塞米松组、美沙拉嗪组,以及TL 2、3组小鼠结肠黏膜可见數量不等淋巴细胞和单核细胞浸润,糜烂及溃疡程度较生理盐水组、丙二醇组减轻。进一步两两比较经LSD-t检验,空白对照组与生理盐水组、丙二醇组小鼠结肠病理组织评分比较,差异有统计学意义(t=23.325和24.344,均P=0.000);TL 2组与生理盐水组、丙二醇组小鼠结肠病理组织评分比较,差异有统计学意义(t=11.058和11.078,均P=0.000);TL 3组与生理盐水组、丙二醇组小鼠结肠病理组织评分比较,差异有统计学意义(t=12.469和12.581,均P=0.000)。TL具有减轻UC小鼠结肠局部病变损害的作用。见图2。
2.4 各组小鼠血清TNF-α浓度比较
空白对照组、生理盐水组、丙二醇组、地塞米松组、美沙拉嗪组,以及TL 1、2、3组小鼠血清 TNF-α浓度分别为(173.332±18.288)、(388.302±30.202)、(341.322±31.202)、(195.620±18.208)、(231.408±22.608)、(338.36±18.931)、(243.526±23.462)和(197.066±20.108)pg/ml,经方差分析,差异有统计学意义(F=80.681,P=0.000)。进一步两两比较经LSD-t检验,空白对照组与生理盐水组、丙二醇组小鼠血清TNF-α浓度比较,差异有统计学意义(t=17.221和13.138,均P=0.000),生理盐水组和丙二醇组小鼠血清TNF-α浓度较高;TL 2组与生理盐水组、丙二醇组小鼠血清TNF-α浓度比较,差异有统计学意义(t=10.707和7.086,均P=0.000),TL 2组小鼠血清TNF-α浓度较低;TL 3组与生理盐水组、丙二醇组小鼠血清TNF-α浓度比较,差异有统计学意义(t=14.908和10.992,均P=0.000),TL 3组小鼠血清TNF-α浓度较低;地塞米松组与生理盐水组、丙二醇组小鼠血清TNF-α浓度比较,差异有统计学意义(t=15.454和11.408,均P=0.000),地塞米松组小鼠血清TNF-α浓度较低;美沙拉嗪组与生理盐水组、丙二醇组小鼠血清TNF-α浓度比较,差异有统计学意义(t=11.763和8.068,均P=0.000),美沙拉嗪组小鼠血清TNF-α浓度较低。TL能降低UC小鼠血清TNF-α浓度。
2.5 各组小鼠TNF-α mRNA表达水平比较
空白对照组、生理盐水组、丙二醇组、地塞米松组、美沙拉嗪组,以及TL 1、2、3组小鼠TNF-α mRNA相对表达量分别为(1.000±0.000)、(2.332±0.366)、(2.422±0.342)、(1.228±0.142)、(1.426±0.150)、(2.022±0.320)、(1.602±0.202)和(1.582±0.182),经方差分析,差异有统计学意义(F=19.500,P=0.000)。进一步两两比较经LSD-t检验,空白对照组与生理盐水组、丙二醇组小鼠TNF-α mRNA表达水平比较,差异有统计学意义(t=10.294和11.760,均P=0.000),空白对照组TNF-α mRNA微弱表达,生理盐水组和丙二醇组TNF-α mRNA表达上调;TL 2组与生理盐水组、丙二醇组小鼠TNF-α mRNA表达水平比较,差异有统计学意义(t=4.939和5.839,均P=0.000),TL 2组较低;TL 3组与生理盐水组、丙二醇组小鼠TNF-α mRNA表达水平比较,差异有统计学意义(t=5.190和6.133,均P=0.000),TL 3组较低。TL可抑制UC小鼠局部组织中TNF-α mRNA过表达。见图3。
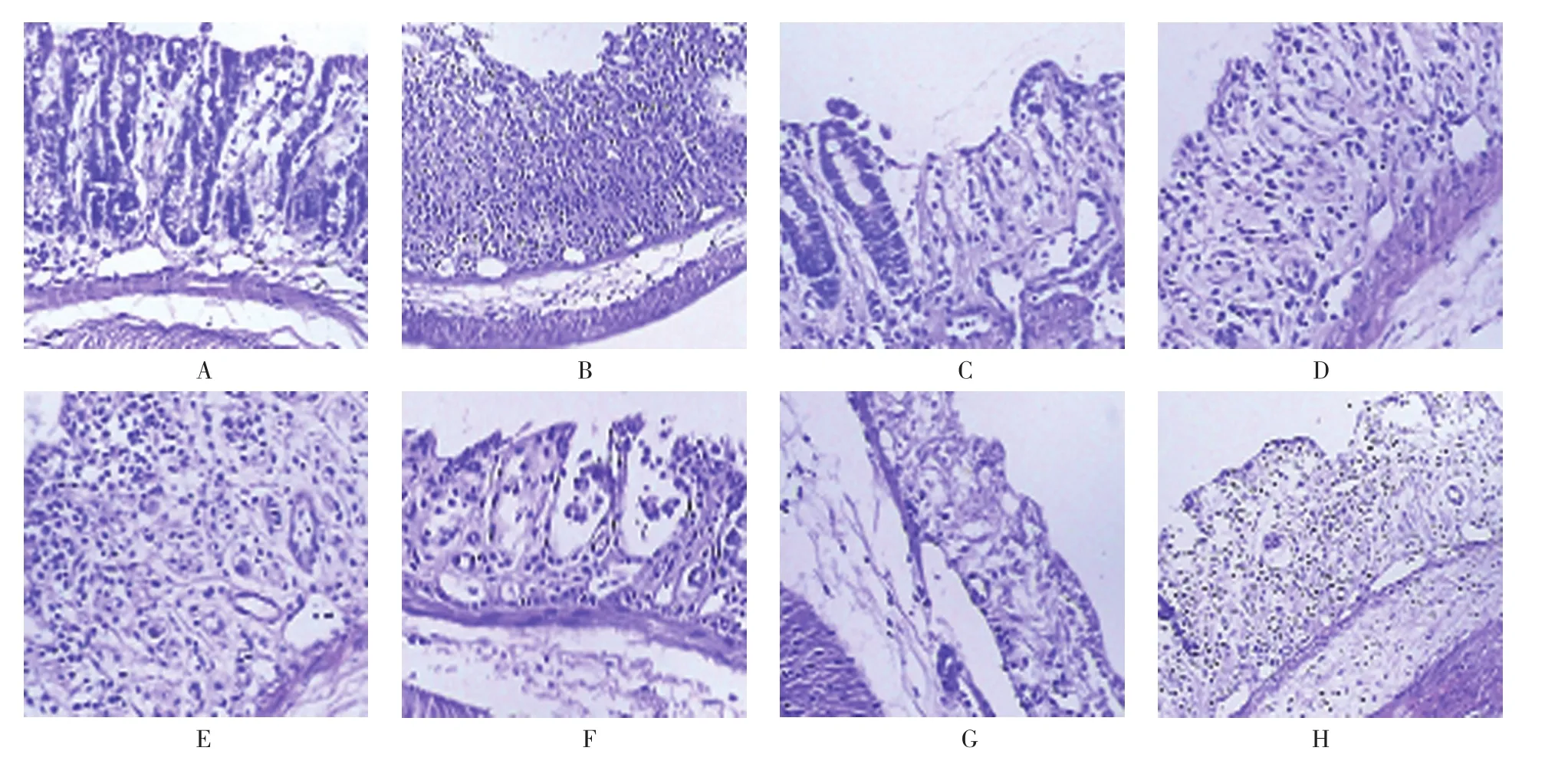
图2 各组小鼠病理组织学图片(HE染色×200)

图3 各组小鼠TNF-α mRNA表达水平比较(n=10,±s)
2.6 各组小鼠TNF-α蛋白表达水平比较
空白对照组、生理盐水组、丙二醇组、地塞米松组、美沙拉嗪组,以及TL 1、2、3组小鼠TNF-α蛋白相对表达量分别为(0.020±0.010)、(0.063±0.020)、(0.058±0.018)、(0.028±0.013)、(0.029±0.013)、(0.046±0.018)、(0.032±0.015) 和(0.030±0.014),经方差分析,差异有统计学意义(F=57.301,P=0.000)。进一步两两比较经LSD-t检验,生理盐水组、丙二醇组与空白对照组小鼠TNF-α蛋白表达水平比较,差异有统计学意义(t=5.439和5.220,均P=0.000),空白对照组小鼠TNF-α蛋白微弱表达,生理盐水组、丙二醇组TNF-α表达上调;地塞米松组、美沙拉嗪组,以及TL 2、3组与生理盐水组小鼠TNF-α蛋白表达水平比较,差异有统计学意义(t=4.150、4.032、3.507 和 3.823,P=0.004、0.002、0.001和0.001),地塞米松组、美沙拉嗪组,以及TL 2、3组TNF-α蛋白表达水平较生理盐水组降低;地塞米松组、美沙拉嗪组,以及TL 2、3组与丙二醇组小鼠TNF-α蛋白表达水平比较,差异有统计学意义(t=3.822、3.694、3.139 和 3.473,P=0.002、0.002、0.007和0.004),地塞米松组、美沙拉嗪组,以及TL 2、3组TNF-α蛋白表达水平较丙二醇组降低。TL可抑制UC小鼠局部组织中TNF-α蛋白的合成。见图4。

图4 各组小鼠TNF-α蛋白的表达
3 讨论
TL具有广泛的免疫调节作用,但由于作用机制的广泛性及机体免疫系统的复杂性,其免疫调节机制并不十分清楚。就目前研究结果可知,其作用机制主要有抑制T细胞增殖或诱导T细胞凋亡、影响NF-κB活性、抑制肿瘤血管生成、抗氧化和抗脂质氧化等[8-17]。
张霞等[16]研究表明,TL可以抑制MOG35-55特异性T细胞增殖,抑制炎症细胞因子IL-17、IFN-γ、TNF-α的表达,并增加IL-4、TGF-β的表达水平,同时抑制Nave T细胞向致病性Th1和Th17细胞的分化。兰雷等[17]研究表明,用TL对三硝基苯磺酸/乙醇性肠炎的大鼠模型进行处理,发现TL可减轻该模型的组织学损伤,下调促炎症细胞因子TNF-α、IL-1及黏附因子ICAM-1的表达水平;同时检测相应的NF-κB活性发现,治疗组较模型组明显受抑,提示TL能抑制NF-κB活化,从而使NF-κB调控的炎症介质产生减少,大鼠结肠组织损伤减轻。周鋆等[23]在复制UC大鼠模型的基础上,以雷公藤红素进行干预,发现高、低剂量雷公藤红素均能改善结肠组织大体和组织学评分,降低NF-κB、p65,以及TNF-α和TNF-αmRNA的表达,表明雷公藤红素对TNBS诱导的大鼠UC具有保护作用。TAO等[24]研究表明,TL可抑制结肠上皮下肌纤维母细胞内IL-8、MCP-1、MMP-3的表达而发挥抗炎效应,其作用机制主要是抑制IL-1β诱导的NF-κB激活。TAO等[25]另一项研究结果表明,TL可以减少TNBS诱导的UC模型小鼠结肠细胞外基质的沉积,以及减少胶原蛋白的产生,从而抑制结肠纤维化病变程度。YU等[26]研究显示,TL可明显改善实验小鼠结肠炎症状,作用机制可能是抑制TLRs/NF-κB信号通路,认为TL可作为Crohn's病的治疗方法之一,值得深入研究。LI等[27]研究表明,TL可以通过下调IL-6/STAT3/SOCS3信号通路抑制IL-17表达;组织学检查结果显示,C3H/HeJBir.IL-10缺失老鼠实验结肠炎症状明显改善。WEI等[28-29]研究表明,给予TL可以明显减轻IL-10缺失小鼠结肠炎的炎症程度和免疫功能紊乱,其机制可能是抑制IL-6/STAT3、TNF-α/TNFR2信号通路,认为TL可能适用于Crohn's病的维持治疗。本实验前期研究结果表明,分别通过TL、地塞米松治疗DSS诱导的UC小鼠,发现TL能减轻小鼠临床症状,并下调次级淋巴组织趋化因子的表达,提示TL可通过抑制SLC的过表达,而达到治疗UC的目的[30]。
本研究结果验证,TNF-α在UC的发生、发展中发挥重要作用,抑制其过表达对UC有治疗作用。同时发现TL 2、3组在给予TL治疗后,各组小鼠体重增加,一般情况好转,DAI评分、大体形态观察及评分、病理组织观察及评分均提示小鼠结肠炎症状缓解,结肠组织局部溃疡、糜烂好转,结果提示TL对UC有治疗作用,其疗效不低于有地塞米松、美沙拉嗪。同时发现给予TL治疗后,血清TNF-α浓度下降,局部结肠组织中TNF-α在mRNA和蛋白水平表达均下调,提示TL有抑制TNF-α过表达的作用。笔者认为TL具有抑抑制炎症的作用,对UC有治疗作用,可通过抑制TNF-α的过表达而发挥疗效,但其具体作用机制仍不明确。进一步明确TL在UC中的作用机制,将对UC的治疗,特别是对激素、美沙拉嗪类药物疗效欠佳的UC患者带来新希望。
综上所述,TL对UC有治疗作用,可能是通过抑制TNF-α的过表达而发挥作用,提示TL可能是一种有效的治疗UC的方法。
