有机胺吸收CO2反应热实验
2018-07-12陆诗建高丽娟李欣泽赵东亚朱全民
陆诗建, 高丽娟, 李欣泽, 赵东亚, 朱全民
(1.中国石油大学(华东)化学工程学院,山东青岛 266580; 2.中国石化节能环保工程科技有限公司,山东东营 257026;3.中国石油大学(华东)储运与建筑工程学院,山东青岛266580)
乙醇胺(MEA)和二乙醇胺(DEA)是工业上应用最广泛的脱除酸性气体(CO2、H2S)的胺液[1]。有机胺吸收CO2反应热与溶剂的吸收能力直接相关,反应热越高,吸收能力越强;反应热越小,吸收能力越弱[2-3]。吸收反应热是气液在吸收反应过程中释放出的热量,解吸反应热则是反应生成物加热分解过程中消耗的热量。解吸过程消耗的总热量包括反应器内气体升温耗热(称为反应器热当量)、溶液升温耗热、解吸反应热(理论上与吸收反应热热值相同)和加热过程中水蒸汽的汽化潜热[4-7]。反应热数据对于脱除CO2的操作单元的设计至关重要,因为它直接决定了溶剂再生过程中所需的蒸汽热量以及反应中CO2的平衡。同时,再生过程蒸汽消耗的热量在装置总能耗所占的比例超过50%,因此要对CO2反应热进行精确的测定。对于乙醇胺(MEA)和二乙醇胺(DEA)的吸收反应热研究比较少,测试也多采用DSC方法,平均测试精度仅有94%[8-12],而乙醇胺、二乙醇胺在低分压CO2吸收和中高压力体系CO2吸收领域均有了较广泛应用,需要更加精准的测定研究;在解吸反应热方面的测试研究尚未开展。笔者研究这两种吸收剂的反应吸收热和解吸热,优化吸收塔和解吸塔的设计。
1 计算模型
1.1 吸收热模型
胺溶液吸收CO2包括两部分:一是物理溶解,二是胺与CO2的化学反应。由于在每一个反应步骤发生时,都很难确定溶解热和反应热会分别占总吸收热的比例,因此这些通常是结合在一起的,称为吸收热[13-15]。
吸收反应的积分热(吸收热)定义为吸收过程中体系的总放热量与 CO2总吸收量的比值,kJ/mol;差分热定义为分段通入CO2释放的热量与分段通入CO2量的比值,kJ/mol[16-19]。
对该CO2反应热测试系统而言,整个吸收反应热的生成热有两个去向,一个是溶液升温,另一个是系统升温,且随着反应的进行,溶液的质量是逐渐增加的,在反应测试系统中,进口阀通入CO2气体,出口阀均关闭,系统为开口系统。
(1)系统总能量(E)的改变量为
dE=dEcv+dem.
(1)
式中,Ecv为系统的总能量(含化学能);e为流动工质的总能量。
(2)开口系统作出的功量,应包括进出口边界上对外作的流动功以及对外作的净功,这样开口系统对外作的功(W)为
dW=dpV+dWnet.
(2)
式中,pV为开口系统进出口边界上对外做的流动功;dWnet为开口系统进出口边界上对外做的净功。
根据能量转换与守恒,有
dQ=dE+dW.
(3)
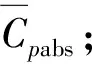
一个反应过程中CO2的吸收量可由分段吸收的CO2累积通入量减去反应平衡时反应器上部空间未被吸收的CO2量来求得,反应达平衡时体系残余CO2量可由气体状态方程得到,即
(4)
式中,V′为达平衡时未反应的CO2体积,L;p为反应达平衡时体系内CO2压力,Pa;V为反应釜内气相体积,m3;R为气体常数,J/(K·mol);T为吸收温度;ρ为CO2在吸收温度下的密度。
则整个吸收反应的放热量Qabs(设反应结束的时刻为te)为
Ts)+HT(Te-Ts).
(5)
式中,HT为吸收温度下的反应热,kJ/mol。
1.2 解吸热模型
CO2解吸过程中,解吸总能耗包括反应液温升显热、系统热当量、溶液汽化潜热以及解吸反应热4部分,计算解吸热可根据加热器加热总功减去其他3部分的热量得到。
(1)系统热当量(QS)为QS=HT(Tt+dt-Tt)。
(2)由于解吸反应存在气提过程,即冷凝的液体是伴随解吸CO2的流出携带出来,同时溶液质量的变化是连续的过程,因此计算模型处理中将冷凝的液体平均到解吸的CO2中,尽可能模拟真实的反应过程。设流出的气液质量为M,流出的CO2质量为MCO2,冷凝液总质量为Mc,CO2解吸总质量为Md,则在dt微元时间段内有
Mm=MCO2(1+Mc/Md).
(6)
设t时刻的质量为Mt,则t+dt时刻的质量为Mt+dt,则系统质量变化为
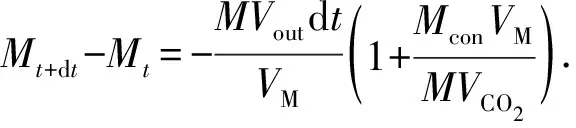
(7)
反应液温升所需显热(Qr)为

(8)
(3)干饱和水蒸气物理性质汽化潜热值h″,系统在dt时间间隔内的能量变化包括溶液温升的能量变化、系统温升的能量变化以及汽化潜热。
溶液汽化潜热为Qg=h″dMcon。因此在系统富液再生过程中,弱联结化合物分解所需的反应热(dQdes)为
(9)
式中,HE为饱和水蒸气物理性质汽化潜热值,kJ。
整个解吸反应的吸热量为Qdes,则
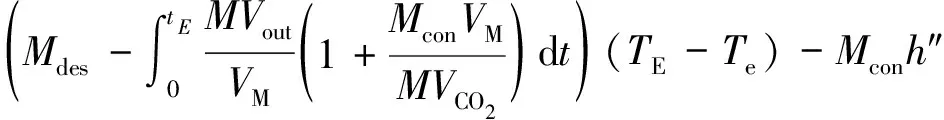
(10)

1.3 解吸率的计算

2 CO2捕集反应热测试装置与流程
DSC方法采用等温测试原理[20-21],将被测样品及参比物置于由几百至几千对热电偶串联组成的环绕型检测器中,环绕型检测器将整个样品池四周及上下部的部分空间“全部包围”起来,通过恒温介质与反应单元的热流交换,保证恒定的吸收温度;样品在实验过程中所产生的总热量有约94%被检测出来。该类测试方法的优点是相对灵敏度非常高,可以测到非常微弱的热量变化,缺点是测量精度不高。
针对DSC量热仪的测试精度缺陷,中石化节能环保工程科技有限公司与中国石油大学(华东)联合开发了高精度反应热测试仪,采用了“气溶胶隔热+抽真空绝热+同步控温”的原理,通过内外温度的控制使反应单元与外界无热流交换,实现气液吸收过程中的绝热环境和无热量散失,利用电加热器的精确控制实现绝热条件下反应热的测量,保证了气液反应过程中的99%总热量可以被测量出来。该反应仪包括反应器、进气CO2预热调压计量、反应器磁力搅拌、排出气液冷却调压计量、加热器调节电源、传感器数据采集与控制以及进料及吹扫部分主体等部分,为绝热反应器。
实验流程主要包括吸收反应、解吸反应、排液吹扫3个操作单元,实验流程如图1所示。

图1 CO2捕集反应热测试装置Fig.1 Flow chart of CO2 capture reaction thermal test device
3 吸收反应热的测量
测量化学溶剂吸收气体反应热,除了直接测量方法之外还可利用实验测得的CO2的分压由Gibbs-Helmholtz公式计算得到反应热[22-23],但这种利用平衡方程计算的方法得到的反应热数据与温度无关[24],而实验证明温度对反应热的影响至关重要。
3.1 不同温度下的反应规律
利用反应热测试装置分别测量了30%DEA和30%MEA溶液在压力100 kPa、温度40、60和80 ℃下的CO2吸收量和反应热。图2为不同温度下MEA与DEA吸收量对比,图3为不同温度下MEA与DEA吸收反应热对比(α为CO2与MEA物质的量之比)。
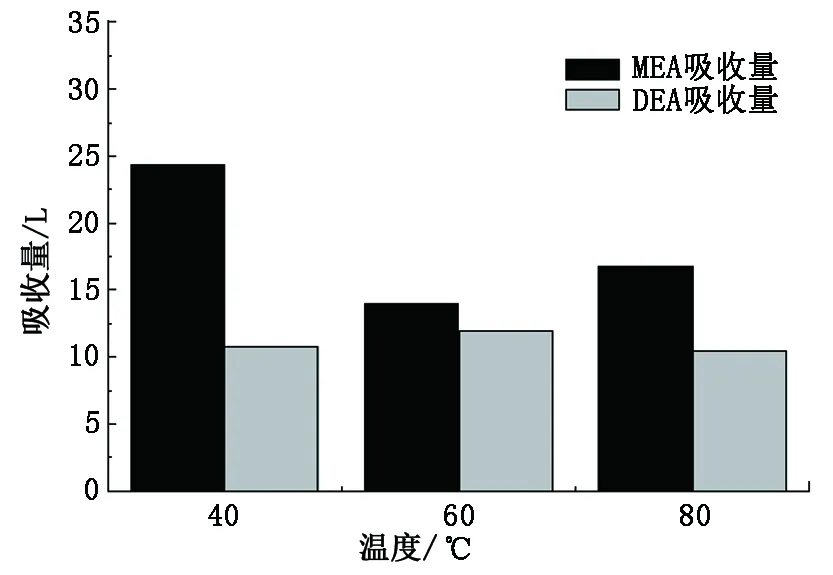
图2 不同温度下MEA与DEA吸收量对比Fig.2 Absorption capacity contrast between MEA and DEA at different temperature
从图2看出:3个温度下DEA溶液的吸收量保持在10~12 L,其之间相差约为1 L,可见DEA溶液吸收能力受温度的变化影响不大;DEA溶液的吸收量均低于MEA溶液。从两性离子角度来看,DEA中含有一个—NH基团,MEA中含有一个—NH2基团,作为生成氨基甲酸盐的重要元素H,DEA的吸收能力明显较弱,但与MEA的差距在低温40 ℃时差别最大约56%,而在高温时差距较小,可以推出当吸收温度较高时,在一定程度上抑制了氨基甲酸盐的形成。
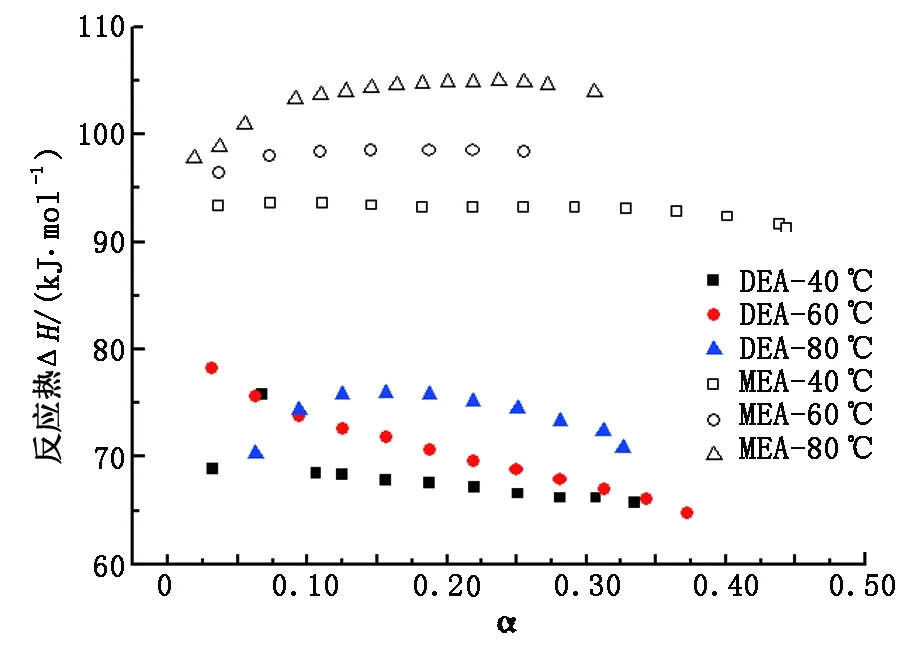
图3 不同温度下MEA与DEA吸收反应热对比Fig.3 Absorption heat contrast between MEA and DEA at different temperature
由图3看出:DEA溶液的吸收热普遍低于MEA溶液的吸收热,在相同温度下进行比较,吸收热低约20 kJ/mol,DEA在节能降耗方面比MEA具有较大的优势;MEA吸收热随负载的增大变化平缓,而DEA溶液随负载的增大呈下降趋势,且40 ℃与60 ℃吸收热相差较小,60 ℃与80 ℃时的吸收热相差较大,因此对于DEA溶液,较高的温度不仅不利于CO2的捕集,同时会增大系统的能耗。
3.2 不同质量分数时的反应规律
设定温度40 ℃,压力100 kPa,对质量分数为15%、20%、30%的MEA溶液捕集二氧化碳反应热进行测量。图4为不同质量分数下MEA与DEA溶液的吸收量对比,图5为不同质量分数下MEA与DEA溶液的吸收反应热对比。
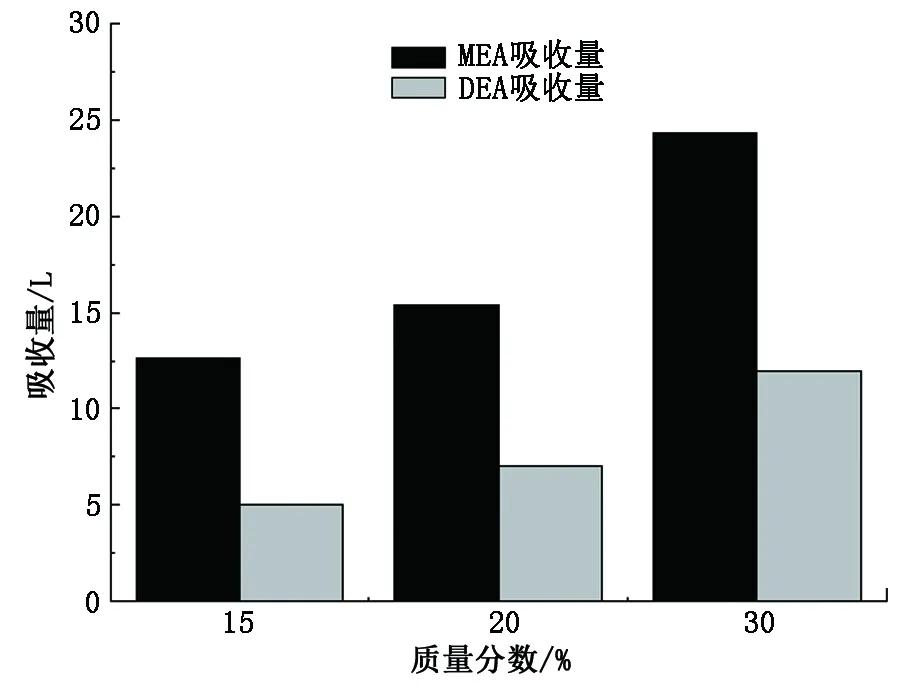
图4 不同质量分数下MEA与DEA各质量分数下吸收量对比Fig.4 Absorption capacity contrast between MEA and DEA at different mass fraction
由图4看出,在随质量分数变化的趋势上DEA与MEA一致,但较不同温度而言,不同质量分数下二元胺DEA的吸收量与一元胺MEA的吸收量相差更为明显,均超过50%。
由图5看出,相同质量分数下DEA吸收热均小于MEA,且15%与20%吸收热相差不大,30%的吸收热比前两者大5~10 kJ/mol,说明高质量分数会增大系统能耗。

图5 不同质量分数下MEA与DEA吸收反应热对比Fig.5 Absorption heat contrast between MEA and DEA at different mass fraction
3.3 不同压力时的反应规律
实验系统选定压力为100、300和500 kPa进行30%DEA溶液的吸收反应。图6为不同压力下MEA与DEA吸收量对比,图7为不同压力下MEA与DEA吸收反应热对比。
由图6看出,DEA溶液吸收量随压力的增大呈明显递增趋势,与MEA不同,DEA在300与500 kPa的吸收量相差约为5 L,这说明压力对于CO2在DEA溶液中的溶解度影响较大,即压力越大,吸收能力越强。
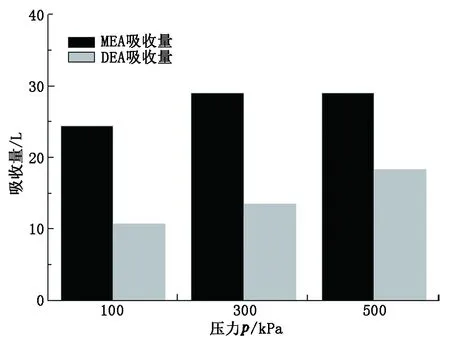
图6 不同压力下MEA与DEA吸收量对比Fig.6 Absorption capacity contrast between MEA and DEA at different pressure
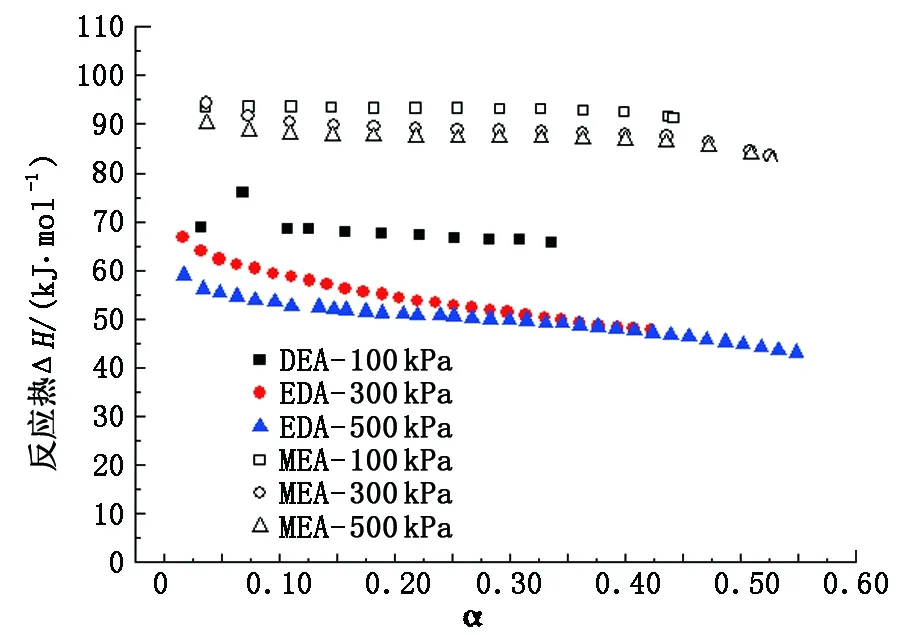
图7 不同压力下MEA与DEA吸收反应热对比Fig.7 Absorption heat contras tbetween MEA and DEA at different pressure
由图7看出,100 kPa压力下DEA的吸收热高于300 kPa和500 kPa的吸收热,与MEA不同的是,DEA受压力影响更明显,其吸收热相差约10 kJ/mol;300 kPa与500 kPa下两者吸收热相差极小,可以推出较高压力下有利于DEA吸收热的减小。
对于DEA溶液,在一定程度上提高运行压力有助于增强溶液吸收能力与降低系统能耗。表1列出了部分学者[11-14]利用C80、CPA122以及其他自行设计的量热器测量MEA吸收热的数据,这里Mathonat与Hugues虽然均采用的C80,但各自采用的流动单元是自行设计的。由表1看出,本课题自主设计的反应热测试仪测试方差最小。
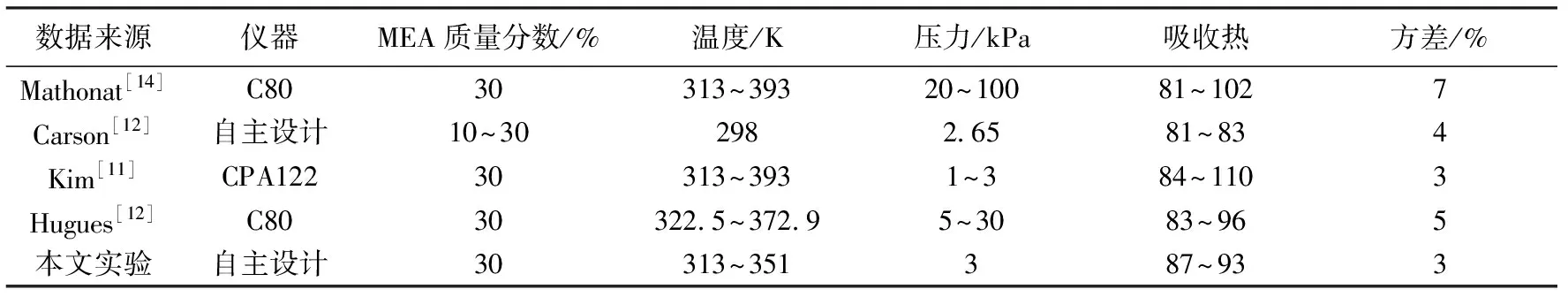
表1 吸收热文献数据统计
图8为Kim等得到的30%MEA在压力为300 kPa、温度分别为40、80和120 ℃吸收热随负载的变化情况,以及本文中实验数据,其中每个点代表负载从零升至指定负载内的反应热。由图8看出:吸收热受温度影响较大,吸收温度越高,反应热越高;吸收热随负载的增大而减小。本实验测出的吸收热曲线较光滑,几乎没有分散的点,表示系统运行稳定,曲线介于40 ℃与120 ℃之间,与80 ℃数据比较接近。根据温度以及CO2质量分数对吸收热的影响,原因有两方面:一是两者的吸收温度不同,本实验初始吸收温度40 ℃,至吸收平衡状态,溶液温度约为78 ℃,因此实际的吸收温度介于40~78 ℃;二是两者的压力不同,Kim采用的是300 kPa,本实验采用的是100 kPa,压力越大,充入的CO2则越多,则负载越大,根据吸收热随负载增大而减小的规律,可得出实验的吸收热值接近于Kim 80 ℃的数据。
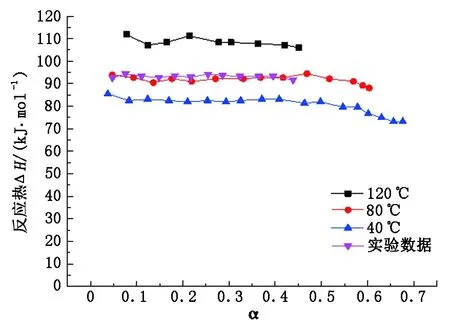
图8 压力为100 kPa本文实验与Kim数据对比Fig.8 Comparison of experimental data with Kim' data at 100 kPa
为验证压力对反应热的影响,实验测量的300 kPa的数据见图9。可以看出,300 kPa的曲线介于40 ℃与80 ℃的曲线之间,与以上阐述的吸收热介于吸收温度40 ℃与78 ℃对应的吸收热数值之间相吻合。
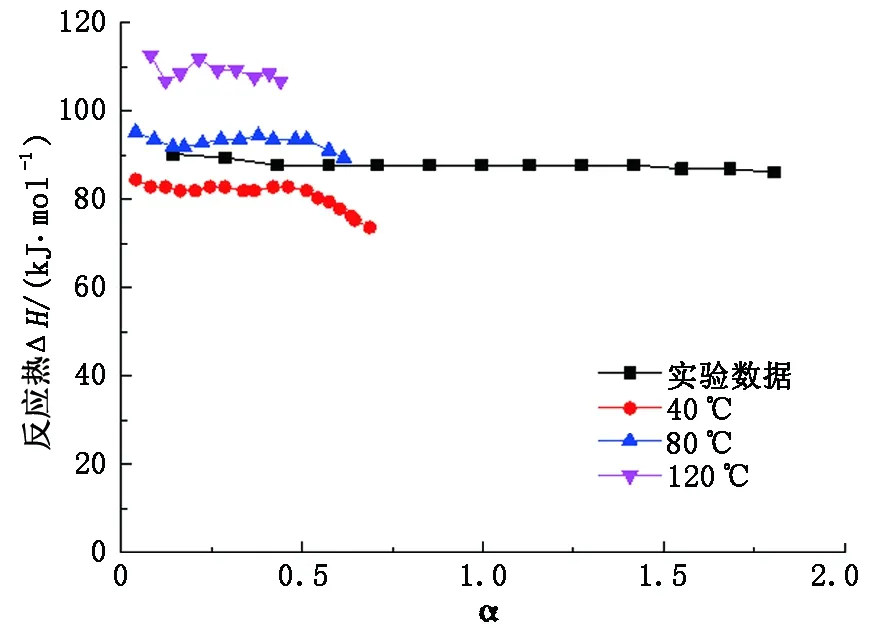
图9 压力300 kPa本文实验与Kim数据对比Fig.9 Comparison of experimental data with Kim' data at 300 kPa
4 解吸反应热测量
解吸反应为吸收反应的逆过程,解吸热包括了溶液升温、系统升温、解吸反应吸收热、汽化潜热4部分,其中汽化潜热是排出的 CO2携带的高温蒸汽的能量,溶液在整个过程的质量是逐渐减小的。特别是化学吸收法的解吸能耗过高[25-26],已经成为化学吸收法的主要制约瓶颈。为此,世界各国研究者从新吸收剂开发、吸收解吸装置性能、过程优化和工艺改进等方面开展了大量的研究工作[27-28]。
4.1 解吸反应热边界
本文中实验解吸过程中溶液升温热量、系统升温热量、汽化潜热以及解吸反应热均来自于电源电能的输入,因此解吸反应热为电能与其他能量总和的差值。水在标准状况下的汽化潜热为2 257 kJ/kg,冷凝水相差1 g,则系统的汽化潜热相差2.257 kJ,由此可见,冷凝液的质量微小的差别,也会对解吸热产生较大的影响。由于冷凝水主要是在解吸反应过程出来的CO2携带水蒸气经冷却逐渐形成的,而解吸时间越长冷凝液的质量越大,因此本实验系统测量解吸反应热的关键是对解吸反应结束时刻的认定。
解吸反应开始时刻是从吸收反应结束后开启排气阀门开始计算,反应结束时刻是观察冷凝液出水由分散液滴变成桥塞管路的液柱时刻计算。
以一组实验数据为例(图10)。在6 000 s、温度为85 ℃的斜率发生变化,这是由于系统内溶液开始进行解吸反应,吸收了部分能量,导致溶液无法按照原先的升温速率升温,因此这个点视为实际开始解吸时刻,不同于计算开始解吸时刻,后者是用于在处理程序中输入的计算值,而计算模型是基于能量守恒的原理,视某个时刻开始之后的系统的能量输入与输出相等。
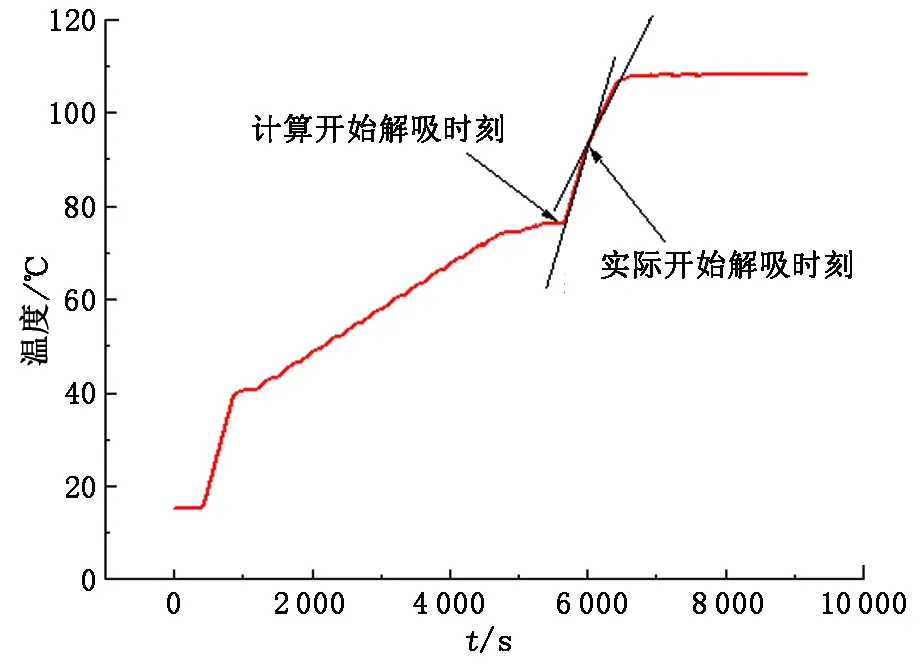
图10 解吸反应开始反应时刻Fig.10 Desorption reaction time
实验中解吸反应的结束时刻是通过观察冷凝水的出液情况判断的,解吸反应过程的冷凝管出液有2种状态(图11):一种是分散的液滴,这种状态的形成是由于解吸过程中排出CO2的气提作用会携带出一部分溶液,从而冷凝出来,但这种携带出的液量较少,只会形成分散的液滴附着在管壁,逐渐被带入双端钢瓶中;另一种是液塞形成桥塞管路状,此时对应大规模解吸反应基本结束,液态水由于压力下降开始大量蒸发汽化阶段,这种状态的形成主要是由于解吸过程水大量汽化,造成冷凝管中出现连续的水柱,此时将会对解吸热的测量带来较大误差。
质量流量计由于本身结构,气体通过流量计需要一定的内外压差,而解吸产生的CO2气量使系统内压力的增值较小。通过放空实验测量该压差(图12),反应器初始压力为270 kPa。可以看出,至平衡状态反应器内余压约为1.5 kPa,即一旦反应器内外压差低于1.5 kPa,气体流量趋近零。
另外,解吸过程随着温度的不断上升,溶液的饱和蒸汽压也随之增加,由于出口流量的自动控制,当解吸反应析出的CO2与温升造成的饱和蒸汽压上升,两者作用的反应器压力小于设定压力,则无气体流出,而反应过程必须保证反应器内压力高于溶液对应温度的饱和蒸汽压,以防止大量汽化,不利于反应热测量。故改进设置解吸反应设定压力为溶液实时温度对应的饱和蒸汽压。

图11 冷凝管出液的状态Fig.11 State of outlet of condensing tube
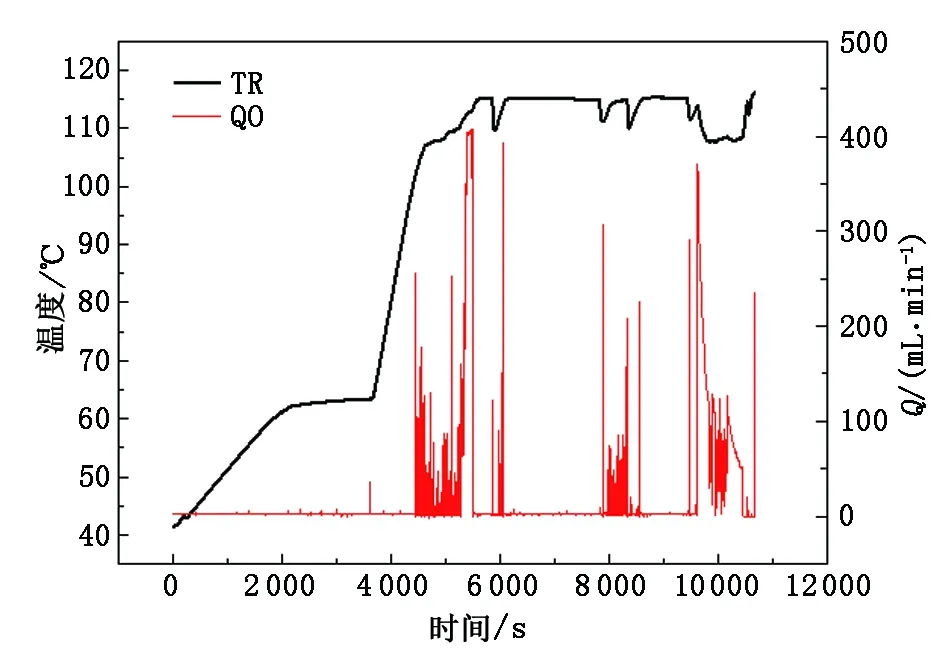
图12 引入饱和蒸汽压控制前出口流量曲线Fig.12 Outlet flow curve before pull-in saturated steam pressure
实验测得MEA、DEA饱和蒸汽压为0 kPa时对应的温度分别为102 ℃和105 ℃,由于解吸温度不能低于饱和蒸汽压为0 kPa所对应的温度,以防水蒸气大量汽化,影响解吸热的测量,因此解吸温度设为105 ℃,解吸压力为0 kPa。
4.2 MEA解吸反应热
表2为用质量分数为30%的MEA溶液在压力为100 kPa的条件下测得不同温度条件下的解吸热数据。
表3是在吸收温度为40 ℃、压力为100 kPa的条件下测得的不同质量分数的MEA的解吸热数据。
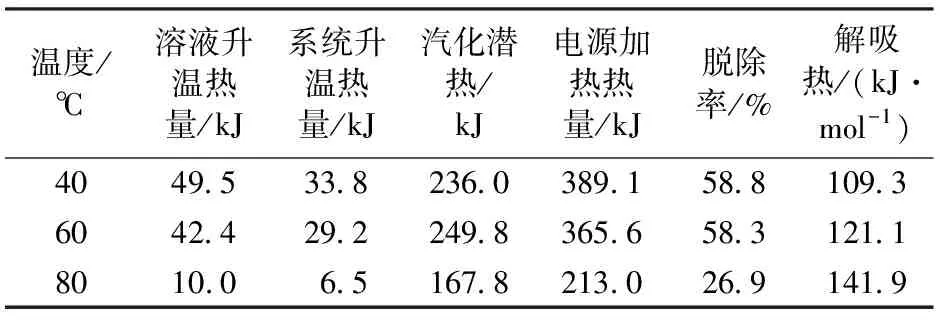
表2 各温度下MEA解吸热数据
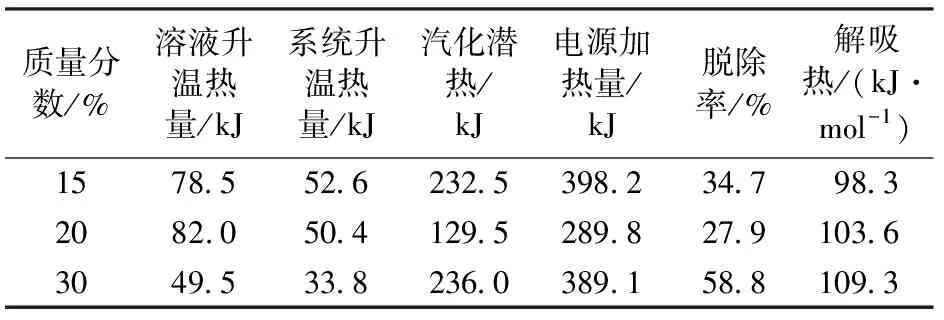
表3 各质量分数下MEA解吸热数据
表4是用质量分数为30%的MEA溶液在温度为40 ℃的条件下,测得不同压力条件下的解吸热数据。

表4 各压力下MEA解吸热数据
由表2~4看出,各工况条件下得到的解吸热值相比吸收热值均明显偏高,吸收工况为 30%MEA在100 kPa、40 ℃时,解吸热比吸收热高出 10 kJ/mol。理论上解吸反应为吸收反应的逆过程,因此两者吸收与释放的热量应该相等。产生这样的差异是由于携带的水滴状变成水柱状过程中存在的汽化吸热过程,带走的这部分能量导致解吸反应的能耗总体较吸收反应偏高。目前对醇胺溶液的再生能耗的测试实际上都是以吸收热为标准,从实验可以看出,实际的能耗较吸收热更准确。
在相同的解吸条件下,从脱除率的反映情况来看,各吸收温度下,40 ℃与 60 ℃相当,80 ℃时最低但能耗最高,说明较高的吸收温度使得 MEA 解吸性能下降。随着吸收温度的增大,MEA的解吸热也随之增大;各吸收质量分数下,解吸热相差不大,但脱除率在 30%时最大,20%时最小,说明溶液质量分数对于 MEA 溶液的解吸性能影响不是单调函数;各吸收压力下,解吸热相差不大,基本保持在109.3 kJ/mol,在压力为100 kPa时,CO2脱出率高达58.8%,且在较高吸收压力下脱除率整体偏低。
4.3 DEA解吸反应热
表5为用质量分数为30%的DEA溶液在压力为100 kPa的条件下,测得不同温度条件下的解吸热数据。
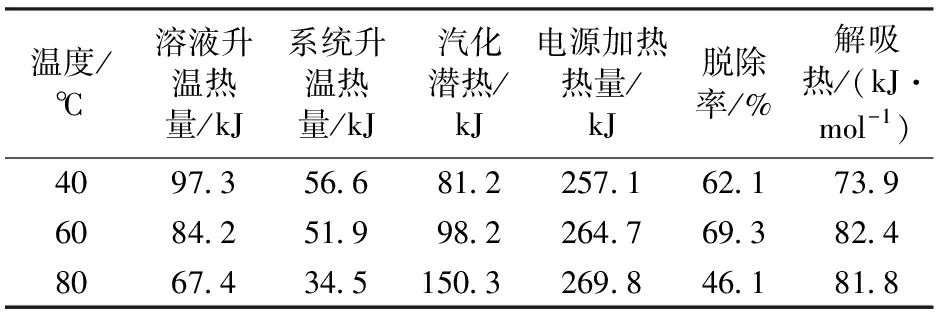
表5 各温度下DEA解吸热数据
表6为在吸收温度为40 ℃、压力为100 kPa的条件下,测得的不同质量分数DEA的解吸热数据。
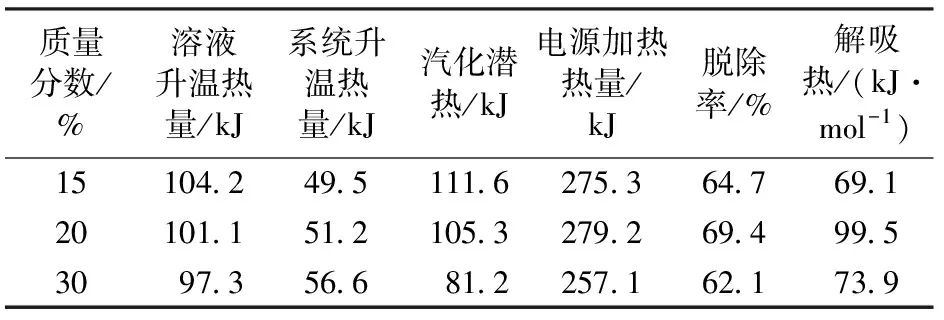
表6 各质量分数下DEA解吸热数据
表7为用质量分数为30%的DEA溶液在温度为40℃的条件下,测得不同压力条件下的解吸热数据。
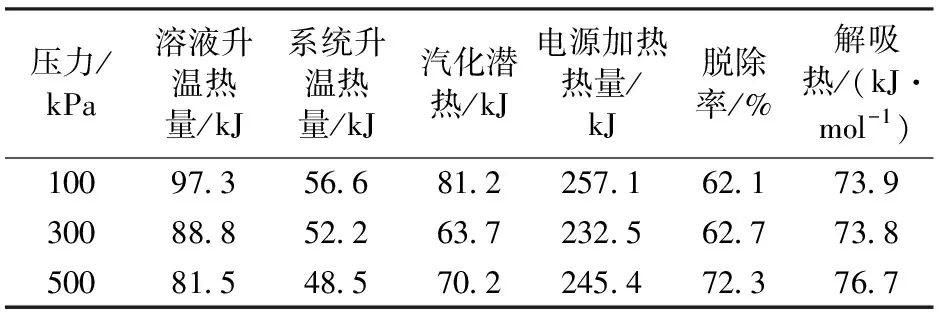
表7 各压力下DEA解吸热数据
不同吸收温度条件下,在40 ℃时解吸热最低,60 ℃和80 ℃的解吸热相差不大,且高于40 ℃的解吸热,脱除率在60 ℃最高,80 ℃时最低;在不同吸收质量分数和压力的条件下,脱除率基本保持在62%~72%。对于解吸热来说,某些工况下存在反常情况,如80 ℃解吸热略低于60 ℃,20%解吸热比30%要高,高达99.5 kJ/mol,若排出测量误差的可能,这些反常点的出现说明吸收热对于溶液再生能耗的决定作用并不可靠,而实际的解吸反应测量更能反馈该工况下溶液具体的能耗情况。
综合比较MEA和DEA的解吸热和脱除率数据可以看出,MEA 溶液解吸热范围为100~140 kJ/mol,DEA溶液解吸热范围为70~100 kJ/mol,MEA的能耗明显高于DEA,与MEA的吸收量大于DEA有很大关系,因为吸收热越大,反应热越大。从数据中还可以发现DEA溶液的脱除率普遍超过60%,而MEA溶液最高为60%,这反映了DEA溶液虽然在吸收能力上弱于MEA,但其富液的再生能力较强,文献[2]显示在净化过程中MEA和CO2会发生副反应而生成难以再生降解的噁坐烷酮等降解产物,导致部分溶剂丧失脱碳能力,可见DEA在反应过程中的溶液的性能稳定方面较MEA更有优势。
5 结 论
(1)MEA吸收量40 ℃最高,80 ℃时最低,吸收热随温度升高而增大,且高吸收温度不利于解吸;在不同吸收质量分数情况下,MEA和DEA溶液的吸收量随质量分数增大而增大,吸收热 30%时最高,15%和 20%相当,且低质量分数不利于解吸;在不同压力情况下,MEA和DEA溶液的吸收量随压力增大而增大,吸收热随压力升高而减小,且高压不利于解吸。
(2)与MEA溶液相比而言,DEA溶液吸收量与吸收热随各吸收工况的变化趋势与MEA基本一致,DEA溶液的吸收能力仅有MEA的一半,吸收热较MEA低20~30 kJ/mol,但解吸脱除率普遍高于60%,即解吸能力较MEA强。MEA溶液吸收反应热范围为80~100 kJ/mol,解吸反应热范围为 100~140 kJ/mol,DEA溶液吸收反应热范围为50~80 kJ/mol,解吸反应热范围为70~100 kJ/mol。
(3)自主设计的反应热测试仪测试方差最小,吸收热数据与Kim测试数据相吻合。
(4)解吸反应的结束边界是通过观察冷凝水的出液情况判断的,一种是分散的液滴,另一种状态是液塞形成桥塞管路状,此时对应大规模解吸反应基本结束,平衡状态反应器内余压约为1.5 kPa,气体流量趋近零。
