野菊茎叶多糖的 提取工艺优化及其性质研究
2018-07-11刘存芳杜全超田光辉
刘存芳,杜全超,史 娟,张 强,田光辉
(陕西理工大学陕西省催化基础与应用重点实验室,陕西汉中 723000)
野菊(ChrysanthemumindicumL.)又俗称苦薏、野黄菊、疟疾草等,是菊科菊属的一种多年生草本植物,全国各地分布广泛,资源丰富,常生长于山坡草地、田边路旁,喜凉爽湿润的环境,耐寒,陕西秦巴山区盛产野菊。野菊花是野菊的头状花序[1],作为中药材广泛使用[2-3],野菊花中的活性成分研究较多[4],其含有黄酮[5]、挥发油和萜类[6-7]、多糖[8]、蛋白质和氨基酸、维生素以及营养元素等物质[9-10],能清热解毒、消肿,治疗咽喉肿痛、痈疽、丹毒、疔疮、湿疹[11],抑制病毒、保肝护肝[12],其中野菊花多糖还能清除氧自由基,有抗衰老、增强机体抵抗力等功效[13-14],野菊花药理活性的研究也较多[15-16]。
野菊茎叶中同样含有丰富的活性成分[17-18],如有机酸、黄酮、多糖和糖苷、萜类、挥发油、苯丙素类以及营养元素等[19-21],其茎叶的开发应用研究还尚少[22-23],在野菊花作为中药材的收集过程中有大量的野菊茎叶产生,野菊茎叶没能得到充分利用,其有开发应用的价值[24]。另外,目前关于野菊多糖的研究几乎没有,本文用超声波辅助热水浸提法提取野菊茎叶中的多糖,在单因素实验的基础上设计正交实验来优化其多糖的最佳提取工艺,并对其多糖中的单糖组成进行分析,初步测试其多糖的抗氧化活性,为野菊茎叶的综合利用可提供技术支撑。
1 材料与方法
1.1 材料与仪器
野菊的茎叶 由陕西理工大学植物学分类专家赵桦教授鉴定,确定是野菊(ChrysanthemumindicumL.)的茎叶。葡萄糖(Glu)、果糖(Fru)、半乳糖(Gal)、甘露糖(Man)、木糖(Xyl)、阿拉伯糖(Ara)、鼠李糖(Rha) 均为分析纯,美国Sigma公司;维生素C(VC)、无水乙醇、95%乙醇、无水乙醚、浓硫酸、苯酚、邻二氮菲、硫酸亚铁、磷酸、氯仿、正丁醇、三氟乙酸、苯、盐酸羟胺、吡啶、乙酸酐 均为国产分析纯;水 二次蒸馏水;0.75 mmol的邻二氮菲溶液、PBS溶液为150 mmol/L的pH7.4的磷酸缓冲溶液、0.75 mmol的硫酸亚铁溶液、0.01%的过氧化氢溶液,临时配制。
Finnigan-TraceDSQ型GC-MS仪 美国热电公司;UV-2102 PCS 型紫外-可见分光光度计 尤尼柯上海仪器有限公司;FW177型中草药粉碎机 天津市泰斯特仪器有限公司;SB-4200DTD型超声波清洗机 宁波新芝生物科技股份有限公司;HH-2型电热恒温水浴锅 北京科伟永兴仪器有限公司;SHB-III型循环水式多用真空泵 郑州长城科工贸有限公司;DHG-9070A型电热恒温鼓风干燥箱 上海齐欣科学仪器有限公司;RE-52AA型旋转蒸发器 上海亚荣生化仪器厂;METTLERAE240分析天平 上海托利多-梅特勒仪器有限公司;索氏提取器、布氏漏斗、抽滤瓶等器皿 天津市世博伟业化玻仪器有限公司。
1.2 实验方法
1.2.1 野菊茎叶的预处理及野菊茎叶多糖粗提液的制备 将收集好的野菊茎叶除去杂叶,在50 ℃恒温下干燥至恒重,用中草药粉碎机打碎成粉末,过200目筛,密封保存备用。称取0.2 g野菊茎叶粉末装入索氏提取器中,以乙醚为溶剂回流脱色脱脂[25-26],至提取液呈无色,再换用95%乙醇回流,目的是脱去野菊茎叶中的极性小分子如黄酮、萜类、游离态单糖以及其他醇溶性物质,回流至提取液呈无色后将野菊茎叶粉末取出晾干,回收乙醚和乙醇。晾干的野菊茎叶粉末置于塑料提取管内加适量水,在超声波清洗机内提取多糖,在不同的料液比、提取温度、提取时间、超声功率等条件下提取野菊茎叶中的多糖。抽滤,重复浸提一次,合并滤液,得野菊叶多糖的粗提液。
1.2.2 野菊茎叶多糖提取量的确定 用苯酚-硫酸法测定多糖含量[25]。
1.2.2.1 标准曲线的制作 准确称取105 ℃干燥至恒重的葡萄糖对照品10.00 mg定容于10 mL容量瓶中,配成1 mg/mL的对照品溶液,取8支10 mL的具塞比色管,准确吸取对照品溶液,用水补足2 mL,分别稀释成0.02、0.04、0.06、0.08、0.10、0.12、0.14、0.16 mg/mL的8个不同浓度的系列溶液,再分别加入6%苯酚溶液3 mL混匀,加入浓硫酸5 mL,迅速摇匀,放入80 ℃恒温水浴中,加热20 min后取出,冷却至室温,以水作空白参比,在490 nm波长处用分光光度计测定吸光度值。以吸光度(y)值作纵坐标,以质量浓度(x)值作横坐标可得回归方程为:y=15.038x+0.0652,R2=0.9983,在0.02~0.16 mg/mL的浓度范围内,质量浓度与吸光度呈良好的线性关系。
1.2.2.2 多糖提取量的测定 将野菊叶多糖的粗提液转移至150 mL容量瓶中,润洗,定容,然后准确量取2 mL溶液于具塞比色管中,缓慢加入3 mL 6%苯酚和5 mL98%浓硫酸,迅速摇匀,在80 ℃恒温水浴中,加热20 min后取出,冷却至室温,在490 nm波长下,测量吸光度,结合标准曲线,通过式子,提取量(g/100 g)=多糖质量/原料质量×100确定野菊茎叶多糖的提取量,以质量百分含量表示。
1.2.3 野菊茎叶多糖提取工艺的优化
1.2.3.1 单因素实验 在超声温度80 ℃,超声时间35 min,超声功率360 W时,考察料液比为1∶20、1∶30、1∶40、1∶50、1∶60、1∶70 (g/mL);在料液比1∶50 (g/mL),超声时间35 min,超声功率360 W时,超声温度为50、60、70、80、90、100 ℃(温度过高时,水浴中通入水蒸气控温);在料液比1∶50 (g/mL),超声温度80 ℃,超声功率360 W时,超声时间为15、20、25、30、35、40 min;在料液比1∶50 (g/mL),超声温度80 ℃,超声时间35 min时,超声功率为300、320、340、360、380、400 W等单因素条件下对野菊茎叶多糖提取的影响。
1.2.3.2 正交实验 在单因素实验基础上,以料液比、超声温度、超声时间、超声功率为因素,每个因素取3个水平,设计L9(34)正交实验优化野菊茎叶多糖的提取条件如表1所示。

表1 正交实验因素水平表L9(34)Table 1 The factor-levelTable of orthogonal tests L9(34)
1.2.4 野菊茎叶多糖的精制 称取野菊茎叶粉末100 g在索氏提取器中,分别用乙醚和95%乙醇回流至提取液呈无色,回收乙醚和乙醇。取出粉末晾干,在最佳提取工艺条件下提取多糖,抽滤;将粉末用水重新提取一次抽滤,合并两次的提取液。减压蒸馏提取液为四分之一体积时转移到烧杯中,加入5倍体积无水乙醇沉淀,静置24 h,抽滤,滤饼在105 ℃下干燥,得粗多糖。重复提取粗多糖5次,合并粗多糖,用水溶醇沉法纯化多糖,通过Sevag法脱蛋白(氯仿∶正丁醇=4∶1),在DEAE-纤维素柱(5.0 cm×120 cm)用水洗脱,用苯酚-硫酸显色收集洗脱液,减压浓缩收集液,用无水乙醇沉淀过夜,抽滤、在105 ℃下干燥,得野菊茎叶精制多糖。
1.2.5 野菊茎叶多糖的单糖组成分析 称取野菊茎叶精制多糖12 mg 于安瓿瓶中滴加水全部溶解后,加入4 mL 5 mol/L的三氟乙酸溶液后真空密封,在110 ℃的温度下水解2.5 h,水解液冷却,减压蒸馏直至无明显水分,再加入2.5 mL苯,减压蒸馏回收苯,再加苯2次重复以充分除去三氟乙酸和水,得到野菊茎叶多糖的水解物,减压干燥。糖腈乙酸酯衍生化后用GC-MS分析野菊茎叶多糖的单糖组成,取野菊茎叶多糖的水解物加入20 mg盐酸羟胺,用3 mL吡啶溶解,密封后在90 ℃下水浴35 min,冷却后,滴加1.1 mL乙酸酐,再次密封于90 ℃下水浴35 min后,在60 ℃水浴中敞口用氮气吹干,得到野菊茎叶多糖水解物的糖腈乙酸酯衍生物,用2 mL氯仿溶解,直接吸取在GC-MS仪中分析,对照品单糖的混合样品,按照该方法衍生化后再进行分析。对照品单糖进行定性,色谱峰面积归一化法定量来确定野菊茎叶多糖中各单糖的比例。GC-MS仪工作为DB-5MS(30 m×0.25 mm×0.25 μm)色谱柱,气相色谱条件:载气为He气,柱温:50~250 ℃;初始温度为50 ℃,保持1 min,以10 ℃/min程序升温200 ℃,保持1 min,再以5 ℃/min升温250 ℃,进样口温度为250 ℃;衡流模式流量为1 mL/min,进样量为0.5 μL,分流比为25∶1,色质界面温度为250 ℃。质谱条件:EI离子源,电离能量70 eV,离子源温度250 ℃,倍增器电压976 V,扫描范围80~550质量单位,全扫描模式。
1.2.6 野菊茎叶多糖对羟基自由基的清除率测定 可测定野菊茎叶多糖在Fenton体系中对Fe2+/H2O2产生的羟基自由基清除率[26]。称取5 mg 野菊茎叶精制多糖在50 mL的容量瓶中配置成浓度为0.1 mg/mL的溶液,取8支10 mL的具塞比色管,其中6支编号为1~6号,分别加入0.2、0.4、0.6、0.8、1.0、1.2 mL多糖溶液;另2支标记为未损伤管和损伤管,不加多糖溶液。分别向8支比色管中加入1 mL邻二氮菲溶液、1.5 mL PBS 溶液和1 mL FeSO4溶液,摇匀,再向1~6号以及损伤管中加入1 mL 0.01%的H2O2溶液,用水将8支比色管定容至刻度线并充分摇匀,在37 ℃下普通培养箱中保温2 h后取出冷却至室温,在510 nm下测量样品吸光度I。实验重复三次,取平均值。同时,以相同浓度的VC作为对照。自由基清除率(%)=(In-I0)/(I1-I0)×100,式中:In为加多糖或VC溶液的吸光度,I1为未损伤溶液的吸光度;I0为损伤溶液的吸光度。
1.3 数据处理
用OriginLab Origin V 8.0软件处理数据和绘制图形。
2 结果与分析
2.1 影响野菊茎叶多糖提取的单因素
2.1.1 料液比对野菊茎叶多糖提取的影响 料液比对野菊茎叶多糖提取量的影响如图1,在料液比变化1∶20~1∶50 (g/mL)之间,随着料液比的减小野菊茎叶多糖的提取量逐渐增大,当料液比超过1∶50 (g/mL)后,野菊茎叶多糖的提取量逐渐降低。当料液比较大时,溶剂较少,多糖扩散阻力较大,多糖的溶解量较少,溶出率也就比较小;随着料液比的减小,野菊茎叶多糖溶出率随着溶剂量增加,当料液比过小时,溶剂量过多,吸收损耗了部分超声波,会导致多糖对超声波能量的不敏感,难以从细胞壁上或细胞中脱离,溶出率相对减小,另外,溶剂过多时不利于后续的多糖处理。因此后续选取料液比为1∶40、1∶50、1∶60 (g/mL)三个水平进行正交实验。

图1 料液比对多糖提取量的影响Fig.1 The effect of solid-liquid ratio on the extraction of polysaccharides
2.1.2 超声温度对野菊茎叶多糖提取的影响 超声温度对野菊茎叶多糖提取结果如图2所示,提取温度在50~80 ℃时,野菊茎叶多糖提取量随着温度的升高而升高,在80 ℃时多糖提取量最高,可高达6.01 g/100 g。当超过了80 ℃后,野菊茎叶多糖提取量逐渐下降,随着温度的升高在超声作用下会使野菊茎叶多糖发生分解。因此后续选取超声温度为70、80、90 ℃。

图2 温度对多糖提取量的影响Fig.2 The effect of temperature on the extraction of polysaccharides
2.1.3 超声时间对野菊茎叶多糖提取的影响 超声时间对野菊茎叶多糖提取的影响结果如图3所示,可看出在15~30 min时野菊茎叶多糖提取量随着时间的延长而递增,在30 min时多糖提取量可高达5.82 g/100 g,多糖提取量在30 min后开始下降。30 min之前野菊茎叶多糖随时间溶出程度增大,30 min后,过长时间的超声波会使部分多糖链断裂造成损失影响野菊茎叶多糖的提取量。因此后续选取超声时间为25、30、35 min三个水平。

图3 时间对多糖提取量的影响Fig.3 The effect of time on the extraction of polysaccharides
2.1.4 超声功率对野菊茎叶中多糖提取的影响 超声功率对野菊茎叶多糖提取的影响如图4,超声功率在300~340 W之间时野菊茎叶多糖的提取量逐渐升高。当超声功率为340 W时

图4 功率对多糖提取量的影响Fig.4 The effect of power on the extraction of polysaccharides
野菊茎叶多糖提取量达到最高,超声功率超过340 W之后多糖提取量下降。超声波的空化效应能产生剧烈的震动,会破坏植物细胞结构减少溶剂进入植物细胞组织的阻力,加速多糖的溶出。超声功率较小时,空化效应的作用较小,多糖溶入溶剂中的速率也会小,多糖提取量相对较低,随着超声功率的增加,超声波的空化作用增强,野菊茎叶的细胞组织易破损,加快了多糖分子溶入溶剂中的速率,提高了多糖溶出量。超声波作用于细胞时也会产生局部的升温,当超声波功率过大时,局部溶液升温过热会破坏多糖的结构,影响多糖的提取量,超声波的功率不宜太大。因此后续选取超声功率为320、340、360 W三个水平。
2.2 正交实验优化野菊茎叶多糖的提取工艺
以野菊茎叶多糖的提取量作为考察指标,经过极差和均值分析来确定超声波辅助热浸提取野菊茎叶多糖的最佳工艺。由表2可知,影响野菊茎叶多糖提取的各因素主次关系为:超声温度>料液比>超声功率>超声时间,最佳提取工艺为超声温度80 ℃,料液比1∶40 (g/mL),超声波时间35 min,超声波功率360 W。

表2 正交实验结果Table 2 the results of orthogonal tests
经过3次平行验证实验,在最优条件下提取野菊茎叶多糖,提取量可高达6.26 g/100 g。提取中温度相对不高,提取时间相对较短,料液比值偏小可减小提取中溶剂蒸发的影响,可用于中小企业工业化生产。
2.3 野菊茎叶多糖的单糖组成
对照品单糖混合样品的糖腈乙酸酯衍生物经GC-MS分析的总离子流图如图5所示,在色谱条件下能完全分离,果糖、鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖的色谱峰没有重叠。野菊茎叶多糖水解物的糖腈乙酸酯衍生物经GC-MS分析的总离子流图如图6所示,结合图5中各对照品单糖的色谱峰出峰时间,可以确定出野菊茎叶多糖是由鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖等6种单糖组成,没有检出果糖。色谱峰面积归一化法确定出野菊茎叶多糖中的半乳糖、葡萄糖、阿拉伯糖、鼠李糖、甘露糖、木糖6种单糖按照色谱峰面积34.58∶27.61∶19.32∶10.53∶4.11∶3.85的比例组成,说明野菊茎叶多糖是杂多糖,以半乳糖、葡萄糖、阿拉伯糖为主,占总面积的81.51%。
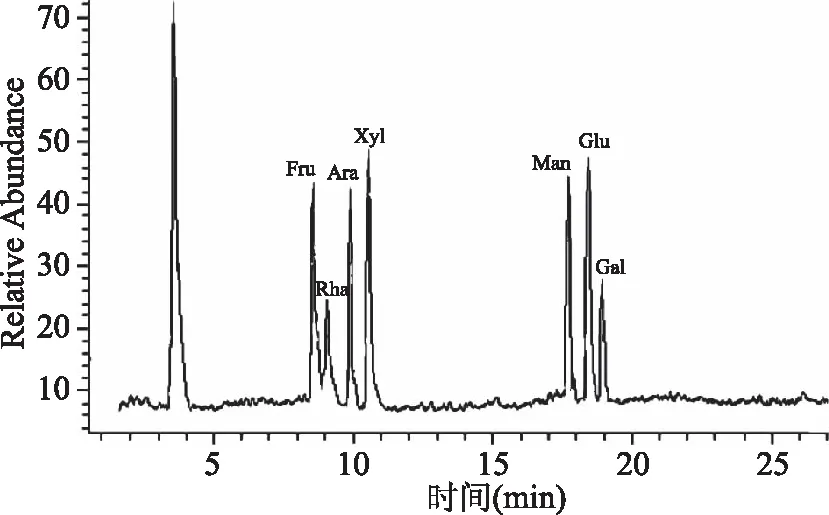
图5 混合对照品单糖糖腈乙酸酯 衍生物的GC-MS总离子流图Fig.5 TIC chromatogram of standard monosaccharides by nitrile acetic ester derivative
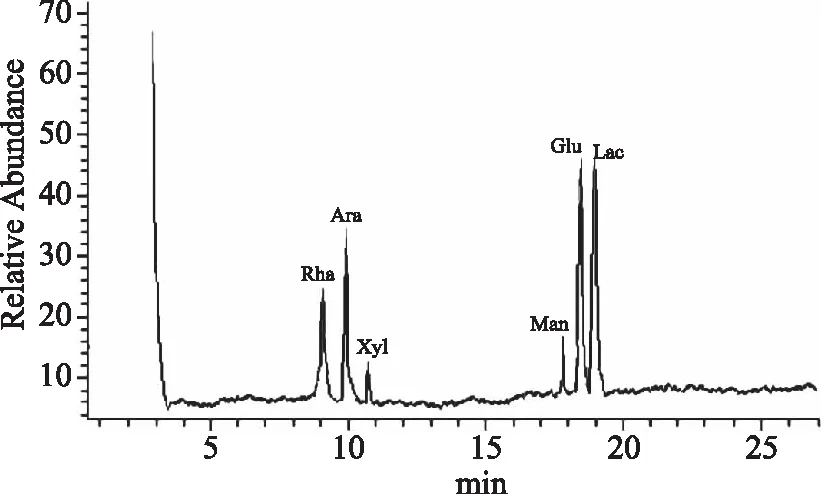
图6 野菊茎叶多糖水解物的糖腈乙酸酯 衍生物的GC-MS总离子流图Fig.6 TIC chromatogram of polysaccharide hydrolysate by nitrile acetic ester derivative from the branches and leaves of Chrysanthemum indicum
2.4 野菊茎叶多糖对羟基自由基有清除作用
由图7可得,野菊茎叶多糖对Fe2+/H2O2产生的羟基自由基有明显地清除作用,其多糖浓度和清除效果存在着一定的量效关系,随着野菊茎叶多糖浓度的增加对羟基自由基的清除率不断增强。和VC对羟基自由基的清除率相比偏低,但也表现出明显地清除作用,说明野菊茎叶多糖有抗氧化活性,是一种潜在的天然抗氧化物质。
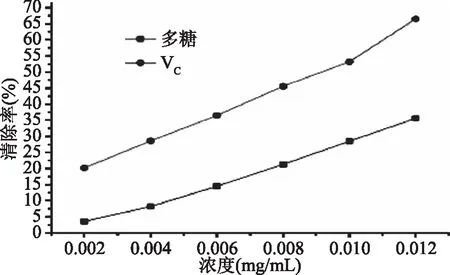
图7 野菊茎叶多糖对羟基自由基的清除作用Fig.7 Scavenging activity of polysaccharide from the branches and leaves of Chrysanthemum indicum on hydroxyl radical
3 结论
野菊茎叶粉末脱色脱脂之后,在考察料液比、超声温度、超声时间、超声功率等单因素影响多糖提取量的基础上,设计正交实验确定野菊茎叶多糖最佳提取工艺为超声温度80 ℃,料液比1∶40 (g/mL),超声时间35 min,超声功率360 W,该条件下多糖的提取量为6.26 g/100 g,这可为利用超声波辅助热水浸提法提取野菊茎叶多糖的工业化生产提供技术支撑,也为分步提取野菊茎叶中的活性物质,充分利用天然资源提供参考。
在最优提取工艺条件下对所得多糖进行精制,用色谱峰面积归一化法确定精制野菊茎叶多糖中单糖的比例,野菊茎叶多糖是由半乳糖、葡萄糖、阿拉伯糖、鼠李糖、甘露糖、木糖6种单糖按照色谱峰面积34.58∶27.61∶19.32∶10.53∶4.11∶3.85的比例组成,说明该野菊茎叶多糖是以半乳糖、葡萄糖、阿拉伯糖为主的杂多糖。通过Fenton体系以VC为对照来确定野菊茎叶多糖对羟基自由基的清除作用,与VC相比对羟基自由基的清除率较低,但也表现出明显地清除作用,说明野菊茎叶多糖有抗氧化活性,野菊茎叶多糖的其他抗氧化效果以及其他生物活性还有待进一步研究。
