超声-微波协同提取杜仲树皮 及树叶中的黄酮类化合物
2018-07-11姜子涛闫长旭李婷婷梁露露何海军
王 颖,李 荣,姜子涛,闫长旭,李婷婷,梁露露,何海军
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
杜仲(EucommiaulmoidesOliver)又名胶木、思仲、思锦树等,为单科单属落叶乔木,是我国特有珍稀濒危二类保护植物及第三纪冰川运动孑遗植物[1-2]。有研究表明,杜仲叶与皮的化学成分基本相同,药效类似[3]。杜仲含有酚类、黄酮类、多糖类及杜仲胶等多种化合物[4]。黄酮含量的高低是判断杜仲生药及其产品质量的重要指标。现已从杜仲中分离鉴定多种黄酮类化合物,比如槲皮素、芦丁、黄芩素、山奈酚等[5-6]。而杜仲胶是结构为反式聚异戊二烯的一种天然高分子材料,主要存在于树皮、叶和种子中[7]。
超声波辅助提取及微波辅助提取是近年来适用于以天然产物为原料提取功能因子的新技术[8-10]。超声波因其空化作用而产生高强度机械效应和热效应,具有细胞破碎、增加穿透性与加速质量传递等优势;微波辅助提取则是通过产生高效内热和电介质热而提高提取效率、减少提取时间并降低料液消耗[11-13]。尽管以上两种提取技术各具优点,但超声波辅助提取的热效应较弱,通常在提取过程中无法达到提取所需高温;微波辅助提取则存在加热不均等问题,这些缺点限制了这二种方法的进一步应用和推广。而采用超声-微波协同提取方法(UMAE)可实现优势互补[14-15],即超声波产生的振荡和搅拌作用能有效弥补微波传热、传质不均等缺陷,而微波极佳的热效应能有效地弥补超声波产热不足的问题。近年来,UMAE在提取多糖、多酚、黄酮等方面已有部分报道[16-17]。Cheng等[16]提取了鸡血藤总黄酮,付洋等[17]发现此法用于荷叶总黄酮的提取效率明显高于加热提取等传统方法。
本文采用UMAE对杜仲树皮及树叶中的黄酮类化合物进行了提取,利用响应面法对提取条件进行了优化。此外,利用扫描电子显微镜(SEM)[18]对UMAE提取中杜仲的微观结构进行了观察,为此法的高效提取机理提供了解释依据。同时,利用高效液相色谱(HPLC)对杜仲树皮与树叶黄酮类化合物成分进行初步定性和含量比较,为开发利用杜仲黄酮奠定了理论基础。
1 材料与方法
1.1 材料与仪器
杜仲树皮与树叶 产地陕西,粉碎过40目筛后置阴凉处备用;芦丁 中国药品生物制品检定所(纯度≥98%);绿原酸 上海晶纯生物科技有限公司(纯度大于99%);没食子酸 天津一方科技有限公司(纯度≥98%);槲皮苷、山奈酚、阿魏酸、槲皮素 阿拉丁试剂公司(纯度≥98%);1,1-二苯基-2-三硝基苯肼(DPPH)自由基 美国Sigma试剂公司;D101大孔树脂 天津南开大学化工厂;甲醇(色谱纯)、甲酸(色谱纯) Sigma-Aldrich Co.(中国公司);无水乙醇、石油醚(沸程30~60 ℃和60~90 ℃)、硝酸铝、亚硝酸钠等 均为国产市售分析纯;蒸馏水、超纯水 实验室自制。
CW-2000型超声-微波协同萃取仪 上海新拓分析仪器科技有限公司;Alpha-1500紫外可见分光光度计 上海谱元仪器有限公司;JSM-IT300型扫描电子显微镜 日本电子公司;1260 Series高效液相色谱仪,色谱柱为Agilent Zorbax Eclipse Plus-C18(250 mm×4.6 mm,5 μm) 美国Agilent公司;FD-5冷冻干燥机 北京博医康实验仪器有限公司;FW100高速万能粉碎机 天津市泰斯特仪器有限公司;TGL-16M台式高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;RE52-86A 型旋转蒸发仪 上海亚荣生化仪器厂;Vortex-Genie 2涡旋振荡器 美国科学工业有限公司;AUW120D电子天平 日本岛津公司。
1.2 实验方法
1.2.1 杜仲胶的分离
1.2.1.1 杜仲胶的分离对杜仲黄酮得率的影响 分别称取3.0 g杜仲树皮粉末和杜仲叶粉末进行脱胶,按照液料比50∶1 (mL∶g)分别加入150 mL石油醚(沸程60~90 ℃),利用超声-微波协同萃取仪,设置微波功率400 W,在开启超声波(50 W/40 kHz)的条件下,温度70 ℃,设定提取时间30 min,趁热对提取液进行减压抽滤,对脱胶的杜仲树皮粉末和杜仲叶粉末进行干燥,备用。由于杜仲胶于石油醚中的溶解度在低温环境下急剧下降[19],因此滤液置于-20 ℃冰箱冷冻3 h可析出杜仲胶,滤去溶剂即得杜仲胶,干燥称重得杜仲胶质量,其中杜仲胶含量(%)=m×100/M,其中:m为杜仲胶的质量(g);M为杜仲粉末质量(g)。各称取1.0 g上述已脱胶的杜仲树皮及叶的粉末和未脱胶的树皮及叶的粉末,按照下述1.2.2方法进行UMAE提取,得到黄酮提取液,根据1.2.3.2节中公式计算黄酮得率,从而比较杜仲胶的分离前后对杜仲树皮及叶的黄酮提取率的影响。
1.2.1.2 杜仲胶分离时间的选择 分别称取六份3.0 g的未脱胶的杜仲树皮粉末,按照1.2.1.1设置超声-微波萃取仪参数,并分别设置时间为0、10、20、30、45和60 min,趁热对提取液进行减压抽滤,对得到的脱胶杜仲树皮粉末进行干燥,备用。各称取1.0 g干燥后的经不同分离时间脱胶的杜仲树皮粉末,按照下述1.2.2方法进行UMAE提取,得到黄酮提取液。根据1.2.3.2节中公式计算黄酮得率,从而确定最佳的杜仲胶分离时间。
1.2.2 杜仲黄酮的UMAE提取 各称取1.0 g上述已脱胶的杜仲树皮及叶的粉末或未脱胶的树皮及叶的粉末,与一定体积的不同浓度的乙醇溶液置于超声-微波协同萃取仪的萃取瓶中进行萃取,设定不同的液料比、提取温度、微波功率、提取时间等条件进行UMAE提取。随后将提取液冷却后离心(温度4 ℃,转速11000 r/min,时间10 min)。上清液经过石油醚(沸程30~60 ℃)三次萃取去除脂溶性成分及叶绿素后,将所得的杜仲黄酮提取液转移至50 mL容量瓶中,用提取时所使用的相应浓度乙醇溶液定容至刻度,则为杜仲黄酮提取液。
1.2.2.1 杜仲黄酮的提取工艺优化单因素实验 由于预实验显示杜仲叶中黄酮含量远高于树皮,树叶与树皮相比更适合于作为提取黄酮类化合物的原料,因此提取条件优化时选用杜仲叶粉末进行。由于仪器限定,超声的功率(50 W/40 kHz)定额不可调节,故本实验在该超声功率下,考察其余因素的影响。称取1.0 g脱胶的杜仲叶粉末,进行单因素实验,得率为提取3次的平均值。首先,固定液料比40∶1 (mL∶g)、微波功率400 W、温度70 ℃、提取时间10 min,考察不同乙醇浓度(40%、50%、60%、70%和80%)对杜仲黄酮得率的影响。其中,液料比为不同浓度的乙醇溶液的体积与杜仲叶粉末质量的比值(mL∶g)。其次,固定乙醇浓度60%、微波功率400 W、温度70 ℃、提取时间10 min,考察不同液料比[20∶1、40∶1、60∶1、80∶1和100∶1 (mL∶g)]对黄酮得率的影响。再次,固定乙醇浓度60%、液料比60∶1 (mL∶g)、微波功率400 W、提取时间10 min,考察不同提取温度(50、60、65、70、75和80 ℃)对黄酮得率的影响。最后,固定乙醇浓度60%、液料比60∶1 (mL∶g)、温度70 ℃,考察不同微波功率(300、400、500和600 W)及不同提取时间(3、4、5、6、7和8 min)对黄酮得率的影响,从而确定最佳提取条件。
1.2.2.2 杜仲黄酮的提取工艺优化单因素实验Box-Behnken中心组合实验 在单因素实验的基础上,固定杜仲提取时间为6 min,选取乙醇浓度(A)、液料比(B)、提取温度(C)和微波功率(D)四个显著因素为自变量,以杜仲黄酮得率(Y)为评价指标,采用4因素3水平的Box-Behnken中心组合实验方法对提取条件进行优化,实验因素及水平设计见表1。
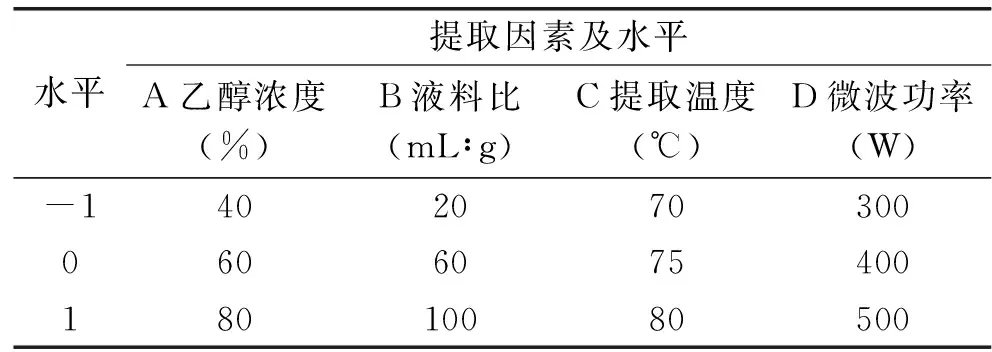
表1 响应面法因素水平编码表Table 1 Factors and levels in response surface analysis
1.2.3 杜仲黄酮的测定
1.2.3.1 芦丁标准曲线的绘制 依据文献方法[20]稍作改进,依次吸取0.2 mg/mL的芦丁标准品溶液0.0、0.5、1.0、1.5、2.0、2.5 mL,分别加入到10 mL比色管中,于每个比色管中各加入5%的NaNO2溶液0.4 mL,涡旋混匀,静置5 min,然后各加入10%的Al(NO3)3溶液0.4 mL,涡旋混匀,静置6 min,再各加入4%的NaOH溶液4.0 mL,用30%的乙醇溶液定容至10.0 mL刻度线,涡旋混匀,静置10 min。依次于508 nm处测吸光度,参比为试剂空白,可得芦丁标准曲线。所得芦丁标准溶液浓度c(mg/mL)与吸光度A的回归方程为:A=11.351×c-0.0063,R2=0.9998。
1.2.3.2 杜仲黄酮含量的测定 将1.0 mL杜仲树皮或杜仲叶黄酮提取液或稀释液(可根据吸光度值适当稀释黄酮原液)置于10 mL比色管中,根据上述1.2.3.1方法[20],依次加入NaNO2、Al(NO3)3、NaOH相继进行反应,最后于508 nm处测吸光度,参比为试剂空白。根据1.2.3.1节中芦丁标准曲线的线性回归方程换算成样品中的黄酮含量。
黄酮得率(%)=C×V×N×100/(M×1000)
其中:C为提取液中黄酮的含量(mg/mL);V为提取液体积(mL);N为稀释倍数;M为杜仲粉末质量(g),1000为质量单位换算系数。
1.2.5 超声-微波(UMAE)与单独超声(UAE)、单独微波(MAE)比较 分别称取三份质量为1.0 g脱胶的杜仲叶粉末,按照表2设置提取条件进行UMAE提取。根据1.2.3.2中公式计算黄酮得率。其中UAE提取法设定微波功率为100 W,仅起到加热的作用[21],因为仪器所限,若微波功率全关闭则达不到所设定的75 ℃提取温度。

表2 超声-微波、单独超声、单独微波的黄酮提取条件Table 2 Setting conditions for UMAE,UAE and MAE
1.2.6 不同提取方法得到的黄酮清除DPPH自由基活性的比较 参照文献的方法[22],测定了三种不同的提取方法(UMAE、UAE、MAE)所得到的黄酮对DPPH自由基的清除率。具体操作如下,在具塞试管中加入浓度为1.0×10-4mol/L的DPPH溶液3.5 mL和无水乙醇0.5 mL,避光静置30 min,测定其在517 nm下吸光度A1;在具塞试管中加入1.0×10-4mol/L的DPPH溶液3.5 mL和不同提取方法所得的杜仲叶黄酮提取液0.5 mL,避光静置30 min,测定其在517 nm下吸光度A;在具塞试管中加入3.5 mL无水乙醇与0.5 mL样品液,测定其吸光度A0。实验重复3次,取平均值。则样品液对DPPH自由基的清除率为:
清除率(%)=[1-(A-A0)/A1]×100
1.2.7 提取完毕杜仲叶粉末残渣扫描电镜分析(SEM) 将UMAE、UAE、MAE提取后获得的残渣置干燥箱中60 ℃干燥,取少量干燥后的三种杜仲叶粉末以及未经黄酮提取的脱胶杜仲叶粉末作为对照,此四种杜仲叶粉末在离子溅射仪中完成真空镀金后利用扫描电子显微镜进行微观分析。
1.2.8 HPLC法对杜仲树皮及树叶黄酮类化合物的初步定性 参考方法[23],利用经95%乙醇、5% HCl、5% NaOH依次浸泡预处理后的D101大孔树脂对上述UMAE提取的杜仲树皮和树叶黄酮进行纯化。其中纯化条件为:上样液pH为4,上样液和洗脱液流速为2 BV/h,洗脱液乙醇体积分数为60%。分别称取经大孔树脂纯化后的杜仲树皮及树叶总黄酮冻干粉末,用色谱纯甲醇溶解并配成1.0 mg/mL的样品储备液。另外,精确称取芦丁、绿原酸、没食子酸、槲皮苷、山奈酚、阿魏酸、槲皮素标准品各0.0100 g,用50 mL甲醇溶解于50 mL 棕色容量瓶中,即得200 μg/mL的标准品储备液。将样品储备液及标准品储备液过0.45 μm有机膜,进HPLC分析。色谱条件:流动相:甲醇(A)、超纯水(B)和1%乙酸水溶液(C);流速:0.8 mL/min;进样量:10 μL;洗脱条件:0~45 min,20%~80% A,1%乙酸水溶液(C)始终保持10%;检测波长:325 nm;柱温:30 ℃。
1.3 数据处理
所有实验测定均重复3次,测定结果以平均值±标准偏差(Mean±SD)表示。采用SPSS 16.0统计软件对单因素实验数据进行单因素方差统计分析,用Design Expert 8.0软件对响应面实验数据进行分析。
2 结果与讨论
2.1 杜仲胶的分离
2.1.1 杜仲胶的分离对黄酮得率的影响 根据方法1.2.1进行实验,图1为杜仲胶的分离对杜仲黄酮得率的影响,由图1可知,杜仲叶的黄酮得率远远大于杜仲树皮黄酮得率,但无论树皮还是树叶,杜仲胶分离后的黄酮得率都大于未脱胶的黄酮得率。树皮中的杜仲胶含量大于树叶中的胶含量[24],由1.2.1.1中杜仲胶计算公式可得本实验所得杜仲树皮和树叶含胶量分别为5.0%±0.2%和1.9%±0.1%。杜仲胶分离前后对树皮黄酮得率的相对影响较大,黄酮得率相对提高50%左右(由0.5%升至1.0%),对树叶黄酮得率相对影响较小(由12.2%升至12.6%)。

图1 杜仲胶的分离对杜仲黄酮得率的影响Fig.1 Effects of gum separation on the extraction yield of flavonoids of E. ulmoides注:不同大、小写字母分别代表树皮和树叶脱胶前后的 黄酮得率的差异显著(p<0.01)。
2.1.2 杜仲胶分离时间对黄酮得率的影响 根据方法1.2.3.2进行实验,得到杜仲胶的最佳分离时间,结果如图2所示,分离时间在0~30 min范围内,随着分离时间的不断增加,杜仲黄酮得率也随之增高,但是当分离时间超过30 min时,杜仲黄酮得率基本保持不变,这是由于30 min可将杜仲胶分离完全,此时间后杜仲胶对黄酮的提取已不具影响,综合能耗考虑,因此,杜仲胶的分离时间选取30 min左右为宜。
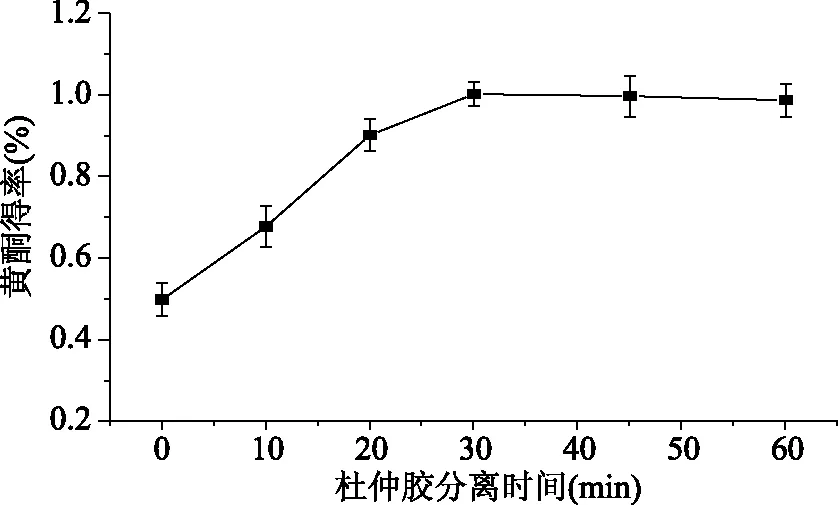
图2 杜仲胶分离时间对杜仲树皮黄酮得率的影响Fig.2 Effects of time of gum separation on the extraction yield of flavonoids of E. ulmoides
2.2 杜仲树皮及树叶黄酮类化合物的成分比较
由于杜仲树皮与树叶的黄酮类化合物得率差别甚大,图1显示脱胶后的树皮及树叶黄酮得率分别为1.0%和12.6%,为进一步说明杜仲树皮与树叶黄酮类化合物的区别,本文采用HPLC法对杜仲树皮及树叶黄酮类化合物的进行初步定性。由图3可知,通过与标准品的保留时间的比对,相同浓度下的杜仲树皮黄酮类化合物含量低于树叶提取物,尤其是芦丁、槲皮苷、槲皮素、山奈酚。树叶同样具有高于树皮的酚酸类化合物,如没食子酸、绿原酸、阿魏酸等,此结果揭示了杜仲树叶相比于树皮可作为黄酮类化合物及酚酸的较优提取原料。Zhou[25]等人的研究结果类似,杜仲树皮及树叶中的芦丁、槲皮素、山奈酚含量分别为0.0169、0.0036、0.0021、0.0644、0.0302、0.0100 mg/g。今后可以通过HPLC-MS/MS以及核磁共振(NMR)对杜仲黄酮类化合物进一步准确定性和定量。
2.3 杜仲黄酮提取条件的单因素实验
不同浓度乙醇溶液对杜仲黄酮得率的影响,结果如图4(A)所示,乙醇浓度在40%~60%的范围内,随着乙醇浓度的不断增加,杜仲黄酮得率也随之增高,但是当乙醇浓度超过60%时,杜仲黄酮得率反而迅速下降。

图4 单因素实验中各因素对杜仲叶黄酮得率的影响Fig.4 Effect of each factor on the extraction yield of the flavonoids from leaves of E. ulmoides by single factor experiment
图4(B)为不同乙醇浓度时紫外波长扫描图,由于黄酮类化合物的紫外光谱在220~400 nm通常有两个吸收带,处于300~400 nm的区域的吸收带称带I,220~280 nm为带Ⅱ[26],此紫外波长扫描图符合黄酮特征光谱,且由图4(B)可知,乙醇浓度为60%时,相比其它浓度的吸光度高,黄酮提取最充分。这是由于当乙醇浓度较低时,主要是以水为提取溶剂,此时水溶性杂质如一些多糖亦被溶解,使得黄酮得率并不高;随着乙醇浓度的增加,溶液极性逐渐减小,弱极性的黄酮类化合物在超声波与微波共同作用下能充分溶解,使得黄酮得率升高[27-28]。当乙醇浓度继续增大,水的比例降低,溶液极性变小,对微波能的吸收减弱,导致微波作用减弱,同时脂溶性成分如叶绿素会溶出,除此之外,高浓度的乙醇溶液亦会使植物细胞内的蛋白质凝固,众多因素都会使黄酮得率的降低[29-30]。综上所述,乙醇浓度为60%时为最适应的杜仲黄酮提取溶剂。
图4(C)为不同液料比对杜仲黄酮得率的影响,液料比在20∶1~60∶1 (mL∶g)的范围内时,杜仲的黄酮得率随着乙醇比例的增加而增加,但是,当液料比到达60∶1后,黄酮的得率却基本保持不变。因为液料比在提取黄酮类化合物过程中主要影响着传质推动力,即固体物料和提取溶剂之间的浓度差[30-31]。当液料比增加时,会提高传质推动力,当比例达到60∶1左右时,黄酮得率已达到最大,说明杜仲黄酮已被充分提取,继续增大的溶剂体积会给萃取瓶内造成压力,且增加能耗,杜仲黄酮提取的液料比为60∶1 (mL∶g)左右为宜。
图4(D)为不同提取温度对杜仲黄酮得率的影响,在50~80 ℃范围内,随着提取温度的升高,黄酮得率呈现先增大后减小的趋势,并在75 ℃时达到最高。这是由于在一定的温度范围内,随着温度的升高,分子运动变得更加剧烈,黄酮在提取溶剂中的溶解度增大,但温度过高可能会破坏黄酮的分子结构,同时一些非黄酮类物质的溶解性也可能增大,且升高温度亦可能凝固植物蛋白[30-31],导致黄酮溶出降低,从而降低黄酮得率,因此,杜仲黄酮的提取温度以75 ℃为宜。
图4(E)为不同微波功率在不同提取时间下对杜仲黄酮得率的影响,如图4(E)可知,400 W微波功率提取6 min时黄酮得率最高。杜仲的提取时间会影响提取溶剂与细胞内黄酮类物质接触的充分度,随着提取时间的增长,提取溶剂能够更加充分的渗透到细胞内部溶解黄酮。但是提取时间的继续增加,则会因为提取时间过长而导致细胞内温度过高,破坏了黄酮提取物中的有效成分,同时高温会凝固蛋白影响黄酮溶出。微波功率的增大会使原料吸收的微波能量增多,从而使黄酮更容易进去溶剂中,但微波功率过高同样会使得细胞内温度过高,导致黄酮得率降低[30-31]。因此,提取时选择微波功率400 W,提取时间6 min为宜。
通过SPSS法处理单因素实验数据(表3),通过比较p值和F值的大小,我们可以确定影响杜仲黄酮得率的各因素大小关系为:乙醇浓度>微波功率>提取温度>液料比>提取时间。其中,乙醇浓度、微波功率、提取温度、液料比这四个因素显著影响黄酮得率,而提取时间对黄酮得率的影响不显著。
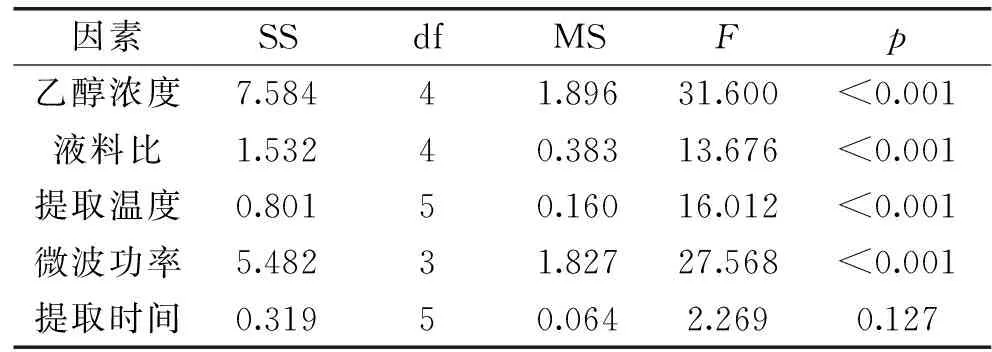
表3 单因素实验的方差分析结果Table 3 ANOVA results for single factor experiment
2.4 响应面法对UMAE法提取杜仲黄酮的工艺优化
2.4.1 响应面设计优化杜仲黄酮的提取 根据上述单因素实验得出的显著因素(乙醇浓度、微波功率、提取温度、液料比),设定提取时间6 min,按照Box-Behnken实验方法设计原理,利用响应面法,对杜仲黄酮的提取工艺进行优化,结果见表4。
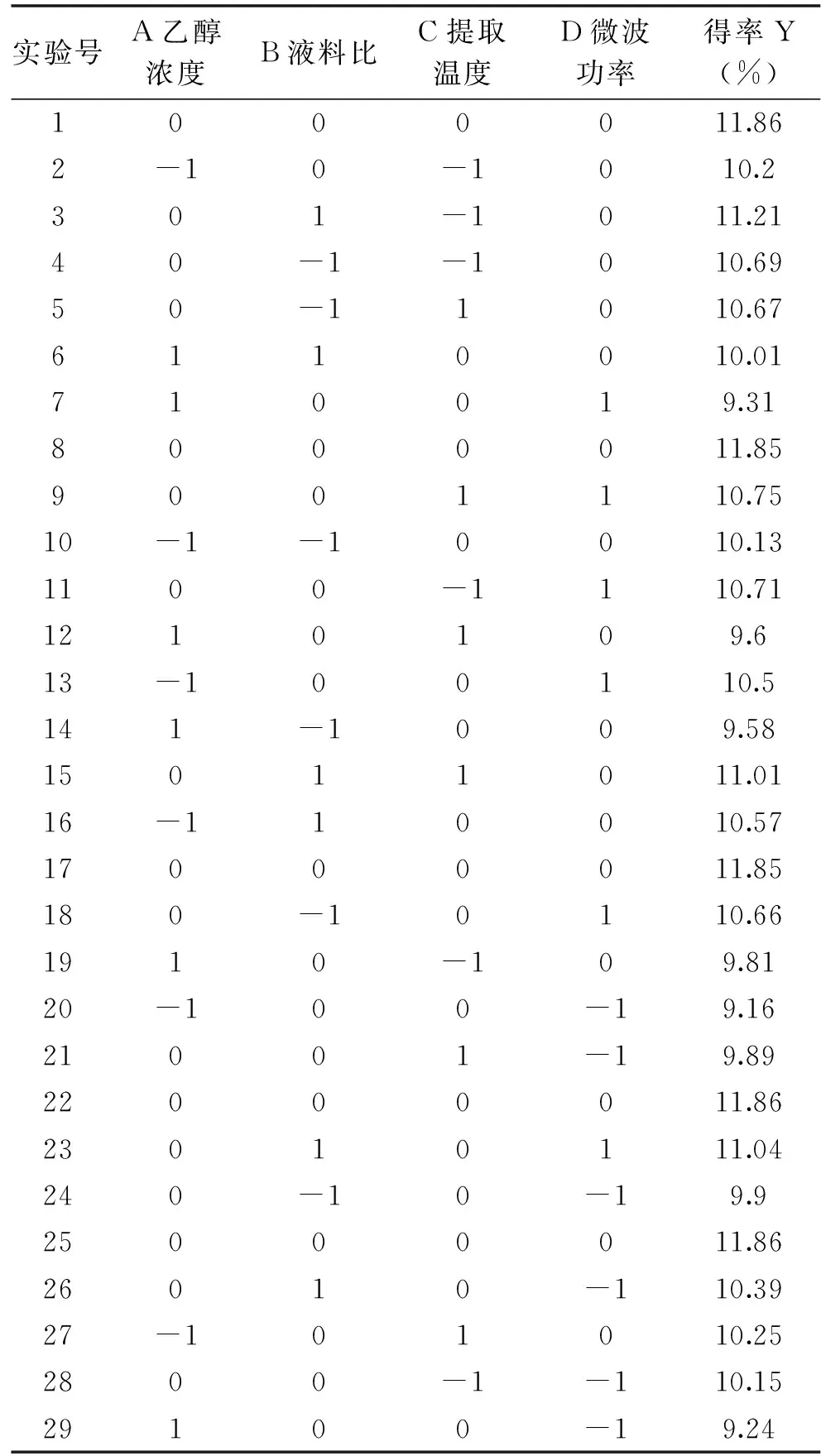
表4 杜仲叶黄酮提取的响应面实验设计及结果Table 4 Response surface design and results for the extraction of the flavonoids from leaves of E. ulmoides
2.4.2 二次回归方程拟合和方差分析 利用Design-Expert软件,对表4中实验数据进行多元回归拟合分析,获得以杜仲黄酮的得率Y为响应值,对自变量乙醇浓度A、液料比B、提取温度C和微波功率D四因素的回归方程为:得率Y(%)=11.86-0.27A+0.22B-0.050C+0.35D-2.5×10-3AB-0.065AC-0.32AD-0.045BC-0.028BD+0.075CD-1.36A2-0.42B2-0.54C2-0.94D2,回归模型的方差分析见表5。

表5 回归方程的方差分析结果表Table 5 ANOVA results for the regression model
2.4.3 响应面分析 响应曲面图是响应值即杜仲黄酮得率Y,对各个实验因素A、B、C、D所构成的三维空间曲面图形,从响应面图中,我们可以直观地看出各个实验因素对黄酮得率的影响及两两因素之间的交互作用对黄酮得率的影响。根据所得回归方程,以黄酮得率Y作为响应值,乙醇浓度、液料比、提取温度、微波功率四个因素两两交互作用对于杜仲黄酮得率的三围空间曲面图见图5。
如图5(A)所示,相较而言,乙醇浓度对黄酮得率的影响比液料比显著,在乙醇浓度与液料比的交互作用等高线中,乙醇浓度方向的等高线变化得更加密集。如图5(B)所示,乙醇浓度相较提取温度对杜仲黄酮的得率的影响更为显著,在乙醇浓度与提取温度的交互作用等高线中,乙醇浓度方向的等高线变化得更加密集。如图5(C)所示,乙醇浓度相较微波功率对杜仲黄酮得率的变化较为显著,在乙醇浓度和微波功率的交互作用等高线中,乙醇浓度等高线变化得更加密集。如图5(D)所示,提取温度相较液料比对黄酮得率的影响更显著,在液料比和提取温度的交互作用等高线中,提取温

图5 各因素交互作用对杜仲叶黄酮得率的响应曲面图和等高线图Fig.5 Response surface and contour plots for effects of interactions of various factors on the extraction yields of the flavonoids from leaves of E. ulmoides注:(A)乙醇浓度和液料比;(B)乙醇浓度和提取温度;(C)乙醇浓度和微波功率;(D)液料比和提取温度;(E)液料比和微波功率;(F)提取温度和微波功率。
度的等高线变化得更加密集。如图5(E)所示,微波功率相较液料比对黄酮得率的影响更显著,在微波功率和液料比的交互作用等高线中,微波功率等高线变化得更密集。如图5(F)所示,微波功率相较提取温度对黄酮得率的影响更显著,在微波功率和提取温度的交互作用等高线中,微波功率等高线变化得更加密集。通常情况下,等高线的形状可反映出交互效应的强弱,椭圆形表示两因素交互作用显著,若为圆形则与之相反,而肉眼观察不尽可靠,表5回归方差分析的结果中F值和P值可更确切地说明各因素交互作用显著与否。由表5可知,乙醇浓度与提取温度、乙醇浓度与微波功率、液料比与提取温度、液料比与微波功率、提取温度与微波功率之间交互作用显著。
2.4.4 最优条件验证实验 根据回归模型预测,杜仲黄酮最佳提取条件为:乙醇浓度57.54%,液料比70.13 (mL∶g),提取温度74.82 ℃,微波功率420.27 W,预测得率为11.94%。考虑实验条件的可操作性,修正所得UMAE法提取杜仲叶黄酮的最佳工艺参数为:乙醇浓度58%,液料比70∶1 (mL∶g),提取温度75 ℃,微波功率420 W。按照修正后的工艺条件进行三次平行验证实验,测得其得率为11.80%±0.09%,与预测值11.94%较为接近(相对误差为1.17%),验证了模型可靠。
2.5 UMAE、UAE、MAE三种提取方法的比较
为了说明超声波及微波在协同提取中所产生的作用,本文以杜仲黄酮得率及杜仲黄酮得DPPH自由基清除率为评价指标,将UMAE、UAE、MAE提取方式进行了比较,比较结果如图6所示,可以看出采用UMAE提取较UAE与MAE提取方式黄酮得率上升明显,UMAE提取方法所得的得率显著高于UAE和MAE的得率(p<0. 001),且黄酮的抗氧化能力(以清除DPPH自由基能力为例)亦有类似结果,UMAE提取法>UAE提取法>MAE提取法。由此可以得出,UMAE提取杜仲黄酮高效的原因是,超声波及微波两种方法进行优势互补、相互协同,进而提高得率。且本文所采取的协同方法提取杜仲黄酮,与前人利用超声波辅助提取杜仲皮中的杜仲胶和杜仲黄酮相比,可显著提高杜仲黄酮得率[19]。
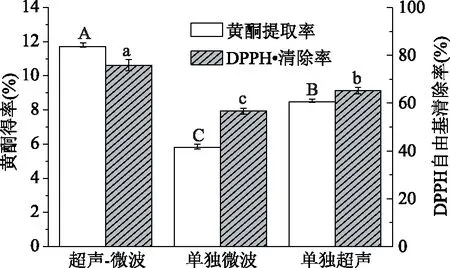
图6 超声-微波协同、单独超声和单独微波法 黄酮得率及DPPH自由基清除率的比较Fig.6 Comparison of the flavonoids from leaves of E. ulmoides by UMAE,UAE and MAE in terms of extraction yields and DPPH free radical scavenging ability
在比较黄酮得率及清除自由基能力的基础上,为进一步说明协同提取高效作用的原因及机理,本文采用扫描电镜(SEM)将不同提取方法提取前后的杜仲叶粉末进行微观结构的观察,其中提取前的杜仲叶粉末作为对照,提取后的粉末包括协同提取、单独微波和单独超声辅助提取后所得粉末残渣,结果如图7所示。由图7可见,相同的杜仲叶粉末分别经过UMAE、UAE、MAE作用后,与未经过提取的对照相比,组织结构均遭到不同程度的破坏。对照图7(A)较为完整,样品表面几乎没有孔洞。但是,经过UMAE作用后的植物细胞无法识别(图7(D)),相比图7(B和C),其微观结构破坏程度最为严重,产生很多孔洞以利于黄酮类化合物的快速溶出。这是由于细胞中的极性分子(H2O)作为吸能分子,以其高偶极矩剧烈吸收微波产生的热量,利用微波能来高效加热物料,导致细胞内部急剧升温和膨胀,从而导致细胞壁遭受严重破坏,有效成分迅速溶出[31]。同时,超声波可通过机械粉碎及撞击作用导致细胞壁破裂,进而产生空穴效应,产生强烈的冲击波,最终导致细胞内容物迅速通过破碎的细胞壁溶出[32],这同时也可以解释为何图7(C)单独超声法所形成的空穴比图7(B)单独微波法的空穴多。当微波与超声波同时协同作用时,可产生一系列剧烈反应使细胞内的黄酮类化合物更加迅速且充分地向外溶出。而单独微波或者单独超声辅助仅能受到上述一种效应的作用,无法同时接受超声波、微波的共同效应,最终使得协同提取方法的黄酮得率及抗氧化能力显著高于其他提取方法[12,33]。有研究表明,在比较超声-微波协同和水浴振荡提取牛蒡中多酚类化合物含量时,可从SEM电镜观察微观结构时得出相似结论[34]。
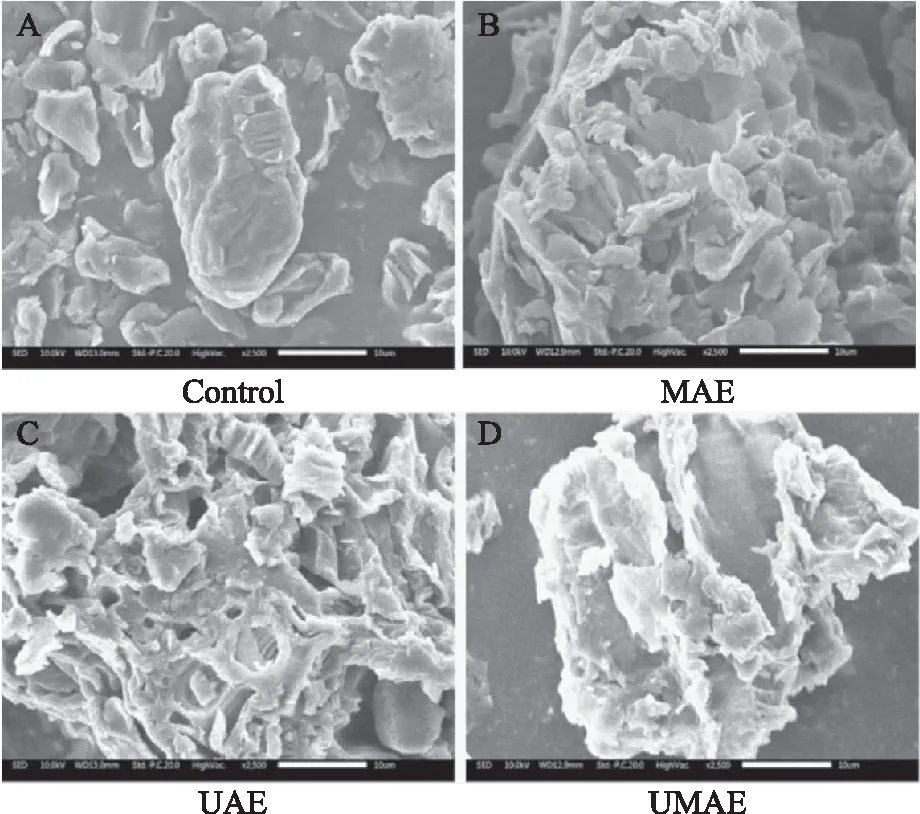
图7 杜仲叶粉末残渣扫描电镜照片Fig.7 Scanning electron microscope pictures of residual powders of E. ulmoides leaves注:(A)对照;(B);单独微波;(C)单独超声;(D)超声-微波协同提取;放大倍数均为2500倍。
3 结论
本文首先揭示了杜仲胶的分离对杜仲树皮和树叶黄酮提取的影响,且利用HPLC法比较了树皮和树叶的黄酮类化合物的主要成分,树叶中的黄酮类化合物如芦丁、槲皮素、山奈酚显著高于树皮中的含量,揭示了杜仲树叶相比于树皮可作为黄酮类化合物的较优提取原料。在单因素实验的基础之上,利用响应面法对杜仲黄酮的各个提取条件即乙醇浓度、提取温度、微波功率和液料比进行优化,优化后得到的杜仲黄酮最佳工艺条件为乙醇浓度为58%,液料比为70∶1 (mL∶g),温度为75 ℃,微波功率为420 W,时间为6 min,此条件下的粗黄酮得率为11.80%±0.09%。UMAE提取方法与MAE或UAE提取法相比较,其黄酮得率显著高于MAE和UAE(p<0.001),UMAE提取得到的杜仲黄酮清除DPPH自由基能力亦比较高。
