结合预处理方法的酶法 制备美藤果肽工艺的优化
2018-07-11梁钻好林凤英马晓伟
梁钻好,林凤英,黎 攀,马晓伟,杜 冰,*,沈 睿
(1.华南农业大学食品学院,广东广州 510642;2.无限极(中国)有限公司,广东广州 510627;3.广州市食品药品监督管理局食品监督执法分局,广东广州 510130)
美藤果,又被称为南美油藤(PlukenetiavolubilisLinneo)、印加果(Sachainchi)、星油藤,属大戟科多年生木质藤本植物,生长于海拔200~1500 m的南美洲安第斯山脉地区热带雨林[1]。其果实形状像星星,种仁可食用,富含油脂(45%~60%)和蛋白质(27%~30%)[2,3]。2009年引种中国云南。虽然美藤果是秘鲁、厄尔瓜多等地区的传统食物,但国内外关于美藤果的研究并不多。1992年Hamaker等[2]对美藤果基本成分、蛋白氨基酸和油脂脂肪酸组成进行了初步分析,此后直到近10年国外才开始陆续更新对美藤果的研究[3-7]。2013年美藤果油正式被批准为我国新资源食品,因此近5年国内学者围绕美藤果油展开了一系列基础研究[8-10]。但相比美藤果油,美藤果蛋白的受关注程度更低。据目前国外为数不多的研究报道显示,美藤果的蛋白含量仅次于大豆,由18种氨基酸组成,与公认为容易消化吸收的大豆蛋白对比,赖氨酸和亮氨酸含量偏低,但含硫氨基酸、酪氨酸、色氨酸和苏氨酸含量远高于大豆蛋白和其他油料作物,根据FAO/WHO/UNU评分模式属于优质植物蛋白[2,5]。另外,美国Foodnavigator的最新报道[11]显示,美藤果蛋白的PDAAC(蛋白质消化率校正氨基酸记分)为0.87(满分为1.0,乳清蛋白为1.0),是一种营养均衡、容易吸收的优质植物蛋白。2016年美藤果蛋白被批准为我国的新食品原料,因此在国内的研究报道更是屈指可数,但这种优质的美藤果蛋白必将引起广泛的关注[12]。
美藤果的开发目前主要停留在油脂方面,榨油后得到的果粕残渣含有约60%的高价蛋白质,可作为开发植物多肽的新原料。植物多肽因具有营养和调节机体生理功能的双重功效被广泛关注,如大豆多肽具有明显的抗疲劳、提高营养物质的吸收率[13]、抑制乳腺癌和前列腺细胞增殖[14]等多种特殊功效;花生多肽具有抗氧化[15]、抗高血压[16]的作用。由于植物中富含蛋白质的原料不多,一般以豆类多肽为主,但由于部分人对某些豆类过敏,推广受限。目前市场上的植物多肽产品以大豆多肽、燕麦多肽为主,产品品种单一,原料稀缺。而美藤果种仁的蛋白含量仅次于大豆,远高于燕麦,果粕中的蛋白质含量更是高达60%[17];再者,鉴于美藤果油的高不饱和性和高含油率,美藤果提油是以冷压榨方式提取的,果粕中的蛋白质质量未受到影响;另外,作为新食品原料,美藤果蛋白及其附加产品前景可观。因此,本文旨在利用美藤果粕开发高质量植物多肽,筛选合适的预处理方式提高水解效果,通过响应面实验优化酶法制肽工艺,并分析肽液分子量分布状况。一方面有助于开发深加工、高附加值的美藤果产品,实现原料的综合利用;另一方面可以加速我国肽产品市场的发展,前景可观。
1 材料与方法
1.1 材料与仪器
美藤果粕(低温压榨提取油脂后得到的果粕) 普洱联众生物资源开发有限公司提供;胃蛋白酶、碱性蛋白酶、木瓜蛋白酶、中性蛋白酶、胰蛋白酶、复合蛋白酶 广州市齐云生物技术有限公司;L-酪氨酸、甘氨酸(均为标准品,HPLC≥98%) 上海易蒙斯化工科技有限公司;十六烷基三甲基溴化胺(CTAB)、十二烷基硫酸钠(SDS)、吐温-80、甜菜碱、亚硫酸钠(均为食品级) 河北百味生物有限公司。
1260高效液相色谱仪 美国安捷伦公司;A300全自动氨基酸分析仪 德国曼默博尔;KQ-250TDV高频数控超声波清洗器 赛多利斯科学仪器;UV3010紫外可见分光光度计 日本日立有限公司;HH·S21-4恒温水浴锅 上海悦丰仪器仪表有限公司;PHS-3D PH计 上海精密科学仪器有限公司。
1.2 实验方法
1.2.1 美藤果粕基本成分分析 总蛋白(粗蛋白)测定:参照GB/T 5009.5-2016的凯氏定氮法;粗脂肪测定:参照GB/T 5009.6-2016的索氏抽提法;总糖测定:苯酚硫酸法;水分测定:参照GB/T 5009.3-2016的直接干燥法;灰分测定:参照GB/T 5009.4-2016的马弗炉法。
1.2.2 美藤果粕的脱脂处理 美藤果粕粉碎后按1∶6的料液比加入石油醚,60 ℃回流提取6 h,过滤,滤渣于60 ℃烘干除去剩余石油醚,粉碎,过100目筛备用。
1.2.3 酶解工艺流程 调料→预处理→调节pH→酶解处理→灭酶→测定水解度
1.2.4 蛋白酶种类的确定 选用胃蛋白酶、碱性蛋白酶、木瓜蛋白酶、中性蛋白酶、胰蛋白酶和复合蛋白酶对美藤果蛋白进行水解制肽。脱脂美藤果粕按1∶20的料水比调配,然后分别添加4000 U/g的蛋白酶,按各酶的最佳作用pH和温度酶解3 h,以蛋白水解度为指标,确定最优酶种。
1.2.5 蛋白质预处理方式的确定 固定反应条件为:料水比1∶20、预处理温度50 ℃、预处理时间15 min,考察添加Na2SO3(添加量:0、0.15%、0.25%、0.35%、0.45%)、添加表面活性剂(表面活性剂类别:十六烷基三甲基溴化铵(CTAB)、十二烷基硫酸钠(SDS)、吐温-80、甜菜碱,均按0.4%的浓度添加)及超声处理(超声频率:20、40、60、80 kHz)三种预处理方式对美藤果粕蛋白水解度的影响。然后调节pH(根据实验确定选用碱性蛋白酶,最适pH=9.0),加入4000 U/g蛋白酶,50 ℃下酶解3 h,85 ℃灭酶15 min,酶解液用于测定水解度。
1.2.6 美藤果蛋白的酶解
1.2.6.1 单因素实验 在最优的预处理方式(50 ℃,40 Hz超声15 min)下对美藤果粕进行预处理后,调节pH至9.0,采用酶解效果最佳的碱性蛋白酶对蛋白进行酶解,酶解结束后在85 ℃灭酶15 min,酶解液用于测定水解度。固定反应条件为加酶量4000 U/g、酶解温度50 ℃、酶解时间3 h,考察不同料水比(1∶5、1∶10、1∶15、1∶20、1∶25、1∶30)对美藤果蛋白水解度的影响;固定反应条件为料水比1∶20、酶解温度50 ℃、酶解时间3 h,考察碱性蛋白酶的不同加酶量(2000、4000、6000、8000、10000 U/g)对美藤果蛋白水解度的影响;固定反应条件为料水比1∶20、加酶量4000 U/g、酶解时间3 h,考察不同酶解温度(35、40、45、50、55、60、65 ℃)对美藤果蛋白水解度的影响;固定反应条件为料水比1∶20、加酶量4000 U/g、酶解温度50 ℃,考察不同酶解时间(1、2、3、4、5、6、7 h)对美藤果蛋白水解度的影响。进行单因素实验,考察各因素变量对美藤果蛋白水解度的影响。
1.2.6.2 响应面优化实验 根据Box-Behnken中心组合设计原理,在单因素实验的基础上,根据各因素对美藤果蛋白水解度的影响,选取3个主要影响因素作为自变量,以水解度为响应值,设计3因素3水平15个实验点的响应面分析实验,确定美藤果蛋白水解的最佳工艺条件,因素与水平设计见表1。
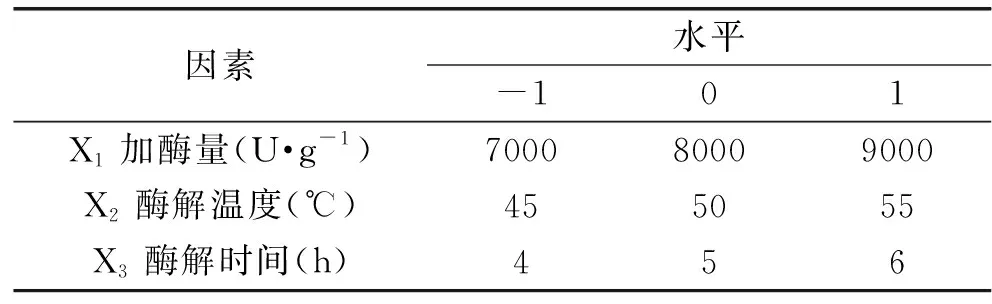
表1 因素水平表Table 1 Factors and levels used in response surface methodology
1.2.7 蛋白酶活力的测定 参照GB/T 23527-2009的福林法进行测定。
1.2.8 蛋白水解度的测定 水解度的测定采用茚三酮法[18]
式中:DH为蛋白水解度;H为水解断裂的肽键数目;Htot为总肽键数目(用全自动氨基酸测定仪测定)。
1.2.9 肽相对分子质量分布 参考GB/T 22492-2008附录A《大豆肽相对分子质量分布的测定方法》,采用高效凝胶过滤色谱法测定美藤果肽的相对分子质量分布情况,色谱柱为TSK G2000SWXL(5 μm,300 mm×7.8 mm)凝胶色谱柱。
1.3 数据分析
采用Design-expert V8.0.6进行响应面分析,SPSS Statistics 17.0作统计学分析。
2 结果与分析
2.1 美藤果粕基本成分分析
美藤果粕的基本组分及含量见表2。由表可知,美藤果粕的蛋白含量较高,可以用于开发植物多肽的重要原料。

表2 美藤果粕的基本成分Table 2 Basal component of Sacha inchi
2.2 酶种类对美藤果蛋白水解度的影响
蛋白的活性、最适反应条件和对美藤果蛋白的水解度如下表3。其中碱性蛋白酶对美藤果蛋白的水解能力显著(p<0.05)高于其他5种蛋白酶,各种蛋白酶水解能力次序为:碱性蛋白酶>木瓜蛋白酶、复合蛋白酶>胃蛋白酶、中性蛋白酶>胰蛋白酶。
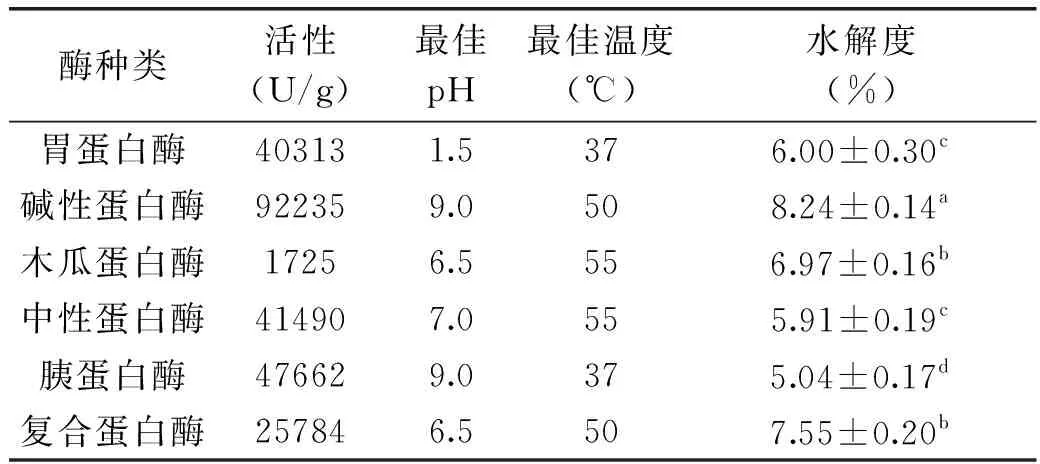
表3 蛋白酶活性、最适反应条件及水解效果Table 3 Protease activity,optimum reaction conditions and hydrolysis effect
碱性蛋白酶来自枯草杆菌[19],属内切蛋白酶,可裂解谷氨酸、赖氨酸、色氨酸、亮氨酸、蛋氨酸和谷氨酰胺酸羧端的肽键,且当N-端为疏水性氨基酸时裂解速度更快[20-21]。另外,相比中性和酸性溶液,美藤果蛋白在碱性溶液中具有更高的溶解度[22],因此在pH9.0的条件下用高活性的碱性蛋白酶作用,相比pH在中偏酸性条件下具有高活性的酸性(胃蛋白酶)和中性(木瓜蛋白酶、中性蛋白酶、复合蛋白酶)蛋白酶,美藤果蛋白的水解度较高。虽然胰蛋白酶的最适pH也是碱性,但胰蛋白酶是专一识别赖氨酸和精氨酸残基的肽链内切酶,而美藤果蛋白的氨基酸组成中赖氨酸是轻微缺乏的,这两种氨基酸只占美藤果蛋白的9.8%[2],因此同样在碱性条件下,胰蛋白酶对美藤果蛋白的水解能力较差。
2.3 预处理方式对美藤果蛋白水解度的影响
根据2.2酶种类的筛选,确定碱性蛋白酶为美藤果粕水解所用酶,以下实验均采用碱性蛋白酶进行酶解。
2.3.1 Na2SO3的添加对美藤果蛋白水解度的影响 在加热情况下,蛋白质球状结构展开,二硫键暴露,还原剂Na2SO3的加入可裂解二硫键,促进蛋白质水解[23]。如图1所示,相比对照组(Na2SO3添加量为0),少量Na2SO3的添加(0.25%)能使碱性蛋白酶对美藤果蛋白的水解度提高10%,但Na2SO3的增加对美藤果蛋白水解度影响不明显。
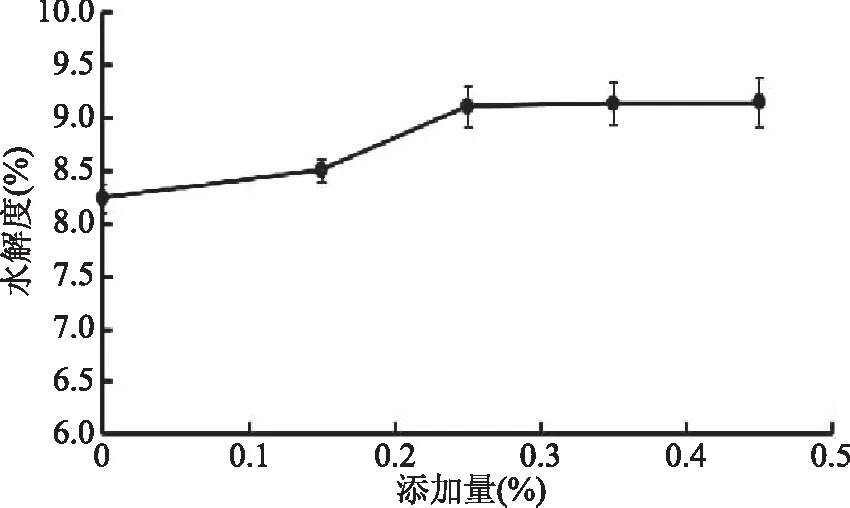
图1 亚硫酸钠添加量对美藤果蛋白水解度的影响Fig.1 Effect of sodium sulfite addition on degree of hydrolysis of Sacha inchi protein
在蛋白质功能性修饰的应用中,化学试剂Na2SO3被用于提高大豆蛋白的溶解性[24]。Liu等[23]的研究跟本论文研究结果一致,证实了加入Na2SO3可促进大豆蛋白的水解效果,在50~100 μmol/L Na2SO3的添加量中,氮酸和小分子肽含量均有显著增加,以100 μmol/L的浓度下,小分子肽含量增加最大。多肽之间是通过二硫键链接的,蛋白质之间也是通过二硫键聚合的,Na2SO3可裂解这些二硫键,从而促进蛋白质水解。基本上,蛋白酶能迅速作用于不溶性蛋白颗粒,把松散地结合在表面的多肽水解下来,但蛋白质内部更致密更核心的多肽水解较慢[25]。Liu等[23]研究还发现Na2SO3的加入使溶液中SH基团含量增加,即二硫键被裂解,进一步证实了Na2SO3是通过裂解二硫键加速水解蛋白质内部紧密连接的多肽的。
2.3.2 表面活性剂种类对美藤果蛋白水解度的影响 如图2,在4种表面活性剂中,只有阳离子表面活性剂CTAB能显著提高美藤果蛋白水解度,非离子表面活性剂吐温-80对水解度影响不大,阴离子表面活性剂SDS和两性表面活性剂甜菜碱的加入反而会降低美藤果蛋白的水解能力。

图2 表面活性剂对美藤果蛋白水解度的影响Fig.2 Effect of surfactants on degree of hydrolysis of Sacha inchi protein
酶属于蛋白质,表面活性剂的加入,可改变蛋白酶的二级结构(α螺旋、β折叠等),从而改变蛋白酶活力,或抑制或提高,这与表面活性剂的类型以及酶的种类有关[26]。CTAB和SDS对美藤果蛋白水解能力的截然相反的作用,可能的原因是阴离子和阳离子表面活性剂添加到酶解液中,分别与蛋白酶结合形成络合物,对蛋白酶结构产生影响,阳离子表面活性剂与碱性蛋白酶结合时激活了酶的活性,阴离子表面活性剂却抑制了酶的活性。非离子表面活性剂通常与酶的结合力较弱[26],杨庆利等[27]研究发现配制洗涤剂常用的非离子表面活性剂脂肪醇聚氧乙烯醚(AEO9)、烷基酚醚(TX-10)、甲基乙基醚(MEE)、吐温-80、烷基糖苷12-14(APG12-14)和椰子油脂肪酸二乙醇酰胺(6501)中,只有AEO9可显著增强液体蛋白酶活性,其他的非离子表面活性剂对液体蛋白酶活性影响不明显。本论文研究也发现吐温-80对碱性蛋白酶水解美藤果蛋白影响不大。但熊丹等[26]则有不同发现,他们认为在水分含量较低的情况下,吐温-80能显著提高胰酶催化牛血清白蛋白水解能力,但在高水分含量时,则没有明显影响。这进一步表明非离子表面活性剂对蛋白酶活力的影响与蛋白酶种类有关。
2.3.3 超声处理对美藤果蛋白水解度的影响 如图3,20 Hz超声处理15 min,美藤果蛋白水解度就由8.24%±0.14%提升到11.05%±0.15%,20~80 Hz的超声处理均能有效提高美藤果蛋白的水解能力,其中40 Hz的提高率最明显,达50%以上。

图3 超声处理对美藤果蛋白水解度的影响Fig.3 Effect of ultrasonic treatment on hydrolysis degree of Sacha inchi protein
酶解反应往往由于酶与底物位点接触频率低,导致反应时间延长或反应效率低。有许多研究表明,超声技术可提高酶解反应效率[28-29]。Zhou等[29]研究超声技术对中性蛋白酶和玉米谷物蛋白分子结构的影响,发现超声使蛋白质的紧密空间结构舒展开,部分残基暴露,与蛋白酶接触的机会增大,从而缩短酶解时间。丁青芝等[30]研究发现,用超声处理过的蛋白酶对菜籽蛋白进行酶解,或用蛋白酶酶解超声处理过的菜籽蛋白,或超声与酶解同时处理菜籽蛋白,3种处理方式与比常规酶解相比,均能明显提高酶解液的ACE抑制率,同时肽得率也显著提高,超声处理过程中,超声的空化作用会破坏蛋白原料和蛋白酶结构,一定频率的超声预处理后,美藤果蛋白结构会变得疏松,蛋白酶的作用位点暴露,有利于加速酶和美藤果蛋白底物的结合。但当超声频率过大时,美藤果蛋白结构被破坏程度加大,而且超声对蛋白质化学键的断裂缺乏选择性,从而导致蛋白水解度下降。丁青芝等[30]关于超声处理菜籽蛋白原料中超声功率对蛋白水解度的影响也有类似的结论。
2.4 酶解技术在美藤果肽制备中的应用
Na2SO3或表面活性剂处理对碱性蛋白酶水解美藤果蛋白的水解度最大提高率分别为11%和12.4%(图1和图2),而超声处理对美藤果蛋白水解度的最小提高率就已经有34.1%,最高可达50%以上(图3),即超声处理能更有效地提高碱性蛋白酶水解美藤果蛋白的能力。因此以下的酶解单因素实验和优化实验均先采用40 Hz超声处理15 min。
2.4.1 料水比对美藤果蛋白水解度的影响 如图4可见,随着水量增加,美藤果蛋白水解度也显著增加,当料水比增加到1∶15时,水量的变化对蛋白水解度影响不大。但当水量增加到一定程度,即1∶30时,蛋白水解度反而急剧下降,这与酶浓度的过度稀释有关。水量增加到一定程度,酶浓度被稀释,酶与底物接触的机率极大降低,水解能力下降。但图4中,料水比在1∶15~1∶25较大一个范围内变化时,水解度变化不显著,即在该范围内料水比对美藤果蛋白水解度的影响并不显著。因此最适料水比可在这个范围内变动。

图4 料水比对美藤果蛋白水解度的影响Fig.4 Effect of material water ratio on hydrolysis degree of Sacha inchi protein
2.4.2 加酶量对美藤果蛋白水解度的影响 加酶量对美藤果蛋白水解度如图5,低酶量时,酶量的增加促进蛋白水解度的急剧增加;当酶量增加到4000 U/g时,继续加大酶量,蛋白水解度增加幅度略有减少;当酶量翻倍达到8000 U/g时,蛋白水解度达到较大值,13.67%±0.18%,曲线趋于平缓。考虑到经济情况,最适加酶量选择为8000 U/g。

图5 加酶量对美藤果蛋白水解度的影响Fig.5 Effect of enzyme amount on hydrolysis degree of Sacha inchi protein
2.4.3 酶解温度对美藤果蛋白水解度的影响 蛋白水解过程中温度是一个重要的影响因素,温度过低,酶空间结构不能充分打开或暴露;温度过高,蛋白和酶都有可能会变性,导致水解度降低。图6可见,最佳酶解温度为50 ℃。
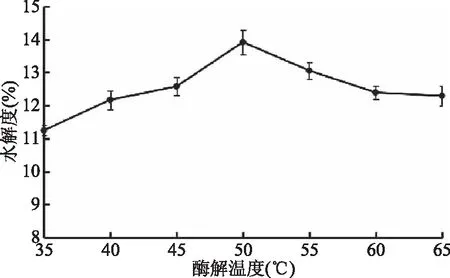
图6 酶解温度对美藤果蛋白水解度的影响Fig.6 Effect of enzymolysis temperature on hydrolysis degree of Sacha inchi protein
2.4.4 酶解时间对美藤果蛋白水解度的影响 从图7可知,酶解时间对美藤果蛋白水解度有显著的影响,1~5 h期间,蛋白水解度与酶解时间之间呈线性关系,而且该直线的斜率高达1.845,即酶解时间为1~5 h变化时,蛋白水解度的加速度为1.845 U/(g·h)。5 h的美藤果蛋白水解度几乎是1 h的2倍,此后增加酶解时间,水解度变化不大。因此,最佳酶解时间为5 h。
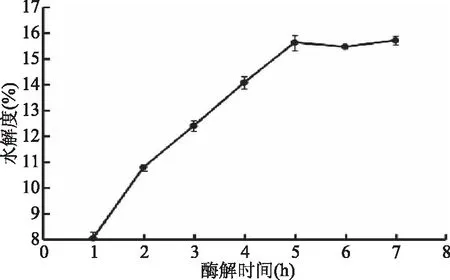
图7 酶解时间对美藤果蛋白水解度的影响Fig.7 Effect of enzymolysis time on hydrolysis degree of Sacha inchi protein
2.4.5 响应面优化实验 图4显示料水比为1∶15~1∶25时,美藤果蛋白水解度最高,但没有显著差异,即在该范围内料水比因素对水解度影响不大,因此只选取加酶量、酶解温度、酶解间3个影响因素作为自变量,以蛋白水解度为响应值,进行响应面优化实验,实验结果见表4。

表4 响应面设计与实验结果Table 4 Response surface design and experimental results
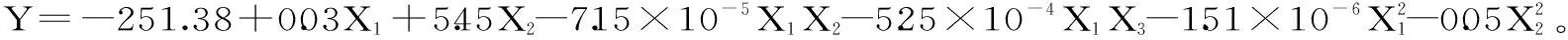
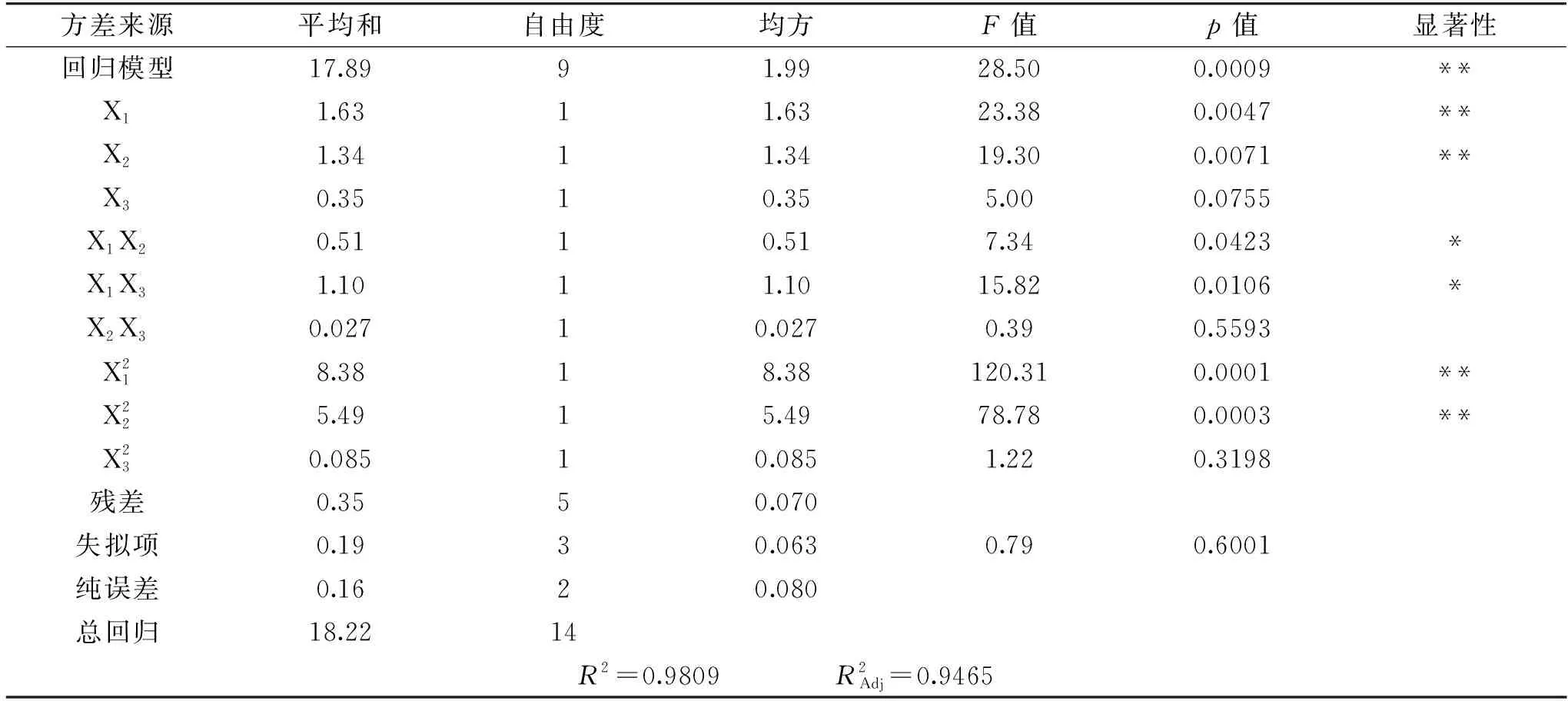
表5 回归方程模型方差分析Table 5 Regression equation model analysis
图8的响应曲面可较直观地了解美藤果蛋白酶解工艺中加酶量、酶解温度、酶解时间3个因素之间交互作用对蛋白水解度的影响。由三组图对比可知,加酶量和酶解时间对美藤果蛋白水解度的影响均较为显著,表现为图8B曲面最为陡峭。

图8 交互作用对蛋白水解度影响的响应曲面Fig.8 Response surface of interaction effects on proteolysis
由回归方程可知,美藤果肽酶解制备的最优工艺条件为:加酶量7646.07 U/g,酶解温度51.27 ℃,酶解时间6 h。在该条件下,美藤果蛋白水解度的理论值可高达18.06%。考虑到实际操作将其工艺条件优化为:加酶量7600 U/g,酶解温度52 ℃,酶解时间6 h。在此条件下进行验证实验,得到美藤果蛋白平均水解度为18.21%,与理论预测值相比相对误差仅为0.83%。因此,采用Box-Behnken设计优化得到的美藤果肽酶解制备工艺条件可靠,具有实用价值。优化后的超声辅助酶法制肽,其水解度相比Rosana Chirinos等[17]采用碱性蛋白酶提取美藤果粕蛋白得到的7.8%水解度要高得多。
2.5 肽分子量分布
美藤果粕经超声处理和碱性蛋白酶水解后得到的蛋白酶解液即为美藤果蛋白肽。通过测定分子量分布(表6),发现美藤果蛋白酶解得到的肽物质大多为分子量<1000 Da的寡肽(占94.64%),并有50%以上分布在180~500 Da之间,分子量在2000 Da以上的大分子多肽只占1.97%。这表明美藤果粕和水以1∶20的比例混合后在40 Hz下超声处理15 min,再用7600 U/g的碱性蛋白酶在52 ℃下酶解6 h的酶解效果较好,水解度高,得到的肽液分子量小而集中。
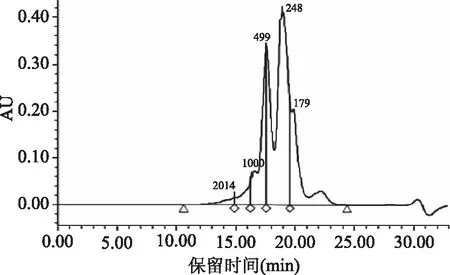
图9 美藤果多肽的色谱图Fig.9 Polypeptide chromatogram of Sacha inchi
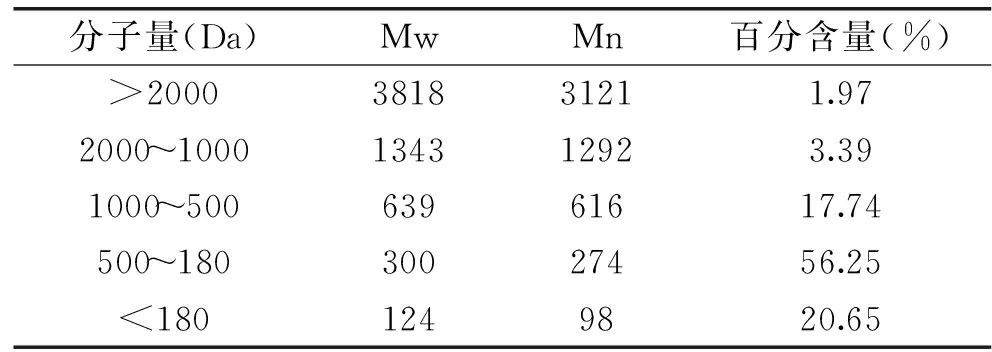
表6 美藤果肽的相对分子质量分布Table 6 Relative molecular weight distribution of Sacha inchi polypeptide
3 结论
本研究采用酶解技术对美藤果肽的制备条件进行优化,并测定制得的肽相对分子质量,得出如下结论:
各种蛋白酶对美藤果粕的水解能力次序为:碱性蛋白酶>木瓜蛋白酶、复合蛋白酶>胃蛋白酶、中性蛋白酶>胰蛋白酶,碱性蛋白酶最适宜用于美藤果肽的制备。
分别采用3种预处理方式:添加Na2SO3、添加表面活性剂、超声处理对酶法制备美藤果肽进行预处理。添加0.15%~0.45%的Na2SO3均能提高蛋白水解度,其中0.25%的添加量可使水解度提高10%;CTAB、SDS、吐温-80、甜菜碱四种表面活性剂中只有CTAB能显著提高美藤果蛋白水解度,提高率为12%;超声处理是三种预处理方式中提高蛋白水解度最明显最高效的方法,40 Hz超声处理可使蛋白水解度比单独酶解处理的提高50%以上。
超声辅助酶法制备美藤果肽最优工艺条件为:40 Hz超声处理美藤果粕15 min后添加7600 U/g碱性蛋白酶,52 ℃下酶解6 h,得到美藤果蛋白水解度为18.21%,肽液为相对分子量集中在<1000 Da的寡肽(占94.64%)。
预处理方式在食品加工中有重要应用,对原料进行适当的预处理可大幅提高有效成分的溶出或增进水解效果。美藤果粕作为提油后的残渣,富含优质蛋白质(约60%),开发成为新的植物多肽原料具有广泛的应用价值。而且美藤果果水解后得到的肽液主要为小分子肽,其功能特性和临床效果值得深入探究。
