苹果腐败霉菌的拮抗酵母菌 筛选鉴定及拮抗机理初探
2018-07-11刘程惠吴祎男胡文忠王艳颖田密霞
刘程惠,吴祎男,胡文忠,*,王艳颖,田密霞
(1.大连民族大学生命科学学院,辽宁大连 116600;2.辽宁省大连海洋渔业集团公司,辽宁大连 116113)
苹果颜色鲜艳、甜脆多汁且营养丰富,深受广大消费者的喜爱。2011年以来,我国的苹果产量持续增加,稳居世界第一,2016年总产量高达4350万吨[1]。但是苹果在采收和运输过程中,不可避免会受到机械损伤,且果实的水分和营养物质含量较高,腐败霉菌很容易通过伤口侵染果实,在贮藏过程中会发病,造成腐烂变质,严重降低了苹果的食用品质和商品价值,已成为妨碍我国苹果产业发展的主要障碍之一。苹果的常见采后侵染性病害有青霉病、链格孢烂果病、霉心病、黑星病等[2-3],引起这些病害的主要微生物为青霉菌(Penicilliumsp.)、链格孢菌(Alternariasp.)、灰霉(Botrytiscinerea)和曲霉(Aspergillussp.)、黑星菌(Venturiasp.)等,它们都是从碰、压、磕、刺伤或病虫害的部位侵入果实,引起苹果发病[4-7]。
利用拮抗酵母菌来防治果蔬采后病害属于生物防治范畴,与其它生防微生物相比,具有能有效利用贫乏营养快速增殖,能适应果蔬贮藏条件,可与化学物质配合使用,不产生抗菌素且遗传稳定等优点[8-9]。最早应用的拮抗酵母菌“Aspire”(Candidaoleophilastrain I-812)和“Yield Plus”(Cryptococcusalbidus)在美国已经商品化多年,主要用于控制苹果、梨等果实的青霉病和灰霉病[10],但是由于商业化条件下低效、市场渗透率低和公司维持和发展其商业化的财力不足等原因已经被撤回[11]。目前,虽然仍有一些拮抗酵母菌如Metschnikowiafructicola和Candidasake等在以色列、西班牙和德国等国家已经被商品化,然而在实践中,接受和广泛使用拮抗酵母菌作为生物防治产品仍然是有限的[11-12]。我国研究者从上世纪90年代开始研究拮抗菌防治果蔬采后病害,到目前为止虽然获得了一些对水果采后病害有明显抑制效果的拮抗酵母菌[13-15],但是在生防菌商业化生产方面却是一片空白,迄今为止还未见能替代化学杀菌剂的拮抗酵母菌产品问世。
本文主要研究从苹果表皮分离、纯化并筛选出对引起苹果腐败的P.expansum、A.alternata和A.niger有拮抗作用的酵母菌,并对可能涉及到的机理进行初步探索,旨在为苹果采后病害的生物防治技术发展和推动拮抗酵母菌的商业化应用提供一定的参考。
1 材料与方法
1.1 材料与仪器
富士苹果 产自于大连瓦房店,取大小均一、无病虫害、无损伤、完全成熟的果实;腐败霉菌:扩展青霉(P.expansum)、互隔交链格孢霉(A.alternata)和黑曲霉(A.niger) 保存在大连民族大学菌种保藏库中,用前进行活化并确定它们具有感染能力[16];含抗生素马铃薯琼脂培养基(PDA)、酵母浸出粉胨葡萄糖琼脂培养基(YPD)和酵母浸出粉胨葡萄糖培养基(YEPD)等生物试剂、吐温-80、明胶等试剂均为化学纯(CP) 北京奥博星生物技术有限责任公司;葡萄糖、无水乙醇等试剂 均为分析纯(AR),天津市科密欧化学试剂有限公司;溴甲酚紫、苯酚红等指示剂 北京化学试剂公司。
VS-1300 超净工作台 苏州市苏信净化设备厂;OLYMPUS BX51偏光显微镜 日本Olympus公司;S-4800扫描电子显微镜 日本Hitachi公司;E-1010喷金仪 日本Hitachi公司。
1.2 实验方法
1.2.1 酵母菌的分离、纯化 苹果用无菌刀削皮,将全部苹果皮切碎并混匀,称取25 g苹果皮样品,加入到225 mL无菌生理盐水中,无菌均质器拍打2 min,再梯度稀释为10-1~10-5菌稀释液。分别取0.1 mL各浓度的菌稀释液涂布于PDA平板上,28 ℃下培养48 h,挑取培养特征各异的单菌落进行平皿划线分离,重复接种3代后转接斜面。在转接斜面的同时制片做纯度检查,若不纯应进一步纯化。4 ℃保存纯化菌种,并为不同颜色和形态的菌编号。
1.2.2 拮抗酵母菌的筛选 将酵母菌接种在YPD固体培养基上划线活化,挑取单菌落于YEPD培养基中,28 ℃ 180 r/min-1振荡培养24 h,作种子液备用。参照Hao等人的方法[17],配制浓度为1×109CFU/mL的酵母菌悬液备用。将腐败霉菌制备成浓度为105个/mL的孢子悬浮液。参照Qin等人[18]的方法,将苹果用200 mg/kg的安替富民溶液浸泡10 min清洗消毒。无菌条件下,在其腰部刺4 mm深×4 mm宽的伤口。每个苹果4个伤口,空白(不接任何菌)、20 μL无菌水接种1个伤口,20 μL酵母菌接种2个伤口。2 h后,除空白外的其他3个伤口均接入20 μL腐败霉菌孢子悬浮液。将苹果分装到无菌保鲜盒中,用保鲜袋密封,28 ℃下,培养5 d。每天测病斑直径。每种酵母菌对于每种腐败霉菌重复10个苹果。
1.2.3 拮抗酵母菌的鉴定 参照《酵母菌的特征与鉴定手册》观察拮抗酵母菌的生长和形态特征,分别做糖发酵实验(测试糖类为葡萄糖、蔗糖和乳糖)、硝酸盐利用、类淀粉生成、重氮基兰和脲酶实验[19]。
拮抗酵母菌ITS通用引物由宝生物工程(大连)有限公司合成,进行序列测试,之后通过GenBank(http://www.ncbi.nlm.nih.gov)进行同源性搜索,与已报道真菌菌株的ITS 区序列进行同源性比较,最后通过MEGA6.0,Neighbor-joining法建立进化树。
1.2.4 拮抗酵母菌最佳拮抗浓度的筛选 将筛选出的拮抗酵母菌配制成浓度为107、108、109和1010CFU/mL的菌悬液,按照上述步骤1.2.2进行实验。
1.2.5 拮抗酵母菌生防机理的初步探究
1.2.5.1 牛津杯平板抑菌实验 参照刘佳等人的方法[20],略有改进,在PDA培养基平板一端的牛津杯中加入酵母菌悬液100 μL(对照用无菌水),另一端放置直径6 mm的腐败霉菌菌饼,25 ℃培养3~5 d,检测酵母菌周围产生的抑菌圈。
1.2.5.2 拮抗酵母菌对苹果腐败霉菌孢子萌发率和芽管长度的影响 参照闫岩[14]等人的方法观察测定苹果腐败霉菌的萌发数和萌发孢子的芽管长度。
1.2.5.3 拮抗酵母菌与腐败霉菌在苹果伤口处的相互作用 将按1.2.2接种过拮抗酵母菌和腐败霉菌的苹果伤口组织用刀片切取3 mm×5 mm×1 mm小块,样品在2.5%的戊二醛溶液中4 ℃固定过夜。连续7 d,每天取样。
固定的样品→蒸馏水清洗三次→乙醇梯度脱水处理→100%的乙醇处理两次→乙酸异戊酯处理→真空冷冻干燥→样品用导电硅胶固定在样品台上→喷金30 s→扫描电镜下进行观察、拍照[20]。
1.3 数据处理
使用SPSS Statistics 18软件进行差异显著性分析,利用Excel 2007软件进行数据处理和绘图。
2 结果与分析
2.1 苹果腐败霉菌的拮抗酵母菌筛选结果
从苹果中分离纯化得到13株酵母菌,编号为Y1~Y13。在第5 d,浓度为109CFU/mL的13种酵母菌拮抗腐败霉菌的结果如图1,其中Y0为无菌水代替酵母菌。接入拮抗酵母菌的苹果的病斑直径越小,说明抑制腐败霉菌的效果越好。对于扩展青霉,酵母菌Y1、Y4、Y9、Y12的防效较好;对于互隔交链格孢霉,酵母菌Y2、Y3、Y4、Y5、Y6、Y8、Y9、Y12和Y13的防效较好;对于黑曲霉,拮抗酵母菌Y1、Y2、Y4、Y5、Y6、Y8、Y9和Y13的防效较好。综合比较,Y4和Y9对三种腐败霉菌都有较好的防效。
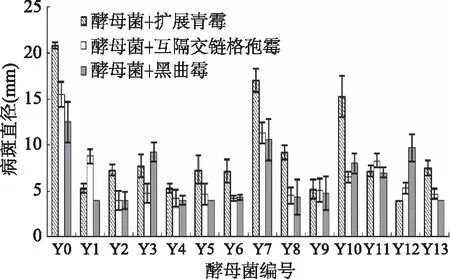
图1 浓度为109 CFU/mL的13种 酵母菌对腐败霉菌的拮抗效果Fig.1 Antagonistic effects of 13 kinds of yeast(109 CFU/mL)on spoilage molds of apples
2.2 酵母菌的鉴定结果
2.2.1 拮抗酵母菌的菌落形态 两种酵母菌的菌落形态如图2,酵母菌Y4菌落呈白色,大而湿润,表面有光泽,容易挑起,边缘光滑;酵母菌Y9菌落呈黑灰色,大而湿润,容易挑起,边缘光滑。通过镜检和生理生化实验初步鉴定酵母菌结果如表1。根据《酵母菌的特征与鉴定手册》,初步鉴定Y4为假丝酵母属(Candidaspp.);Y9为短梗霉属(Aureobasidiumspp.)。

表1 酵母菌的镜检和生理生化结果Table 1 Microscopy and physiological and biochemical results of yeast

图2 Y4和Y9在PDA培养基上的菌落形态Fig.2 Colony morphology of Y4 and Y9 on PDA
2.2.2 拮抗酵母菌Y4和Y9的ITS序列分析鉴定结果 对Y4和Y9的ITS基因片段进行扩增,PCR产物经1%琼脂糖凝胶电泳检测,Y4和Y9的ITS基因序列的特异性扩增条带分别为514 bp和576 bp。将测得的ITS 区序列通过GenBank(http://www.ncbi.nlm.nih.gov)进行同源性分析比较得出,Y4和Candidarailenensis的相似度为100%;Y9与Metschnikowiasp.和Aureobasidiumpullulans的相似度均为100%。用MEGA6.0进行序列比对,比对结果用 Neighbor-Joining法构建系统进化树,结果见图3。由系统发育树显示,Y4与C.railenensis位于同一分支,且进化距离最短;Y9与A.pullulans位于同一分支,且进化距离最短。结合Y4和Y9的菌落形态特征、生理生化和分子鉴定结果,确定Y4为C.railenensis,Y9为A.pullulans,其中A.pullulans是一种类酵母真菌,最终得到一种拮抗酵母菌C.railenensis。

图3 酵母菌Y4(a)和Y9(b)的ITS系统发育进化树Fig.3 Phylogenetic tree of yeast based on ITS sequence of Y4(a)and Y9(b)
2.3 酵母菌拮抗苹果的腐败霉菌最佳浓度筛选
图4可见,C.railenensis的浓度为108、109、1010CFU/mL时对扩展青霉、互格交链格孢霉和黑曲霉都有明显的拮抗作用,且菌液浓度为109、1010CFU/mL时防效较好。综上可见,C.railenensis的最佳浓度为109CFU/mL,对扩展青霉、互隔交链格孢霉和黑曲霉的抑制作用较好。

图4 不同浓度C. railenensis对苹果腐败霉菌的拮抗结果Fig.4 Antagonistic effects of different concentrations of C. railenensis on spoilage molds of apples注:a.扩展青霉,b.互隔交链格孢霉,c.黑曲霉;Y4(7)、Y4(8)、Y4(9)和Y4(10)分别代表酵母菌Y4的 浓度为107、108、109和1010 CFU/mL。
2.4 C. railenensis牛津杯平板抑制效果
牛津杯平板抑制实验结果显示,对照组对三种腐败霉菌均无抑菌圈,而浓度109CFU/mL的C.railenensis对扩展青霉、互隔交链格孢霉和黑曲霉的抑菌圈分别达到(10.3±1.3)、(13.5±2.1)和(10.1±1.2) mm,均有显著的抑制作用(p<0.05)。
2.5 拮抗酵母菌对苹果腐败霉菌孢子萌发和管芽生长的影响
由表2可知,对于扩展青霉,对照组24 h后的孢子萌发率和芽管长度分别为97.4%和60.0 μm,在有C.railenensis拮抗处理的情况下,24 h后P.expansum的孢子萌发率为5.0%,芽管长度为12.6 μm,显著低于对照组(p<0.05);对于互隔交链格孢霉,对照组24 h后的孢子萌发率和芽管长度分别为95.1%和53.4 μm,在有C.railenensis拮抗处理的情况下,24 h后A.alternata的孢子萌发率为5.9%,芽管长度为13.0 μm,显著低于对照组(p<0.05);对于黑曲霉,对照组24 h后的孢子萌发率和芽管长度分别为97.5%和73.5 μm,在有C.railenensis拮抗处理的情况下,24 h后A.niger的孢子萌发率为7.7%,芽管长度为17.1 μm,显著低于对照组(p<0.05)。
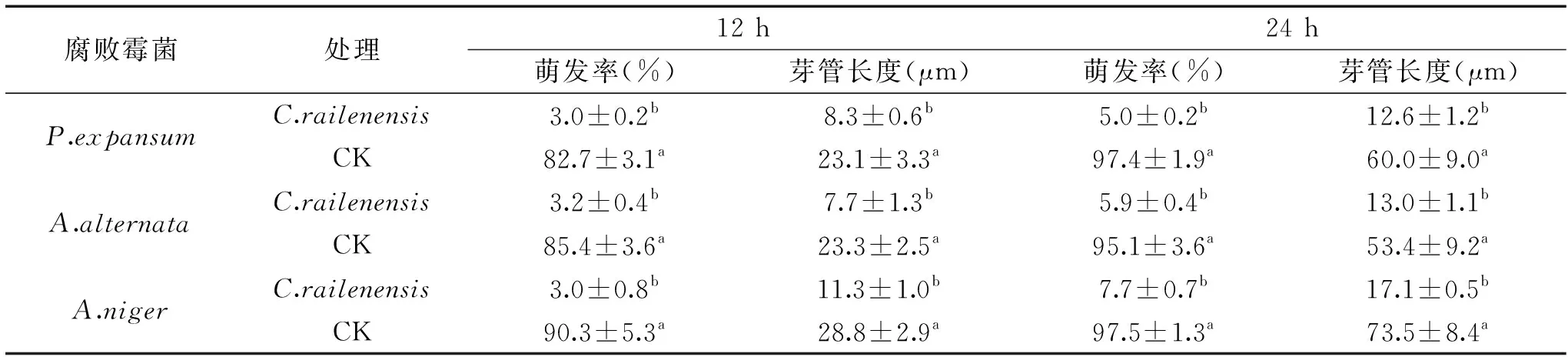
表2 C. railenensis对腐败霉菌孢子萌发率和芽管生长的影响Table 2 Effect of C. railenensis on the spore germination rate and germ tube growth of spoilage molds
2.6 拮抗酵母菌与腐败霉菌在苹果伤口处的相互作用
由图5a和5b,接种后第1 d,C.railenensis孢子利用苹果的营养多处出芽繁殖;接种后第3 d,在苹果伤口上大量繁殖,孢子的表面分泌产生一层丝网状物质,并且可观察到假菌丝。由图5c~5e,C.railenensis大量繁殖,包围并吸附扩展青霉、互隔交链格孢霉和黑曲霉的孢子。由图5f,接种第6 d后,扩展青霉长出菌丝体、分生孢子梗及大量分生孢子,但仍有大量C.railenensis可附着在菌丝体和分生孢子梗上。C.railenensis对互隔交链格孢霉和黑曲霉的拮抗效果较好,接种后第7 d,C.railenensis拮抗互隔交链格孢霉和黑曲霉的苹果表面仍未观察到互隔交链格孢霉和黑曲霉菌丝体。

图5 C. railenensis与苹果腐败霉菌的相互作用Fig.5 Interaction of C. railenensis and spoilage molds on apples注:图中所指为C. railenensis;图中所指为腐败霉菌;(a)为接种后第1 d;(b)为接种后第3 d;(c)~(e)C. railenensis 分别包围和附着扩展青霉、互隔交链格孢霉和黑曲霉的孢子;(f)接种后第6 d,C. railenensis吸附扩展青霉菌丝体。
3 讨论
近几年,已经证实一些拮抗酵母菌能够生物控制苹果采后在贮藏期间由霉菌侵染引起的病害。范青等发现Triehosporonsp.能够抑制苹果采后的灰霉和青霉病[22]。Haïssam综合分析比较Pichiaanomala在生产、活性机理、生态特性和实验效果等方面的优势,认定Pichiaanomalastrain K能够高效可靠地拮抗苹果采前和采后灰霉病和青霉病[23]。Calvo发现通过使用酵母混合物拮抗,增加拮抗菌用量也能提高生物防控苹果采后灰霉和青霉病的效果[24]。近几年,还有一些研究者用茉莉酸甲酯、甜菜碱等生物保鲜剂来增强拮抗酵母菌对苹果采后霉腐病的效果[25-26]。本研究从苹果中分离出对引起苹果病害的P.expansum、A.alternata和A.niger均具拮抗作用的拮抗酵母菌C.railenensis。有研究报道从橘叶中分离到的C.railenensis对导致橘子青霉病的主要腐败霉菌Penicilliumdigitatum有拮抗作用[27],并未对其拮抗机理进行进一步研究。目前还未见从苹果中分离得到C.railennsis的报道,本文首次对C.railennsis用于生物防控苹果多种采后病害和拮抗作用机理进行了研究报道。
通常认为营养与空间竞争是拮抗酵母菌的主要抑病机理,此外还可以通过与病原菌发生直接作用、分泌抑菌物质和诱导寄主对病原菌的抗性来抑制病原菌。本研究中C.railenensis的抑菌浓度较高,使其在与腐败霉菌的营养与空间竞争上具有群体优势,C.railenensis能够显著抑制三种腐败霉菌生长、孢子萌发和管芽生长。通过扫描电镜观察到C.railenensis通过包围和吸附扩展青霉、互隔交链格孢霉和黑曲霉的孢子,占据腐败霉菌的入侵位点,成为所处环境下的优势菌株,进而与它们竞争营养和空间,使得腐败霉菌因营养和空间不足而生长繁殖延缓,从而抑制腐败霉菌孢子的萌发及生长繁殖。C.railenensis还能够吸附P.expansum菌丝体与其直接作用。此外,C.railenensis孢子表面分泌产生一层丝网状粘状物质为生物膜,该生物膜有助于拮抗酵母菌孢子附着于与苹果组织、腐败霉菌孢子的接触面,推测其含有水解酶对苹果组织和腐败霉菌具有消解作用,并且孢子表面分泌的物质覆盖了聚集在一起的分生孢子表面,该物质还可能有助于它们之间生物信号的传导和营养物质的传输。C.railenensis表面分泌的物质含何种水解酶,以及它诱导苹果产生抗性的能力还有待进一步研究。可见C.railenensis生防效果的发挥是多种方式共同作用的综合结果。
4 结论
本实验分离鉴定得到一种拮抗酵母菌C.railenensis,它能够同时对引起苹果采后病害的P.expansum、A.alternata和A.niger具有拮抗作用。C.railenensis的最佳拮抗浓度为109CFU/mL,能够显著抑制(p<0.05)P.expansum、A.alternata和A.niger的菌丝生长、孢子萌发和芽管生长。
通过扫描电镜观察到C.railenensis接种后能够在苹果伤口处快速大量繁殖,孢子的表面分泌产生一层生物膜;C.railenensis的孢子能够包围和吸附P.expansum、A.alternata和A.niger的孢子,并且它还能够吸附P.expansum菌丝体与其直接作用。综合可见,C.railenensis主要是通过营养与空间竞争对三种腐败霉菌发挥拮抗作用,并且通过多种作用方式共同发挥生防效果。
