一株高产碱性磷酸酶菌株的 分离鉴定及其培养基配方优化
2018-07-11高俊乾黄俊元张君奇蔡佳佳亓正良
高俊乾,黄俊元,张君奇,蔡佳佳,亓正良,刘 浩
(天津科技大学生物工程学院,天津 300457)
碱性磷酸酶(Alkaline phosphatase,EC 3.1.3.1,简称AKP)是一类普遍存在于生物体内的非特异磷酸单酯酶[1],可以催化几乎所有磷酸单酯的水解反应,因其在碱性环境下最为有效,故得名碱性磷酸酶。碱性磷酸酶是一组同工酶,多为同源二聚体蛋白。碱性磷酸酶在生物体内可直接参与钙、磷的消化吸收分泌及骨化过程等[2],还可以用于免疫学酶联免疫吸附测定[3]和免疫印迹分析[4-5]、生物传感器识别元件的构建[6](如有机磷农药降解[7]、水体富营养化检测[8-9]、环境监测[10]、含磷有机物质的矿化过程[11]等)、非同位素探针[12]和斑点杂交[13]等方面。因此碱性磷酸酶具有较高的应用价值。
Remy Albrecht等[10]在绿色废物和污水污泥共堆肥中测定的碱性磷酸酶活力最高为1117 U;Adrianne NEdwards等[14]在Clostridium difficile中过表达phoZ基因,碱性磷酸酶酶活最高为4830 U;庄百川[15]在芽孢杆菌中测定得到碱性磷酸酶活性最高为2250 U。目前商品化的碱性磷酸酶主要来源于动物体或植物体,但其产率低、价格昂贵、活性差,使它的使用受到限制[15],因此筛选具有产量高、活性高的碱性磷酸酶微生物菌种显得尤为重要。
本文从土壤中筛选到一株高产碱性磷酸酶菌株,对影响其产碱性磷酸酶的主要因素碳源、氮源、无机盐及初始pH进行研究,在此基础上利用响应面设计优化产酶,从而为碱性磷酸酶生产提供了新的微生物资源,同时对该菌产碱性磷酸酶的工业化生产提供依据。
1 材料与方法
1.1 材料与仪器
土壤样品 天津大港海水养殖场附近;KOD plus聚合酶、PCR配套缓冲液 东洋纺(上海)生物科技有限公司;DNA相对分子质量标准品 北京全式金生物技术有限公司;片段回收试剂盒 天根生化科技(北京)有限公司;琼脂糖 Sunbiotech公司;硝酸盐还原试剂盒 青岛海博生物技术有限公司;革兰氏染色试剂盒 北京索来宝科技有限公司;其它试剂 均为分析纯。
产碱性磷酸酶筛选培养基(g/L):葡萄糖10,硫酸铵0.5,氯化钠0.3,氯化钾0.3,MgSO4·7H2O 0.3,FeSO4·7H2O 0.03,MnSO4·H2O 0.03,CaCl2·2H2O 5,卵磷脂0.2,pH7.2,琼脂粉20;碱性磷酸酶发酵培养基(g/L):葡萄糖10,硫酸铵0.5,氯化钠0.3,氯化钾0.3,MgSO4·7H2O 0.3,FeSO4·7H2O 0.03,MnSO4·H2O 0.03,CaCl2·2H2O 5,卵磷脂0.5,pH7.2;Modified Universal Buffer(MUB)(g/L)[16]:硼酸6.3,柠檬酸14.0,顺丁烯二酸11.6,三羟甲基氨基甲烷12.1,氢氧化钠19.52,pH11.0。
pH计 梅特勒-托利多仪器上海公司;双目生物显微镜 日本OLYPUS公司;5415R型小型冷冻离心机 德国Eppendorf公司;DH-4000B电热恒温培养箱 天津市泰斯特仪器有限公司;HNY-200B控温摇床 上海志诚设备厂;PTC-200型PCR仪 德国Eppendorf公司;ChampGel 5500 凝胶成像仪 北京赛智生物技术有限公司;UV-1800型紫外可见分光光度计 上海美谱达仪器有限公司。
1.2 实验方法
1.2.1 菌株初筛 将采集的土壤样品采用梯度稀释(10-3、10-4、10-5、10-6、10-7、10-8),分别取100 μL稀释样品涂布于产碱性磷酸酶筛选培养基[15],30 ℃培养7 d。每个梯度3平行,待平板长出单菌落后,测量透明圈直径D(mm)和菌落直径d(mm),计算D/d,挑选D/d值较大的菌株进行复筛。
1.2.2 菌株复筛 将初筛得到菌株接入碱性磷酸酶发酵培养基,在30 ℃,200 r/min条件下培养60 h,测定碱性磷酸酶活力,得酶活力最高的菌株,并编号进行后续研究。
1.2.3 磷酸酶活力测定 吸取1 mL发酵液,加入4 mL pH11.0的MUB缓冲液中,再加入0.025 mol/L对硝基苯磷酸二钠(PNPP)溶液1 mL后振荡,37 ℃反应1 h,加入0.5 mol/L氯化钙溶液1 mL和0.5 mol/L氢氧化钠溶液4 mL,振荡后4000 r/min离心10 min,取上清液在420 nm比色[17]。
标准曲线的制作:取6支比色管,依次吸取1 g/L标准对硝基酚溶液0、1、2、3、4、5 mL分别装于比色管中,用无菌水定容至5 mL。在每个比色管中再加入0.5 mol/L氯化钙溶液1 mL、0.5 mol/L氢氧化钠溶液4 mL,振荡后过滤或4000 r/min离心10 min,420 nm条件下测定吸光度。碱性磷酸酶活性以每分钟OD420增加0.001为一个酶活力单位(U)。
1.2.4 菌株菌落形态对比观察 将筛选得到的高产碱性磷酸酶菌株与其它产酶优势菌株点接在产酶固体培养基上,对高产碱性磷酸酶菌株形态进行对比观察。
1.2.5 生理生化鉴定 方法参照《常见细菌系统鉴定手册》[18]和《伯杰细菌鉴定手册》[19]。
1.2.6 分子生物学鉴定
1.2.6.1 引物的设计与合成 提取此菌株的总DNA,利用细菌16S rDNA通用引物进行PCR扩增,引物序列为Prime 935:5′-AGAGTTTGATCCTGGCTCAG-3′,Prime 936:5′-GGTTACCTTGTTACGACTT-3′。
1.2.6.2 PCR扩增 PCR反应体系为:10×PCR Buffer 2 μL,dNTPs(2 mmol/L)0.2 mmol/L,MgSO4(25 mmol/L)0.8 μL上游引物和下游引物各0.2 μmol/L,模板1 μg,KOD plus DNA聚合酶2 U,加无菌水至终体积为20 μL。
PCR反应条件为:94 ℃预变性2 min,94 ℃变性15 s,56 ℃退火30 s,68 ℃延伸1.5 min,反应35个循环,68 ℃后延伸10 min。1.0%琼脂糖凝胶电泳检测扩增产物。
1.2.6.3 系统发育树的构建 纯化上述基因克隆产物后,送北京华大基因公司测序。将测序结果在GenBanK核酸序列数据库进行序列比较,采用MEGA6软件进行同源性分析,构建系统发育树。
1.2.7 不同单因素对高产碱性磷酸酶菌株产酶活力的影响
1.2.7.1 不同碳源对高产碱性磷酸酶菌株产酶活力的影响 以产酶发酵培养基为对照,分别用10 g/L果糖、蔗糖、乳糖、木糖和麦芽糖代替碱性磷酸酶发酵培养基中的葡萄糖,30 ℃、200 r/min摇瓶发酵60 h,取其发酵液,分别测定其碱性磷酸酶活力。
1.2.7.2 不同氮源对高产碱性磷酸酶菌株产酶活力的影响 以产酶发酵培养基为对照,在无硫酸铵的碱性磷酸酶发酵培养基中分别加入0.5 g/L氯化铵、蛋白胨、酵母浸出物、尿素、玉米浆和乙酸铵等,培养条件同上,分别测定其碱性磷酸酶活力。
1.2.7.3 不同pH对高产碱性磷酸酶菌株产酶活力的影响 选择pH分别为4、5、6、7、8、9、10、11、12,培养条件同上,观察其生长并分别测定其碱性磷酸酶活力。
1.2.7.4 不同金属离子对高产碱性磷酸酶菌株产酶的影响 以产酶发酵培养基为对照,研究钙盐对产碱性磷酸活性影响时,在无氯化钙的碱性磷酸酶发酵培养基中分别加入5 g/L的碳酸钙和磷酸钙等;研究钠盐对产碱性磷酸活性影响时,在无氯化钠的碱性磷酸酶发酵培养基中分别加入0.3 g/L的碳酸钠、磷酸钠、硫酸钠和乙酸钠;研究钾盐对产碱性磷酸活性影响时,在无氯化钾的碱性磷酸酶发酵培养基中分别加入0.3 g/L的碳酸钾、磷酸钾、硫酸钾和乙酸钾等,培养方式同上,分别测定其碱性磷酸酶活力。
1.2.8 响应面实验[20-24]为了确定最优水平组合发酵培养基,利用中心组合实验方法进行响应面实验设计。本实验以果糖、尿素、pH和碳酸钙四个因素的不同梯度为响应变量,以碱性磷酸酶活性为响应值,实验因素水平设计见表1。
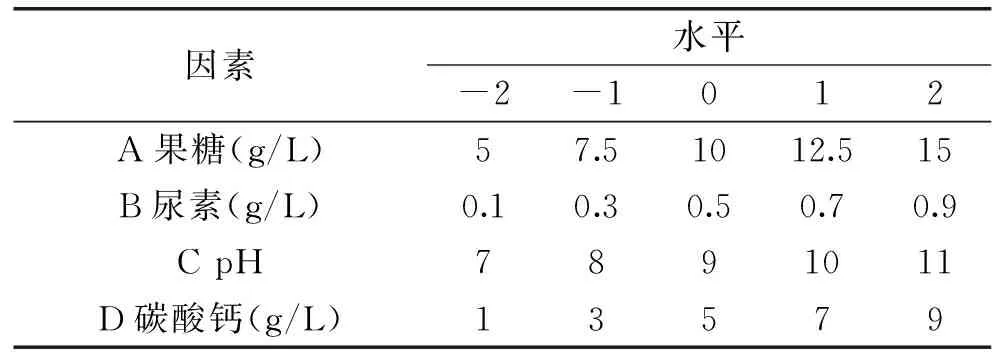
表1 实验因素水平设计表Table 1 Factors and levels in the combination design
1.3 数据处理
每个实验设置三个平行,利用MEGA6系统发育树分析,菌株复筛和单因素实验结果用orign 8.5作图,响应面结果采用Design-Expert 8分析。
2 结果与讨论
2.1 高产磷酸酶菌株的分离与筛选
利用初筛方法对土壤样品进行初步筛选,结果见表2。得到3株透明圈较好的菌株,即菌株S377-1、S377-10、S377-11,其D/d值分别为1.92、1.89和2.25。
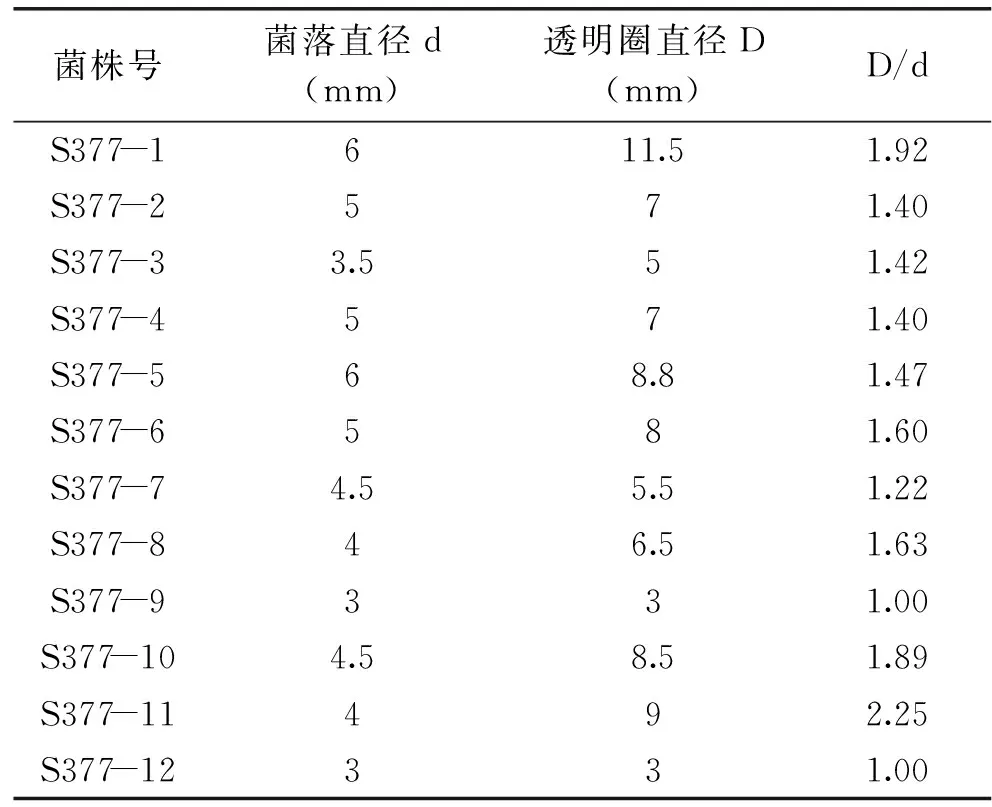
表2 产碱性磷酸酶菌株初筛结果Table 2 Screening results of alkaline phosphatase-producing bacterium
将初筛到的3株菌株进行酶活力测定,结果如图1所示。相对高产碱性磷酸酶的菌株为菌株S377-11,其酶活力达到(3900±25) U,将其编号为S377。
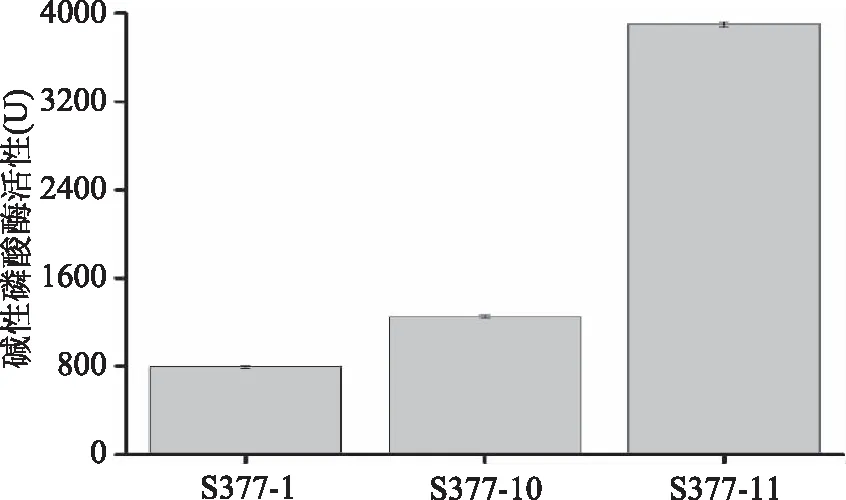
图1 菌株S377-1、S377-10和S377-11 产碱性磷酸酶酶活力的比较Fig.1 Comparison of alkaline phosphatase activity in strains of S377-1,S377-10 and S377-11
2.2 菌株的鉴定
2.2.1 菌株菌落形态对比观察 为更加直观突出菌株S377在产酶培养基上产酶优势采用菌株形态对比观察法,如图2。从图2可知,3株产酶优势菌在产酶培养基上均能较快生长,其中S377-10菌落最大,形成透明圈直径较大,但透明圈与菌落直径比值较小,且产生透明圈效果不显著;S377-1也可以水解产酶培养基上的有机磷,但产生透明圈效果较弱;S377菌落大小适中,产生透明圈较大,透明圈与菌落直径比值最大且产生透明圈效果显著。同时观察可知,S377在产酶培养基上菌落呈圆形,表面粗糙、凸起,菌体表面微黄色。
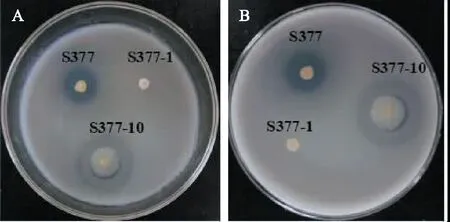
图2 产酶优势菌在产酶培养基上菌落形态观察Fig.2 The colonial morphology observation of enzyme production advantage bacterium on Enzyme production medium
2.2.2 生理生化鉴定 对菌株S377进行如下生理生化实验,如表3。从表3可知菌种S377能够利用D-葡萄糖、D-甘露醇、D-半乳糖、L-阿拉伯糖和木D-糖产酸,其代谢产物能够氧化乙醇和乙酸,能够在GYC培养基上生长并产生透明圈,这些均说明该菌能够产酸,但其氧化酶实验、接触酶实验、硝酸盐还原实验、明胶液化实验、革兰氏染色等均为阴性反应,说明S377可能是一株醋酸菌。

表3 S377菌株生理生化特性Table 3 Physical and biochemical characteristics of S377
2.2.3 分子生物学鉴定 提取S377菌株的基因组DNA。利用细菌16S rDNA通用引物进行扩增,获得一条约1.5 kb的DNA序列(图3)。
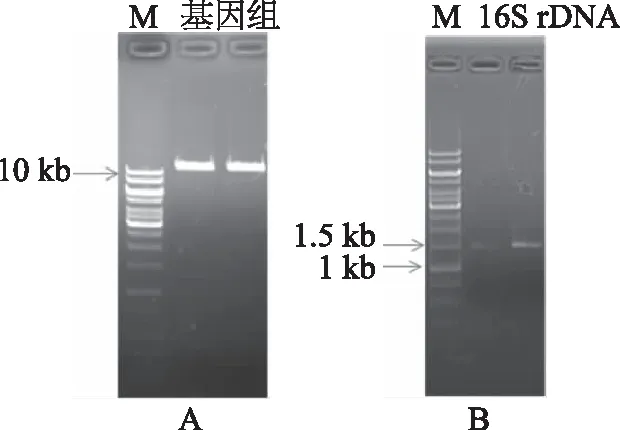
图3 菌株S377基因组及16S rDNAFig.3 Genomic DNA and 16S rDNA of S377注:M表示1 kb DNA标准品。
通过菌株S377的16S rDNA序列与数据库中的所有序列进行核苷酸同源性对比,构建16S rDNA序列相似性系统发育树如图4。由图4可知,菌株S377与醋杆菌奥尔兰亚种(Acetobacter orleanensis)同源性最高,同源性达到100%。因此,通过菌株菌落形态特征、生理生化特性及分子生物学等方面的鉴定,最终确定S377应归属于厚壁菌门(Firmicutes)、梭菌纲(Clostridium)、优杆菌科(Ubacterium)、醋酸杆菌属(Acetobacter sp.)、醋杆菌奥尔兰亚种(A.orleanensis)[25]。
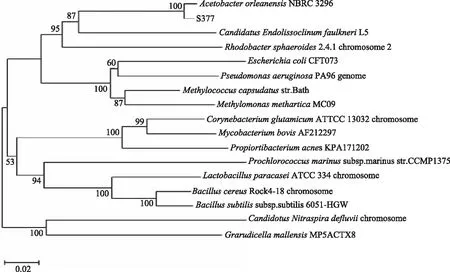
图4 菌株S377基于16S rDNA序列构建的系统发育树Fig.4 Phylogenetic tree for S377 based on 16S rDNA
2.3 不同环境因子对产酶活力的影响分析
2.3.1 碳源对产酶的影响 不同碳源对S377产碱性磷酸酶活力的影响结果如图5所示。从图5可知,以乳糖和木糖为碳源的发酵培养S377产碱性磷酸酶活性均低于对照组;以果糖、麦芽糖和蔗糖为碳源的发酵培养S377产碱性磷酸酶活性均高于对照组,其中以果糖为碳源的发酵培养基碱性磷酸活性最高,酶活力为(9100±130) U,大约是对照组的2.4倍。
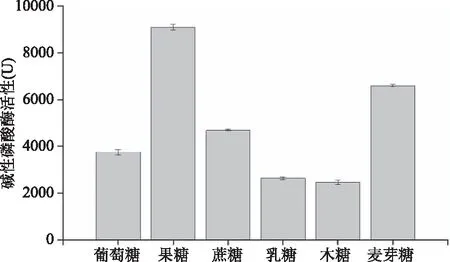
图5 碳源对菌株S377产碱性磷酸酶的影响Fig.5 Effect of carbon sources on the AKP production by strain S377
2.3.2 氮源对产酶的影响 不同氮源对S377产碱性磷酸酶活力的影响结果如图6所示。从图6可知,以氯化铵和酵母浸出物为氮源的发酵培养S377产碱性磷酸酶活性均低于对照组;以尿素、乙酸铵、玉米浆和蛋白胨为氮源的发酵培养S377产碱性磷酸酶活性均高于对照组,其中以尿素为氮源的发酵培养基碱性磷酸酶活性最高,酶活力为(12600±130) U,约为对照组的3.3倍。
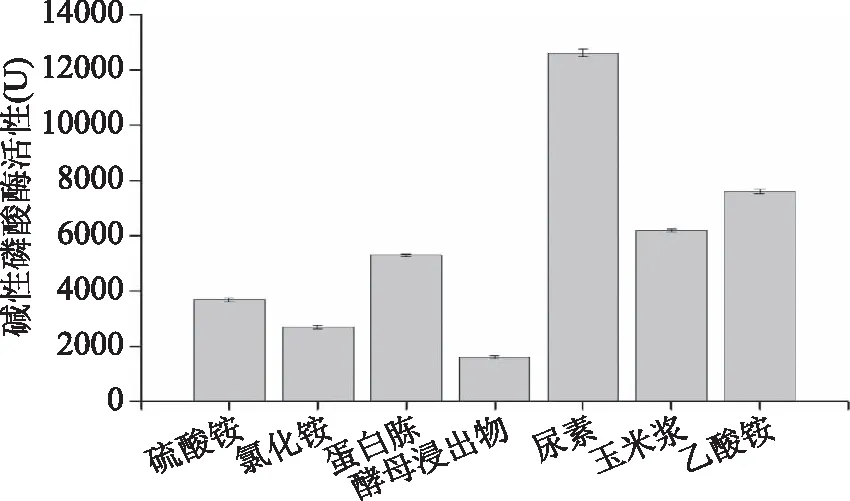
图6 氮源对菌株S377产碱性磷酸酶的影响Fig.6 Effect of nitrogen sources on the AKP production by strain S377
2.3.3 不同初始pH对产酶的影响 不同pH对S377产碱性磷酸酶活力的影响结果如图7所示。从图7可知,S377产碱性磷酸酶活力在碱性环境下相对较高,而在中性或酸性条件下酶活力相对较低,pH10酶活力达到(11800±195) U。一般来说,醋酸菌大多偏好酸性环境,而此菌株在碱性条件下也可正常生长,并分泌高活性的碱性磷酸酶,这有待做进一步的研究。
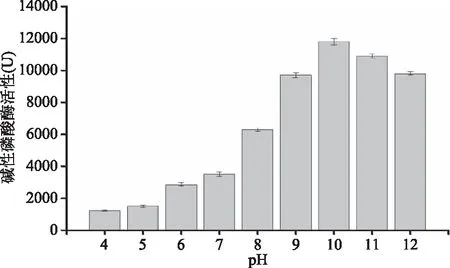
图7 起始pH对菌株S377产碱性磷酸酶的影响Fig.7 Effect of initial pH on the AKP production by strain S377
2.3.4 不同金属无机盐离子对产酶的影响
2.3.4.1 钙盐对产酶的影响 不同钙盐对S377产碱性磷酸酶活力的影响结果如图8所示。从图8中可以看出,与对照组相比磷酸钙对S377产碱性磷酸酶活力的影响不明显,而碳酸钙的影响则比较显著,当加入碳酸钙时酶活力达到(11200±132) U,约为是对照组的3倍。
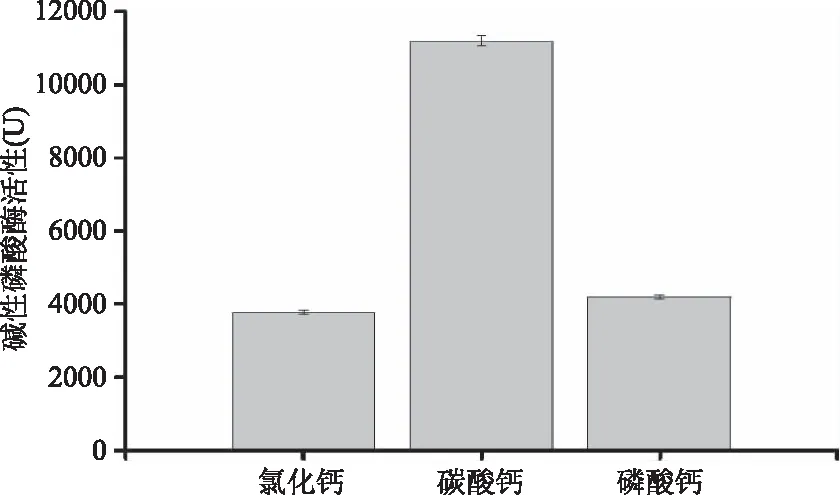
图8 不同钙盐对菌株S377产碱性磷酸酶的影响Fig.8 Effect of calcium salt on the AKP productionby strain S377
2.3.4.2 钠盐对产酶的影响 不同钠盐对S377产碱性磷酸酶活力的影响结果如图9所示。从图9中可以看出,磷酸钠、硫酸钠和乙酸钠对S377产碱性磷酸酶活力影响均低于对照组,仅碳酸钠高于对照组,其酶活力为(5190±129) U,约为是对照组的1.4倍。
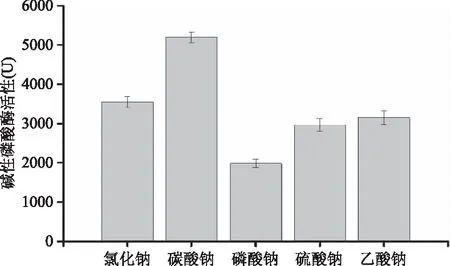
图9 不同钠盐对菌株S377产碱性磷酸酶的影响Fig.9 Effect of sodium salt on the AKP production by strain S377
2.3.4.3 钾盐对产酶的影响 不同钾盐对S377产碱性磷酸酶活力的影响结果如图10所示。从图10中可以看出,磷酸钾和硫酸钾对S377产碱性磷酸酶活力影响均低于对照组;碳酸钾和乙酸钾高于对照组,其中碳酸钾对产酶活力影响最高,酶活力为(6300±162) U,约为是对照组的1.6倍。
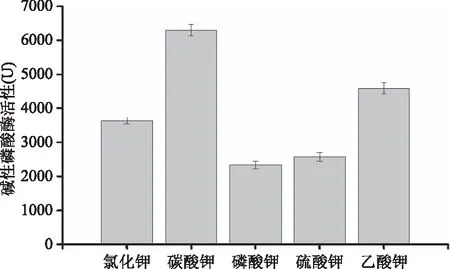
图10 不同钾盐对菌株S377产碱性磷酸酶的影响Fig.10 Effect of potassium salt on the AKP production by strain S377
从上述结果可以看出,钙盐、钠盐或钾盐,均是以碳酸钙、碳酸钠或碳酸钾为培养基成份时产碱性磷酸酶活力最高,这与其pH越高,其活性越高有关。碳酸根离子在发酵过程中有可能起到酸碱缓冲作用。东方醋酸杆菌在发酵过程中会产酸,而碳酸根离子在此过程中可以中和部分酸,使得发酵液中的酸碱环境保持的相对稳定的状态下,从而碱性磷酸酶酶活力相对较高。但其具体作用机制有待进一步的研究。
2.4 响应面实验的优化
总模型方差显著(p<0.001),相关系数R2=0.9281,表明模型相关度较好;模型的失拟项不显著(失拟项p值为0.0573>0.05),表明该模型精确度高,该模型的预测结果可以进行一定参考。各因素对S377碱性磷酸酶活力影响的次序为:尿素>pH>碳酸钙>果糖。
对所得数据进行多元回归分析,以碱性磷酸酶活力为Y,A为果糖,B为尿素,C为pH,D为碳酸钙。得到四个因素与碱性磷酸酶活力之间的模拟方程为:
Y=20333.33-925A-1941.67B-1837.5C-1200.83D-303.75AB+222.5AC+356.25AD+697.5BC+506.25BD-525CD-1200A2-2400B2-1462.5C2-2591.25D2
响应面图形是响应值对各实验因子A、B、C、D所构成的三维空间的曲面图,从响应面分析图上可形象地看出各因素之间的相互作用。根据回归方程得出不同因子的响应面分析图及相应等值线图结果见图11。由图11可较直观地看出各因素对碱性磷酸酶存在一定的交互作用,各响应值均有最优的极值点。通过Design-Expert 8软件进行系统优化分析,得到最大响应值的最佳配比条件为:果糖8.9 g/L,尿素0.4 g/L,pH9.2,碳酸钙4.5 g/L,碱性磷酸酶活力的预测值为28335 U。利用此最优培养基配方进行验证,在30 ℃,200 r/min摇瓶发酵60 h 碱性磷酸酶活性达到(28600±65) U。与预测值之间偏差较小,因此预测结果较为可信。
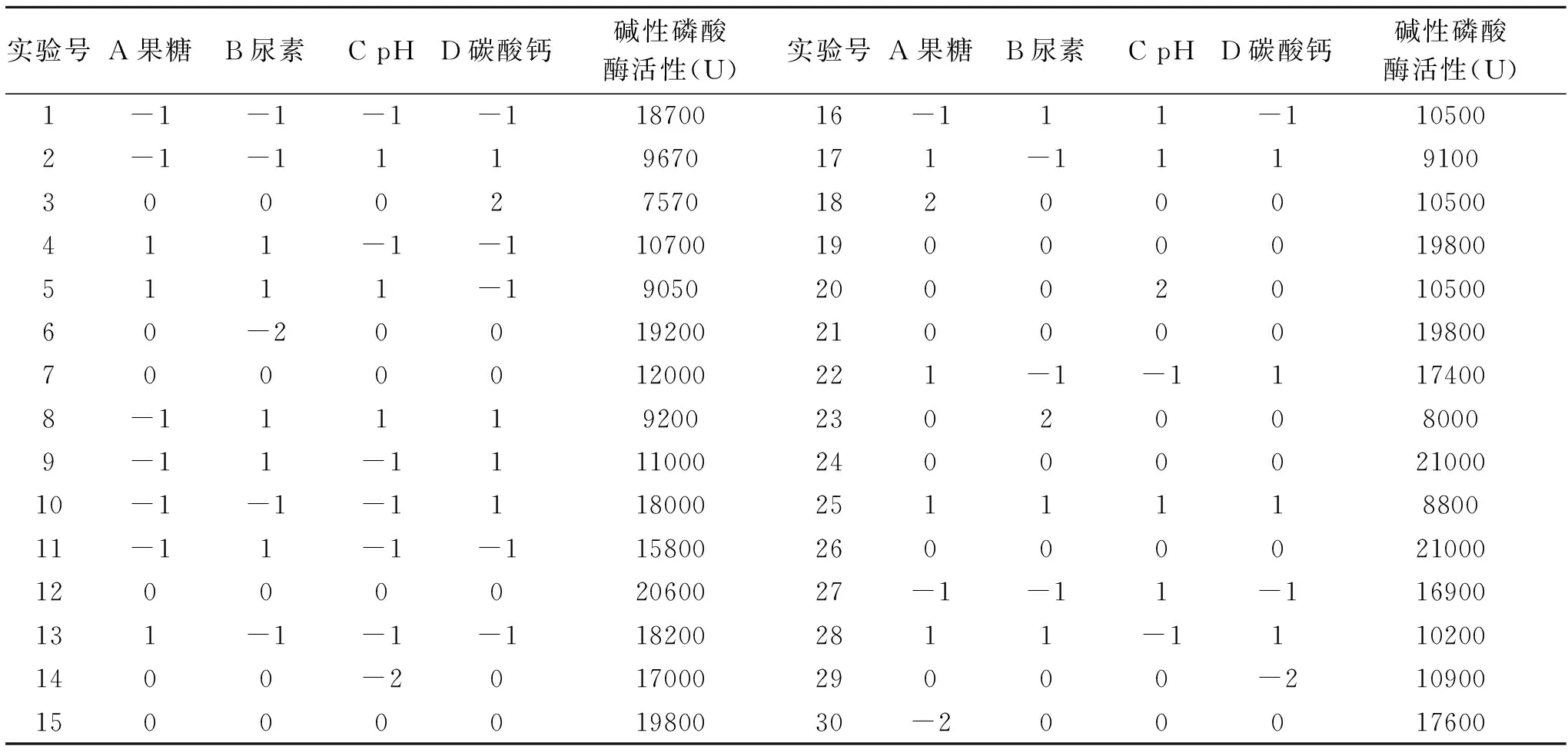
表4 响应面分析实验结果Table 4 Response surface analysis test results
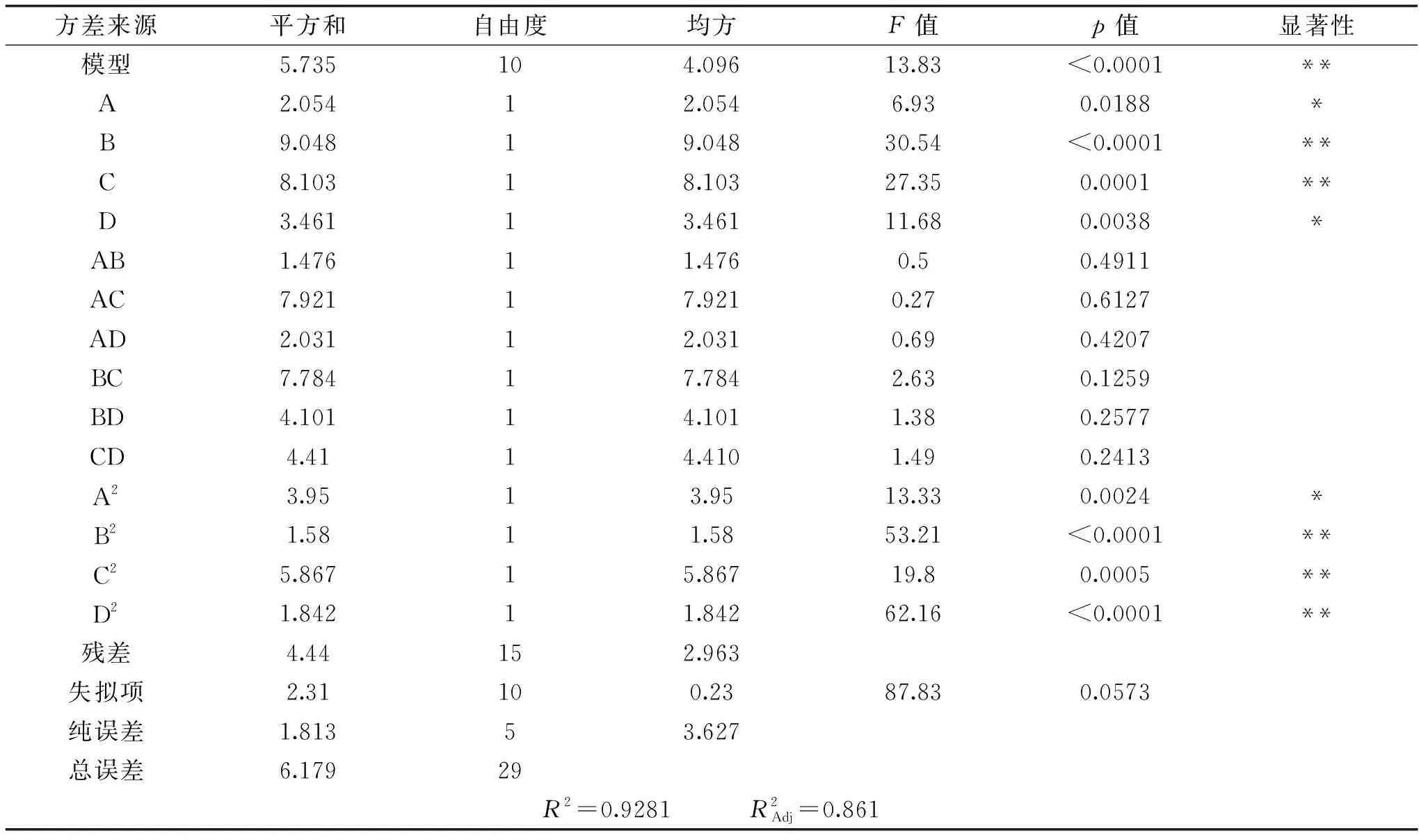
表5 以碱性磷酸酶活性为响应值的二次多项模型的方差分析Table 5 ANOVA for the quadratic model with alkaline phosphatase as response value
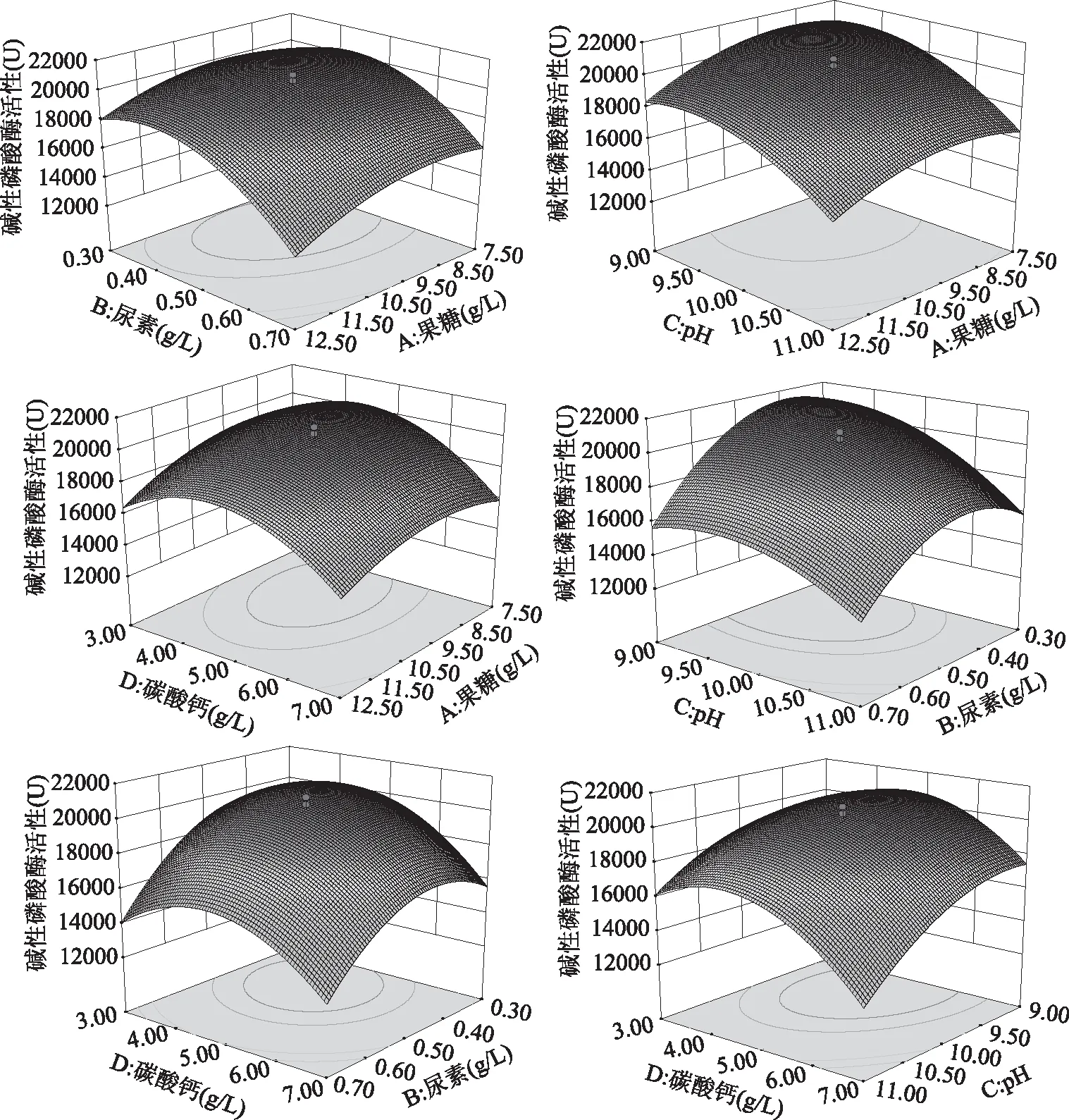
图11 各因素之间的等高线和响应面图Fig.11 The contour map and response graph between the various factors
3 结论
从土壤中筛选到一株高产碱性磷酸酶的菌株,经菌落形态对比观察、生理生化鉴定以及分子生物学鉴定,最终确定此菌株为醋杆菌奥尔兰亚种(A.orleanensis),编号S377。在单因素实验基础上通过响应面实验,发现果糖、尿素、碳酸钙及pH对S377碱性磷酸酶活力影响显著且相互之间存在一定交互作用,产碱性磷酸酶的影响次序为尿素>pH>碳酸钙>果糖。通过系统优化分析得到最佳发酵条件为:果糖(8.9 g/L)、尿素(0.4 g/L)、碳酸钙(4.5 g/L)、pH(9.2),且在最优条件下碱性磷酸酶活力达到(28600±65) U。
