不同花色苷代表性成分的 分离鉴定及体外抗氧化活性的研究
2018-07-11吕晓玲王璐瑶王艳丽王建新郑满荣
高 品,吕晓玲,王璐瑶,王艳丽,王建新,郑满荣
(天津科技大学食品工程与生物技术学院,天津 300457)
花青素类物质为重要的水溶性植物色素,属于酚类化合物中的类黄酮,广泛存在于植物的根、茎、叶、花和果实中。花色苷类色素对大量植物及其制品的色泽起着主要作用,并且具有抗氧化、抗炎、调节血脂、改善胰岛素抵抗[1]、抗突变及抗肿瘤等生物活性[2]。因此,国内外各种植物花色苷提取物被广泛作为食用色素和功能性配料用于食品和保健食品[3]。但由于花色苷多以混合物存在,不同来源的提取物中花色苷的组成差异较大,对其选择性的应用造成一定限制[4]。
由于植物花色苷的不稳定性及含量相对较低,传统分离花色苷多为硅胶柱色谱、凝胶色谱、纸色谱、C18反相色谱等方法[5],存在制备量小、重现性差等缺点,难以获得大量高纯度花色苷,是进一步研究的瓶颈。高速逆流色谱(HSCCC)是一种不使用吸附剂的液-液分配色谱技术,具有高效、稳定、制备量大的特点,被广泛用于天然活性成分的制备分离,也成功用于葡萄皮[6]、紫甘蓝等植物中的花色苷分离和制备[7]。本文采用高速逆流色谱分离不同来源花色苷的代表性单体化合物,并比较了其体外抗氧化活性,为花色苷提取物的产品质量控制及应用提供参考依据。
1 材料与方法
1.1 材料与设备
紫甘薯花色苷(花色苷含量18.53%) 葫芦岛茂华生物有限责任公司;黑加仑花色苷(花色苷含量28.73%),桑葚花色苷(花色苷含量25.70%) 天津市尖峰天然产物研究开发有限公司;黑枸杞花色苷 根据文献[8]提取纯化,测得花色苷含量14.62%;乙腈:色谱纯,甲基叔丁基醚,正丁醇:分析纯;超纯水 Milli-Q超纯水机制得。
LC-20高效液相色谱仪 日本岛津公司;高速逆流色谱仪TBE300C 上海同田生物技术股份有限公司;离子阱飞行时间质谱(LCMS-IT-TOF) 日本岛津公司;半制备高效液相色谱仪 日本岛津公司;MODULYOD-230 冷冻干燥机 美国Thermo Fisher Scientific;UV-2101 PCS 紫外可见分光光度计 尤尼柯(上海)仪器有限公司。
1.2 实验方法
1.2.1 HPLC分析条件 ZORBAX SB-C18柱(4.6 mm×250 mm,5 μm);紫甘薯花色苷和黑枸杞花色苷液相分析条件在陆英[9]等人的条件下经过优化设为:流动相:A:0.2%磷酸水,B:乙腈,二元梯度洗脱:0~30 min,15%~25% B;黑加仑花色苷与桑葚花色苷的液相分析条件在邹堂斌[10]等人的条件下经过优化设为:流动相:A:10%甲酸水,B:乙腈,二元梯度洗脱:0 min 5% B,15 min 15% B,21 min 28% B,22 min 40% B,24 min 60% B,27 min 5% B,30 min 5% B;流速1 mL/min,柱温30 ℃。
1.2.2 HSCCC溶剂体系的选择 在50 mL离心管里将不同溶剂按比例配置上下相,充分混合后分层,分别取4 mL上相和下相,分别装入另外两个干净的10 mL离心管中。将少量的花青素粗提物加入下相,溶解后取1 mL,用HPLC检测,记为C1。在剩余的含有花青素的下相中加入3 mL的上相。充分混合后再取1 mL下相,用HPLC检测,含量记为C2。
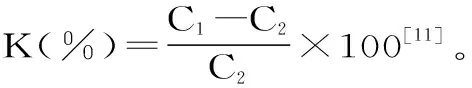
根据K值选择合适的溶剂体系作为HSCCC的固定相和流动相。
1.2.3 HSCCC制备分离花色苷单体 按照甲基叔丁基醚∶正丁醇∶乙腈∶水∶三氟乙酸(V/V,紫甘薯花色苷:2∶5∶1∶6∶0.01,黑枸杞花色苷:2.5∶1.5∶1∶5∶0.01,黑加仑花色苷和桑葚花色苷:2∶2∶1∶5∶0.01)配置溶剂体系,置于分液漏斗中,充分振荡2~3次,静置至上下相分层明显,将上相作为固定相,下相作为流动相,超声脱气30 min备用。将固定相以30 mL/min的流速泵入HSCCC管路中,待固定相充满管路后,以850 r/min正接正转,将流动相以5 mL/min的流速泵入,检测波长520 nm,待有下相流出一段时间后体系达到平衡,将200 mg样品以15 mL下相溶解后进样,根据HSCCC色谱图对出峰位置进行收集,获得高纯度花色苷单体。
1.2.4 质谱条件 采用电喷雾离子源ESI;正离子扫描模式;干燥气温度350 ℃;氮气流速 1.5 L/min;干燥器压力133.0 KPa;喷射电压:4 KV;扫描一级质谱和二级质谱。
1.2.5 体外抗氧化性的研究
1.2.5.1 DPPH自由基清除能力的测定 参考文献中的方法[12],分别向试管中加入2.0 mL 0.1 mmol/mL的DPPH乙醇溶液及2.0 mL的不同浓度的花色苷溶液,混匀,室温下避光放置30 min后于517 nm波长处测定混合物的吸光度。
清除率SD(%)=[1-(Ai-Aj)/Ac]×100
其中:Ac:2 mL DPPH加2 mL无水乙醇;Aj:2 mL无水乙醇加2 mL待测液;Ai:2 mL DPPH加2 mL待测液。
1.2.5.2 总还原力的测定 参考Bae的方法[13],于试管中加入1.0 mL样品溶液,1.0 mL磷酸钠缓冲液(0.2 M,pH6.6)和1%铁氰化钾溶液1.0 mL,充分混合。50 ℃恒温水浴20 min后,加入10%三氯乙酸溶液1.0 mL,摇匀,取2.5 mL上层清液用2.5 mL水稀释一倍,加入0.1%氯化铁溶液0.5 mL,静置10 min,测定混合液在700 nm处吸光值。还原力表示成混合液在700 nm处的吸光值。
1.2.5.3 羟自由基清除能力的测定 按照Smirnoff的方法[14],反应体系中含8.8 mmol/L H2O21 mL,10 mmol/L FeSO41 mL,10 mmol/L水杨酸-乙醇1 mL,分别加入不同浓度花色苷溶液1 mL。最后加H2O2启动反应,37 ℃反应0.5 h,以蒸馏水作参比,在510 nm下测定各浓度的吸光度。考虑花色苷本身的吸光值,以10 mmol/L FeSO41 mL,10 mmol/L水杨酸-乙醇1 mL,不同浓度花色苷溶液1 mL和1 mL蒸馏水作为花色苷空白。
清除率计算公式:
清除率(%)=[A0-(A1-A2)]/A0×100
其中:A0为对照液的吸光度;A1为加入花色苷溶液后的吸光度;A2为不加显色剂H2O2花色苷溶液的吸光度。
1.3 数据分析
实验结果采用SPSS(Statistical Product and Sercice Solution)22.0统计软件进行统计分析,采用Origin 8.0作图软件进行数据处理分析
2 结果与分析
2.1 四种花色苷提取物的液相色谱图及主要组分
四种花色苷提取物的液相色谱图如图1~图4所示。
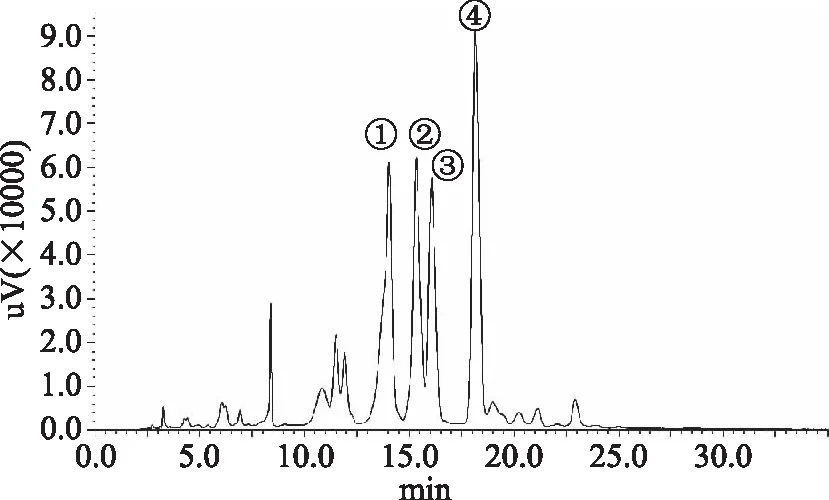
图1 紫甘薯花色苷的高效液相色谱图Fig.1 HPLC diagram of anthocyanin in purple sweet potato
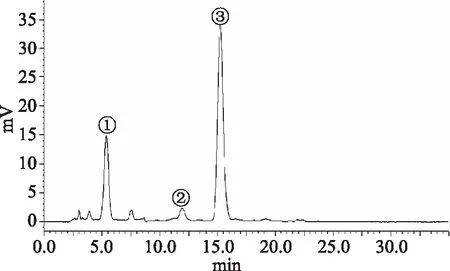
图2 黑枸杞花色苷的高效液相色谱图Fig.2 HPLC diagram of anthocyanin in Lycium ruthenicum Murr

图3 黑加仑花色苷的高效液相色谱图Fig.3 HPLC diagram of anthocyanin in blackcurrant

图4 桑葚花色苷的高效液相色谱图Fig.4 HPLC diagram of anthocyanin in mulberry
由图1~图4可知,紫甘薯花色苷主要含四种组分,组分1占19.08%,组分2占15.41%,组分3占14.12%,组分4占32.10%,其含量最高的为组分4;黑枸杞花色苷主要含三种组分,组分1占13.36%,组分2占4.43%,组分3占71.60%,其主要成分为组分3;黑加仑花色苷主要含四种组分,组分1占12.51%,组分2占30.50%,组分3占12.93%,组分4占30.68%,其主要成分为组分4;桑葚花色苷含两种组分,组分1占53.91%,组分2占29.64%,其主要成分为组分1。
2.2 HSCCC溶剂体系的选择
要使溶剂体系两相间能快速明显地分层,要求体系与被分离物质不发生反应,且样品能在溶剂体系中很好的溶解;使其在两相间的分配系数K在0.5~2之间,且样品中不同化合物的分配系数比大于1.5。有较高的固定相保留值(不小于40%),这样快速能够保证有效的分离。针对不同样品,对不同配比的溶剂体系进行筛选,结果见表1~表4。

表1 不同溶剂体系的分配系数(紫甘薯花色苷)Table 1 Partition coefficient(K)of compounds in different solvent systems(Purple sweet potato anthocyanins)

表2 不同溶剂体系的分配系数(黑枸杞花色苷)Table 2 Partition coefficient(K)of compounds in different solvent systems(Anthocyanins in Lycium ruthenicum Murr.)

表3 不同溶剂体系的分配系数(黑加仑花色苷) Tab. 3 Partition coefficient(K)of compounds in different solvent systems(Black currant anthocyanins)

表4 不同溶剂体系的分配系数(桑葚花色苷)Table 4 Partition coefficient(K)of compounds in different solvent systems(Mulberry anthocyanins)
由表1可知,第1、3、5溶剂体系中,被分离组分的分配系数超过2,在第2、4溶剂体系中,组分1的分配系数过小,不能很好的分离,编号6溶剂体系分配系数K在合适范围内,优于其他体系,有良好的分离度,且样品中不同化合物的分配系数比较大,故选择编号6,即2∶5∶1∶6∶0.01的溶剂体系进行紫甘薯花色苷的分离。
由表2可知,组分1在不同溶剂体系中K值都较小,无法分离出单体物质,但组分3能与组分1和组分2良好的分离,其中,第2种溶剂体系得到的不同组分间K值的比值更大,故选择2∶2∶1∶5∶0.01的溶剂体系进行黑枸杞花色苷的分离。
由表3可知,溶剂体系1、2、3中,不同组分的分配系数比小于1.5,溶剂体系4中不同组分间的分配系数比值较大,能更好的分离,因此,选择2∶2∶1∶5∶0.01的溶剂体系进行黑加仑花色苷的分离。
由表4可知,溶剂体系1中,两组分分配系数的比值小于1.5,因此,选择2∶2∶1∶5∶0.01的体系进行桑葚花色苷的分离。
2.3 HSCCC制备分离四种不同花色苷的单体
2.3.1 四种不同花色苷的单体分离制备 采用选出的分离不同花色苷的最优溶剂体系,根据出峰位置收集得到不同组分,分别在40 ℃下旋蒸,冻干保存。
2.3.2 花色苷单体的结构鉴定 采用液质联用在正离子模式下对各组分进行鉴定,进行一级质谱和二级质谱分析,通过各成分的色谱保留时间、紫外最大吸收波长并结合各成分质谱的分子离子峰和碎片离子峰与Truong V D等[15-21]的鉴定结果进行比对验证,数据见表5~表8。

表5 紫甘薯花色苷单体的结构鉴定Table 5 Structural identification of anthocyanin monomers from purple sweet potato

表6 黑枸杞花色苷单体的结构鉴定Table 6 Structural identification of anthocyanin in Lycium ruthenicum Murr.

表7 黑加仑花色苷单体的结构鉴定Table 7 Structural identification of anthocyanin monomers of blackcurrant

表8 桑葚花色苷单体的结构鉴定Table 8 Structural identification of the mulberry anthocyanin monomer
2.3.3 四种提取物代表性花色苷单体的选择 依据每种花色苷提取物选择含量较高,分子量较居中的单体化合物作为代表成分的原则,紫甘薯花色苷选择组分4(芍药素-3-咖啡酰-阿魏酰槐糖苷-5-葡萄糖苷),黑枸杞选择组分3(矮牵牛素-3-O-对香豆酰芸香糖苷-5-O葡萄糖苷),黑加仑选择组分4(矢车菊色素-3-芸香糖苷),桑葚选择组分1(矢车菊-3-O-葡萄糖苷)作为代表性成分,用HSCCC制备以上四种代表性单体化合物,用液相色谱面积归一法测得四种单体组分纯度均较高,依次为90.51%、94.25%、95.02%和98.2%。作为后续研究的材料。
2.4 四种代表性花色苷单体的体外抗氧化性质的比较研究
2.4.1 四种代表性花色苷单体DPPH自由基清除能力 DPPH·称二苯代苦味酰基自由基(2,2-diphenyl-l-picry-hydrazyl radical)是一种很稳定的以氮为中心的自由基,通过吸光度的减少量可测定自由基清除剂的清除能力[22]。
四种代表性花色苷单体DPPH自由基清除能力如图5所示。
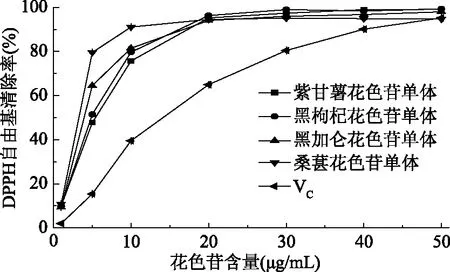
图5 四种不同来源花色苷单体 DPPH自由基清除能力的比较Fig.5 Comparison of DPPH free radical scavenging ability of four different source anthocyanins
半抑制浓度(即IC50,是清除率达一半时样品的浓度)能较好地反映和比较样品的抗氧化能力。用SPSS分析软件计算出抗坏血酸的半数抑制浓度IC50值为14.38 μg/mL,而四种花色苷单体的IC50值均低于抗坏血酸,其中,紫甘薯单体的IC50为6.58 μg/mL,黑枸杞单体的IC50为5.35 μg/mL,黑加仑单体的IC50为4.71 μg/mL,桑葚单体组分的IC50为2.44 μg/mL,由以上数据可知,五种抗氧化剂对DPPH自由基清除能力大小依次为:桑葚>黑加仑>黑枸杞>紫甘薯>VC。
2.4.2 四种代表性花色苷单体的羟自由基清除能力 在众多自由基中,羟基自由基是最活泼的,反应速度较快的,对机体危害最大的自由基[23]。四种代表性花色苷单体的羟自由基清除能力如图6所示。

图6 四种不同来源花色苷单体羟自由基清除能力的比较Fig.6 Comparison of hydroxyradical scavenging ability of anthocyanins from four different sources
用SPSS分析软件计算出抗坏血酸的半数抑制浓度IC50值为228.00 μg/mL,紫甘薯单体化合物对OH·清除率其IC50为93.32 μg/mL,黑枸杞单体的IC50为123.25 μg/mL,黑加仑单体的IC50为147.37 μg/mL,桑葚单体组分的IC50为95.02 μg/mL,VC的IC50为228.00 μg/mL,由以上数据可知,五种抗氧化剂对OH·自由基清除能力大小依次为:紫甘薯>桑葚>黑枸杞>黑加仑>VC。
2.4.3 四种代表性花色苷单体的还原能力 还原力的测定以样品是否为良好的电子供应体为指标,还原力大的样品是良好的电子供应者,供应的电子除了可使Fe3+还原为Fe2+外,亦可与自由基反应,使自由基成为稳定的物质[24]。
如图7所示,四种花色苷单体的还原力小于抗坏血酸,是因为抗坏血酸2-OH存在稀醇式互变异构,容易脱氢,因此抗坏血酸还原力大于花色苷。在四种花色苷中,单体还原能力依次为:黑枸杞>桑葚>紫甘薯>黑加仑。

图7 四种不同来源花色苷还原能力的比较Fig.7 Comparison of anthocyanin reduction ability in four different sources
3 结论
通过高速逆流色谱,选用甲基叔丁基醚-正丁醇-乙腈-水体系分别制备得到紫甘薯、黑枸杞、黑加仑、桑葚花色苷的代表性花色苷单体化合物,用HPLC-MS鉴定推测为芍药素-3-咖啡酰-阿魏酰槐糖苷-5-葡萄糖苷、矮牵牛素-3-O-对香豆酰芸香糖苷-5-O葡萄糖苷、矢车菊色素-3-芸香糖苷、矢车菊-3-O-葡萄糖苷,且纯度都在90%以上。通过测定其对DPPH自由基的清除能力、对OH·自由基的清除能力以及总还原能力的比较,可以看出不同花色苷单体化合物均具有较好的体外抗氧化性,对DPPH自由基清除能力大小依次为:桑葚>黑加仑>黑枸杞>紫甘薯>VC,对OH·自由基清除能力大小依次为:紫甘薯>桑葚>黑枸杞>黑加仑>VC,得出的结果不一致,可能是由于不同抗氧化指标所依赖的物质基础有较大的差异,表明在评价物质的抗氧化特性时,指标选择的不同会造成不相同的结果。后续实验还需进一步从分子或者细胞水平探究花色苷抗氧化能力,提供更可靠的理论依据;继续研究对比不同花色苷单体其他特性,探究不同花色苷单体的作用机制。
