桃金娘果实花色苷提取物 对两种假单胞菌生物被膜的抑制研究
2018-07-11刘永吉范玉慧郭红辉
刘永吉,范玉慧,郭红辉
(韶关学院英东食品科学与工程学院,广东韶关 512005)
桃金娘(Rhodomyrtustomentosa(Ait.)Hassk)的果实称岗稔,成熟后为紫黑色浆果,富含花色苷等物质[1],其花色苷主要由矢车菊啶-3-O-β-葡萄糖色素和芍药啶-3-O-β-葡萄糖等几种花色苷单体构成[2-3]。桃金娘果实的总花色苷含量相当于414 mg矢车菊素/100 g(以干质量计)[4],是较理想的花色苷来源。
花色苷是一类植物多酚类活性物质[5],具有抗氧化、清除自由基等生物活性。花色苷这类天然酚类抗氧化物多数也具有一定的抗菌作用[6],如蓝莓花色苷和葡萄皮花色苷对致病性大肠杆菌(Escherichiacoli)、金黄色葡萄球菌(Staphylococcusaureus)和沙门氏菌(Salmonella)均有抑制作用[7-8]。此外,蓝靛果中的花色苷提取物能够减少细菌生物被膜的形成和降低细菌在接触面上的粘附作用[9],也有一定抑制作用。蓝莓花色苷提取物能够显著抑制铜绿假单胞菌(Pseudomonasaeruginosa)、大肠杆菌(E.coli)和金黄色葡萄球菌(S.aureus)生物被膜的形成和粘附作用[10]。可见,不少植物来源的花色苷对细菌生物被膜的形成具有抑制作用。
细菌的生物被膜是由多糖、蛋白和核酸等物质构成复合结构,细菌形成生物被膜后对环境、抗生素等具有更强的适应性和抵抗力。目前已确定多种食源性细菌具有形成生物被膜的能力,也能够在食品或食品接触面上形成生物被膜[11-12],这有利于其在食品接触面黏附、并进一步污染食品。假单胞菌属细菌多数能够形成生物被膜[13],荧光假单胞菌(Pseudomonasfluorescens)、莓实假单胞菌(Pseudomonasfragi)、隆德假单胞菌(Pseudomonaslundensis)等常见腐败菌都能形成生物被膜,由其引起的食品污染风险已经引起了重视,探索针对生物被膜的植物活性抑制剂是控制生物被膜的重要途径之一。
本研究主要以成熟的桃金娘果实为花色苷提取原料,探索其花色苷提取物对荧光假单胞菌和隆德假单胞菌生物被膜的抑制作用,为探寻抑制腐败菌生物被膜的植物活性成分、进一步开发新的植物活性抑制剂提供理论依据。
1 材料与方法
1.1 材料和仪器
桃金娘果 购于韶关当地市场,储存于-20 ℃冰箱;荧光假单胞菌、隆德假单胞菌菌种 源于腐败的冷却猪肉,本实验室分离鉴定后保存的菌株;胰蛋白胨大豆营养肉汤培养基(TSB) 广东环凯微生物科技有限公司;平板计数琼脂(PCA) 广东环凯微生物科技有限公司;乙酸 天津市大众试剂研发中心;结晶紫 天津市大茂化学试剂厂;甲醇 成都市科龙化工试剂厂。
LDZX-50FBS型立式压力蒸汽灭菌器 上海申安医疗器械厂;RE-52B型旋转蒸发仪 上海亚荣生化仪器设备有限公司;SK3200LH型双频超声波清洗仪 韶关德尔实验仪器有限公司;Bio-Rad Imark型酶标仪 美国伯乐生命医学产品有限公司。
1.2 实验方法
1.2.1 菌种的活化与制备 将冻存的菌种室温解冻后用琼脂平板划线,将划线平板在30 ℃下培养至出现明显单菌落(24~36 h),取单菌落经两次液体过夜活化(30 ℃摇床180 r/min)后,用无菌TSB稀释至OD600 nm为0.5备用。
1.2.2 桃金娘花色苷提取物的制备 称取100 g匀浆,加入60%乙醇250 mL,超声波处理25 min(功率250 W,40 kHz),用布氏漏斗过滤,滤液避光存储;残渣重复以上步骤。混合两次滤液,用0.22 μm的滤膜过滤,取滤液于旋转蒸发仪50 ℃旋转蒸发,待蒸发至体积小于15 mL左右时,停止蒸发,测定粗提物中花色苷含量,无菌水调整浓度,得到4 g/mL的桃金娘花色苷粗提物,再次过0.22 μm滤膜除菌,-18 ℃冰箱中避光冻存备用。花色苷含量(C,mg/L)的测定参考刘永吉等[10]的方法,采用pH示差法测定计算公式如下。
C=A×MW×DF×1000/(ε×l)
式中:A=[(Aλmax-A700)pH1.0-(Aλmax-A700)pH4.5];ε=26900(为矢车菊-3-葡萄糖苷的摩尔消光系数);MW=449.2(矢车菊-3-葡萄糖苷的分子量),DF为稀释倍数。
1.2.3 肉汤稀释法测定最小抑菌浓度 用梯度稀释法测定桃金娘花色苷粗提物的最小抑菌浓度(Minimum Inhibitory Concentration,MIC)。所用的桃金娘花色苷粗提物的花色苷含量为4 g/mL,取稀释好的花色苷提取物加入含有TSB培养液的96孔板中,依次稀释到第10孔,第11孔为不含抑菌剂的空白对照,第12孔为TSB培养基空白对照,最终各孔的花色苷提取液梯度浓度分别为:2000、1500、1000、500、250、125、62.5、31.25、15.75、7.85、0 mg/mL。将二次活化好的菌株稀释至OD600 nm值为0.5,然后取2 μL接种至孔板,每株菌独立重复接种3次。30 ℃培养24 h,观察判断。以明显不长菌的每个菌的最低抑菌剂浓度为该菌的MIC。
1.2.4 最小杀菌浓度(Minimum Bactericidal Concentration,MBC)的测定 在MIC测定的基础上选择所有澄清的孔板,将其培养液进行稀释100倍,取0.2 mL稀释菌液平板涂布后30 ℃恒温培培养24 h,以菌落不超过5个的最低浓度为MBC值。
1.2.5 桃金娘花色苷对生物被膜的抑制规律研究 在低于最小抑菌浓度的非抑菌浓度下(500 mg/mL)做花色苷提取物对细菌生物被膜的抑制实验。在96孔标板中培养生物被膜。取稀释好的菌液2 μL接入200 μL含有亚抑菌浓度花色苷提取物的TSB中,每个浓度做4个平行样。以接菌的不含花色苷提取物的培养基作为阳性对照,以没有接菌的空白培养基作为阴性对照。在30 ℃分别培养6、12、24 h,取出测定生物被膜的产量。
1.2.6 微孔板法测定细菌的生物被膜产量 参照文献[14-15]将培养生物被膜后的孔板取出,小心除去未黏附的浮游菌培养液。用无菌TSB清洗孔板3次,用200 μL甲醇固定15 min,之后吸去甲醇并在空气中晾干,加入200 μL 1%结晶紫加入结晶紫溶液染色5 min,将染液吸出,用流水清洗孔板至滴水无色为止。酶标板在空气中晾干,加入200 μL/孔的33%乙酸进行溶解,用酶标仪测定630 nm处的吸光度,以此吸光值表示生物被膜的产量。以接菌的不含抑菌剂的培养基作为对照。
1.3 数据处理
所有实验至少重复两次,实验数据用SPSS 19.0(SPSS Inc. Chicago,IL,USA)进行单因素方差分析,数据用Excel软件处理并绘图。
2 结果与分析
2.1 桃金娘花色苷提取物对两种假单胞菌的MIC测定
桃金娘花色苷提取物对两种假单胞菌的MIC测定如表1所示。结果表明,隆德假单胞菌和荧光假单胞菌对桃金娘果实花色苷提取物具有敏感性,在一定的浓度下,桃金娘花色苷提取物均能抑制两种假单菌的增长。由表1可知,桃金娘花色苷提取物对隆德假单胞菌的最小抑菌浓度(MIC)为1500 mg/mL,对于荧光假单胞菌的最小抑菌浓度(MIC)为1000 mg/mL。相同浓度花色苷提取物对荧光假单胞菌的抑制效果比对隆德假单胞菌的抑制效果更明显。本研究的桃金娘果实花色苷提取物对两种假单胞菌的MIC较葡萄皮花色苷对致病菌的MIC高[7],这可能是因为不同来源的花色苷和菌种差异导致的,即使是不同产地的同一种果实的花色苷提取物对同一种细菌的抑制作用也有较大差异[16]。

表1 花色苷提取物对隆德假单胞菌和荧光假单胞菌MIC的测定结果Table 1 MIC of the anthocyanin extracts on Pse lundensis and Pse fluorescens
2.2 桃金娘花色苷提取物对两种假单胞菌的MBC测定
桃金娘花色苷提取物对两种假单胞菌的MBC测定结果如表2所示,花色苷提取物对隆德假单胞菌的MBC为2000 mg/mL,对荧光假单胞菌的MBC为1000 mg/mL。这进一步表明,隆德假单胞菌和荧光假单胞菌对桃金娘花色苷提取物敏感。一定浓度的桃金娘花色苷提取物对两种假单胞菌均有杀菌抑制效果。该研究的桃金娘花色苷提取物对两种假单胞菌的杀菌浓度高于葡萄皮花色苷对大肠杆菌(E.coli)或金黄色葡萄球菌(Saureus)的杀菌浓度[7],差异原因可能与花色苷来源和菌种差异有关,此外,花色苷的稳定性也是重要因素之一。花色苷在偏酸性条件下更稳定,而本抑菌实验所用的TSB培养基pH为7.3±0.2,在这种条件下花色苷的稳定性和活性受到了一定破坏和限制。

表2 花色苷提取物对两种假单胞菌的MBC的测定结果Table 2 MBC of the anthocyanin extracts on Pse lundensis and Pse fluorescens
2.3 桃金娘花色苷提取物对隆德假单胞菌生物被膜的抑制作用
在MIC浓度下,细菌的生长繁殖受到抑制剂的抑制,这种情况下并不能很好地观测抑制剂对细菌代谢的影响;在低于MIC的亚抑菌浓度下,细菌生长繁殖只有部分被抑制,而其代谢物的产生有明显变化。因此,本文在亚抑菌浓度下观测桃金娘花色苷提取物对两种假单胞菌生物被膜的作用规律,其结果如图1(A)和图1(B)所示。
从生物被膜染色结果看,在12和24 h时,与对照组相比,添加500 mg/mL的桃金娘花色苷提取物能够抑制隆德假单胞菌生物被膜的产生,减少了该菌在接触面上的粘附量(图1A)。从生物被膜产生量测定结果看,添加了500 mg/mL的桃金娘花色苷提取物组在12和24 h时其生物被膜的产量显著(p<0.05)低于对照组(图1B),在24 h时差异显著(p<0.05)。低浓度的花色苷提取物对细菌生物被膜的抑制效果较低,这可能是因为低浓度的花色苷提取物不能有效地降低细菌在接触面上的粘附[9]。同时,随着时间的延长,花色苷提取物对细菌生物被膜的抑制作用减弱,还可能是部分花色苷在碱性TSB培养基中转变成了查耳酮等物质使抑制作用减弱。本次研究中,添加250 mg/mL的桃金娘花色苷提取物在24 h对隆德假单胞菌的生物被膜没有抑制效果,与对照相比反而增加了生物被膜的形成量,但差异不显著。推测在花色苷作用较强的培养前期细菌密度较低,其生物被膜形成量较少,受到了花色苷的显著抑制(图1B,12 h);随着花色苷抑制作用的减弱和菌密度的增加该菌产生了较多的生物被膜(图1B,24 h),体系中的花色苷浓度低于抑制细菌生长的MIC浓度,在这种抑菌浓度下细菌的代谢受到一定抑制,但仍然能够生长;这增加了细菌生长的困难性,但也可能刺激细菌产生更多的生物被膜来抵抗和适应这种不利条件;这是细菌借助生物被膜增强自身的适应性和抵抗性的结果[17]。类似的研究表明,部分低于MIC浓度的蓝莓花色苷提取物对耐药的铜绿假单胞菌(PseaeruginosaCI)、大肠杆菌(E.coli)的生物被膜没有抑制作用,反而促进了生物被膜的产生量[18]。

图1 花色苷提取物作用下隆德假单胞菌生物被膜的 结晶紫染色图(A)和产量图(B)Fig.1 Inhibition results of anthocyanin extracts on Pse lundensis biofilm formation(B) and bacterial adhesion on microtiter plate surface visualized by crystal violet staining(A)注:同一时点的不同字母表示不同浓度间 存在有显著差异(p<0.05);图2同。
2.4 桃金娘花色苷提取物对荧光假单胞菌生物被膜的抑制规律
在低于MIC的亚抑菌浓度下,桃金娘花色苷提取物对荧光假单胞菌生物被膜抑制作用如图2(A)和图2(B)所示。从生物被膜染色结果看,在12和24 h时,与对照组相比,添加500和250 mg/mL的桃金娘花色苷提取物能够抑制荧光假单胞菌生物被膜的产生,降低其在接触面上的粘附量(图2A)。随着培养时间的延长,各组假单胞菌生物被膜的产量逐渐增加(图2B)。在第6 h并未观测到500和250 mg/mL的桃金娘花色苷提取物对荧光假单胞菌生物被膜的形成有抑制作用;在第12 h,500 mg/mL桃金娘花色苷提取物抑制了荧光假单胞菌的生物被膜的形成,与对照组有显著差异(p<0.05);24 h后,500和250 mg/mL的桃金娘花色苷提取物均能够抑制荧光假单胞菌生物被膜的形成,与对照组有显著差异(p<0.05)。花色苷的这种抑制作用可能是通过增强细菌的细胞膜通透性,抑制菌体对数期的生长分裂等机理实现的[19];如,大肠杆菌(E.coli)经紫甘薯花色苷处理后出现明显的菌体变形,细胞质稀薄,质壁分离,细胞质解体并形成空泡等细胞死亡现象[20]。
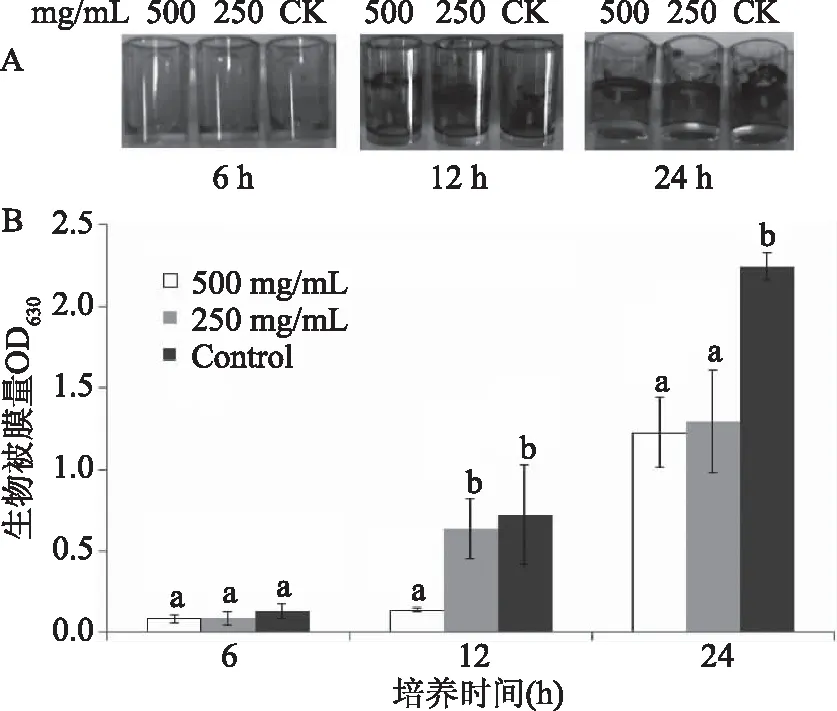
图2 花色苷提取物作用下荧光假单胞菌生物被膜的 结晶紫染色图(A)和产量图(B)Fig.2 Inhibition results of anthocyanin extracts on Pse fluorescens biofilm formation(B) and bacterial adhesion on microtiter plate surface visualized by crystal violet staining(A)
3 结论
本文研究了桃金娘果实花色苷提取物对隆德假单胞菌和荧光假单胞菌的抑制作用和抑菌浓度的花色苷提取物对两种假单胞菌生物被膜的抑制效果,研究发现:桃金娘果实花色苷提取物对隆德假单胞菌和荧光假单胞菌具有一定的抑制作用,对隆德假单胞菌和荧光假单胞菌的最小抑菌浓度分别为1500与1000 mg/mL。在低于MIC的亚抑菌浓度下,500 mg/mL的桃金娘果实花色苷提取物对隆德假单胞菌和荧光假单胞菌生物被膜具有抑制效果,能够降低两种假单胞菌在接触面上的粘附量。该研究为进一步研究桃金娘果实中花色苷抑制细菌生物被膜的可能性提供了基础。
