天然保鲜剂的配比优化及其对牛肉保鲜效果的影响
2018-07-11付丽胡晓波吴丽高雪琴皇甫幼宇
付丽,胡晓波,吴丽,高雪琴,皇甫幼宇
(1.河南牧业经济学院食品工程学院,河南郑州 450046)(2.河南伊赛牛肉股份有限公司,河南焦作 454450)
我国是世界第一产肉大国,2016年全国肉类总产量达8540万吨,占全球肉类总产量的27%。但我国肉类结构不尽合理,牛肉产量为717万吨,仅占肉类总产量的8.40%,仅为世界牛肉占比的1/3,因此,大力发展牛肉产业是我国肉类工业“十三五”发展的主要方向。冷鲜牛肉高蛋白质、低脂肪且味道鲜美[1,2],已成为肉类消费的主流。但目前冷鲜牛肉多采用大块真空包装贮运,无包装冷藏柜销售的模式,在贮藏、运输和销售过程中易受到外界微生物的污染或自身酶的作用而腐败变质,食用价值降低[3],货架期短,有些微生物甚至会产生对人体有害的毒素,严重影响了我国牛肉产业的发展。天然保鲜剂安全、可靠,具有很好的抑菌活性,有些还具有很强的抗氧化作用。同时也符合现代消费者崇尚自然与健康的生活理念,因此,开发高效与安全的天然保鲜剂具有广阔的应用前景。
张铁华等[4]通过对屠宰、预冷、分割后的鲜牛肉表面菌相分析得出G(-)小杆菌和G(+)球菌是致使其腐败变质的主要菌系。茶多酚具有广谱抑菌性,对腐败菌、食源菌和致病菌均有很好的抑菌活性[5,6];也具有一定的延缓衰老、提神醒脑和止渴甚至抗癌等作用;另外,还具有很好的抗氧化和清除自由基的能力[7]。壳聚糖是甲壳素经脱乙酰作用得到的[8],是目前发现的自然界中唯一大量存在的碱性氨基多糖,具有较强的抑菌性和抗氧化性[9,10],是一种天然、无毒、安全、性能稳定的保鲜剂,对多种细菌和真菌均有抑制功能[11]。乳酸链球菌素(Nisin)是乳酸链球菌代谢中产生的多肽物质,对大多数G(+)菌抑制作用较好并对芽孢杆菌的孢子有强烈的抑制作用,作为天然食品保鲜剂被广泛应用的细菌源抑菌剂[12],也是唯一被世界卫生组织批准的天然抗菌肽[13]。
本试验选用茶多酚、Nisin、壳聚糖三种天然保鲜剂进行抑菌圈试验,以大肠杆菌与金黄色葡萄球菌的对象菌,以抑菌圈直径为检测指标,优化了三种天然保鲜剂协同保鲜的最适配比,并进行该保鲜剂与冷藏协同对牛肉保鲜效果的研究,开发出一种高效且安全的牛肉天然保鲜剂。
1 材料与方法
1.1 材料与试剂
新鲜牛肉(黄瓜条),河南伊赛牛肉股份有限公司;金黄色葡萄球菌、大肠杆菌菌种,河南牧业经济学院微生物实验室;茶多酚(含量 98%,食品级),郑州指南针生物科技有限公司;水溶性壳聚糖(纯度100%,食品级),河南金诚生物科技有限公司;Nisin(生物效价≥1000 IU/mg),深圳恒生生物科学科技有限公司;LB营养肉汤(用于大肠杆菌与金黄色葡萄球菌的活化扩培),青岛高科园海博生物技术有限公司;营养琼脂(用于大肠杆菌与金黄色葡萄球菌的抑菌试验),北京奥博星生物技术有限责任公司;空白药敏片(6 mm),杭州微生物试剂有限公司。
1.2 仪器与设备
ZWYR-2102C恒温培养振荡器,上海智城分析仪器制造有限公司;303A-3数显电热培养箱,上海浦东荣丰仪器有限公司;FA2104电子天平,上海舜宇恒平科学仪器有限公司;BHC-1300IIA2超净工作台,苏州净化仪器有限公司;LDZX-50KBS立式压力蒸汽灭菌器,上海申安医疗器械厂;BHC-1300IIA2超净工作台,苏州净化仪器有限公司;K9860全自动凯氏定氮仪,山东海能科学仪器有限公司;BlueStar B型分光光度计,北京莱伯泰科仪器股份有限公司;CR-400色差计,柯尼卡美能达(中国)投资有限公司。
1.3 试验方法
1.3.1 抑菌圈法优化天然保鲜剂的配比试验
1.3.1.1 抑菌液的制备
分别称取一定量的茶多酚、壳聚糖及 Nisin溶于蒸馏水中,定容至100 mL,充分混匀,装入试剂瓶中,放于冰箱备用。
1.3.1.2 菌种的活化与菌悬液的制备
菌种活化:将于冰箱内冷冻保存的斜面菌种取出,在无菌的环境下,用灭菌的接种环挑取适量的菌种在营养琼脂培养基上划线,于37 ℃恒温培养24 h。
扩培:为了提高菌液浓度,能够足够铺满培养皿,需要对菌种进行扩大培养至菌量达到一定浓度。经过24 h培养过后的细菌,挑取单个明显菌落于LB营养肉汤中,放于37 ℃恒温培养振荡器中,220 r/min摇床培养9~12 h,得到原菌液备用。
计数:在无菌条件下,使用移液枪吸取1 mL原菌液至灭过菌9 mL的生理盐水中充分混匀,依次10倍递增直到将原菌液稀释至10-8后,吸取0.1 mL菌液接种于事先准备好的营养琼脂培养基上,涂布均匀后,在37 ℃下经过24 h恒温培养并计数,以确认试验平板中活菌的浓度是达到107~108CFU/g。
1.3.1.3 试验平板的制备
试验平板的制备采用涂布平板法。将制备好的营养琼脂培养基从冰箱内取出,充分加热至溶解后,冷却至50 ℃左右。
在无菌的条件下往已灭菌的平板中倾注 15~20 mL的培养基,水平静置至凝固后,用无菌移液器注入混匀的大肠杆菌或金黄色葡萄球菌菌液0.2 mL,用无菌涂布棒涂布,使菌液均匀布满培养基表面,平板表面菌液适宜干燥后备用。
1.3.1.4 抑菌试验
取经160 ℃灭菌20 min并烘干的滤纸片,用无菌的镊子夹取浸泡于一定浓度的天然保鲜剂溶液中 1 min,取出微干备用。在无菌的条件下,放于已准备好的试验平板中适当位置的培养基上,每个平板放三个滤纸片,每个滤纸片间间隔一定的距离。将培养皿放入培养箱37 ℃经24 h恒温培养,取出后用游标卡尺测量各抑菌圈直径的大小。
1.3.1.5 三种天然保鲜剂单因素抑菌圈试验
三种天然保鲜剂的抑菌浓度见表1,以沾有灭菌蒸馏水的滤纸片作为对照,以抑菌圈直径为检测指标,进行三种天然保鲜剂单独使用抑菌效果的研究。
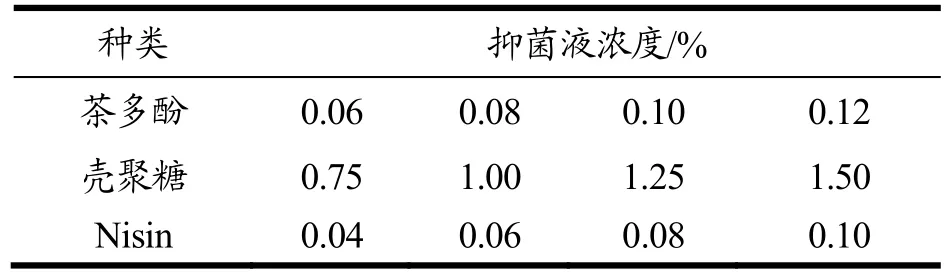
表1 单因素实验安排表Table 1 Single factor experiment schedule
1.3.1.6 三种天然保鲜剂协同抑菌圈试验
根据的单因素试验结果,选出三种天然保鲜剂的最适抑菌浓度后,进行 L9(33)正交试验优化出三种天然保鲜剂的最适配比。按正交试验因素水平配制各种复合抑菌溶液进行抑菌试验,于37 ℃,培养24 h后观察抑菌情况,用游标卡尺测量抑菌圈大小。
1.3.1.7 抑菌圈大小的测量
将培养好的试验平板取出,校准好游标卡尺,以抑菌圈直径表示抑菌圈的大小。抑菌圈直径的测定应用马海滨等[16]的方法,采用十字交叉法测量抑菌圈直径,平行测三次取其平均值。
Parking Violation Detection Algorithm Based on OpenCV and Machine Learning……………LIU Hai, TAN Zhonghui(2·65)
1.3.2 天然保鲜剂对牛肉保鲜效果的研究
1.3.2.1 保鲜剂的制备
根据抑菌圈试验得到的茶多酚、壳聚糖、Nisin三种天然保鲜剂协同保鲜的最适配比进行保鲜剂的制备。在无菌条件下,称取相应量的茶多酚、壳聚糖、Nisin混匀后,放入盛有500 mL无菌蒸馏水的烧杯中,充分溶解后,定容至1000 mL,装入无菌试剂瓶中备用。按肉块重5%进行添加。
1.3.2.2 肉样处理
将刀、案板等放入超净工作台,用酒精棉球擦拭后紫外照射杀菌30 min。将新鲜牛肉(黄瓜条)在案板上,剔除肉样表面的可视脂肪及筋腱及肌膜,分割为80~100 g左右的长方形肉块,分为54块,装入到洁净的塑料袋内充分混合以保证每块肉的初始菌数基本一致。然后将肉块进行分两组,每组27块。具体试验安排见表2。
在无菌的条件下,将制备好的保鲜剂装入灭过菌的喷壶中,均匀喷洒在肉样的表面,自然晾干5 min。然后分装于用酒精棉球擦试消毒并编号的聚苯乙烯塑料保鲜盒内,加盖。以未经保鲜剂处理的肉样做对照。所有肉样放于4 ℃冷库内。分别在0、1、3、5、7、9、11、13、15 d取出相应的肉样进行各项指标的检测。
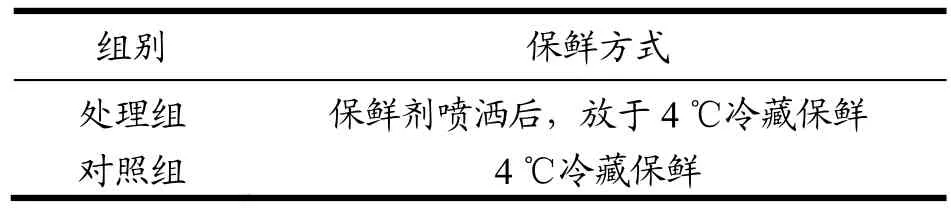
表2 四种保鲜方式的实验安排表Table 2 Experiment schedule of four preservation methods
1.3.2.3 检测指标
菌落总数:按照GB 4789.2的方法[17]进行检测。肉样新鲜度评价参照 Duun等[18]的标准:<4.0 log(CFU/g)为新鲜肉,4.0~6.0 log(CFU/g)为次鲜肉,>6.0 log(CFU/g)为变质肉。TVB-N值的测定采用GB 5009.228[19]中的自动凯氏定氮仪法进行检测。其值≤15 mg/100 g为一级新鲜牛肉,≤20 mg/100 g为二级鲜肉,>20 mg/100 g时则为变质肉[20,21]。吊挂损失率:顺着纤维方向将牛肉切成2×3×5 cm的条状,准确称量后,用线绳悬挂一端,再用保鲜袋套住,扎紧袋口后悬挂于0~4 ℃冷库中24 h后取出,用滤纸吸干表面水分后再称重。

色差(L*值和 a*值):参照郭新颖等[9]的方法并稍做改动。垂直肌纤维方向切取2.0 cm厚度的肉块,用滤纸吸干表面水分,平放在塑料板上,覆盖一层透明保鲜膜,用色差计测量 L*值和 a*值。新鲜牛肉的L*值在 30~45 之间,a*值在 10~25 之间[22]。
TBARS值:按据国标GB 5009.181[23]中的分光光度法进行测定。

式中:c-校准曲线中得到的试样溶液中丙二醛的浓度,µg/mL;V-试样溶液体积,mL;m-试样质量,g。

表3 感官评定标准Table 3 Sensory evaluation table of beef
感官评定:选取6个食品专业人员成立评定小组,评定指标包括色泽、气味、粘度和弹性四个指标,四项评分相加即为总体可接受性。总体可接受性评分≥60时为新鲜肉;50~60之间为次鲜肉;≤50为不新鲜或腐败变质。具体评定标准见表3。
1.3.3 数据分析
每个试验重复3次,结果表示为平均数±SD。图表采用 Sigmaplot12.5进行绘制。数据统计分析采用SPSS Statistics 20.0比较均值中独立T检验进行显著性分析,差异显著性水平为0.05。
2 结果与分析
2.1 三种天然保鲜剂单因素抑菌试验
不同浓度茶多酚、壳聚糖、Nisin抑菌效果见表4。由表4可见,茶多酚通过清除自由基、螯合金属离子等作用达到抑制微生物生长繁殖的目的[24]。在0.10%时抑菌圈直径达到最大值,为7.43 mm,显著大于对照组(p<0.05);当茶多酚浓度大于0.10%时,抑菌效果有所降低(p>0.05),原因可能是茶多酚具有很好的抗氧化活性,能减少氧的浓度,对好氧菌抑制作用较强;另外,茶多酚为棕黄色粉末,浓度高时会影响色泽,这与黎柳等[25]的研究结论是一致的。

表4 不同浓度茶多酚、壳聚糖及Nisin的抑菌效果Table 4 Bacteriostatic effects of different concentrations of tea polyphenols, chitosan and Nisin
不同浓度壳聚糖抑菌效果都明显优于对照组(p<0.05)。壳聚糖分子具有带正电的氨基可与细菌细胞产生的酸性物质反应生成一些结构复杂的高分子物质而增大细菌细胞的渗透性;另外,壳聚糖进入菌体后能阻断菌体RNA转录及蛋白质生物合成,从而达到抑菌作用。壳聚糖浓度1.00%时,抑菌圈直径最大为7.82 mm,这与马海宾等[16]的研究结论基本一致。当壳聚糖浓度>1.00%时,抑菌效果有所降低(p>0.05),原因可能是壳聚糖具有很好的成膜性,浓度大时溶液变得较粘稠,不利于壳聚糖解离出大量的阳离子到菌体细胞表面,且对菌体具有一定的保护作用,从而影响了抑菌的效果,这与曾清清等[26]研究结果也是一致的。
不同浓度的 Nisin处理组的抑菌圈均显著大于对照组(p<0.05)。Nisin能作用于革兰氏阳性菌菌体细胞膜,破坏其完整性,改变细胞通透性,细胞内带电荷物质(蛋白质)外泄,给菌体细胞造成不可恢复性损伤,失去代谢和增殖活性,达到抑制其生长和繁殖的作用。当Nisin的浓度在0.08%时,抑菌圈直径达到7.1 mm,抑菌效果最好且显著优于对照组(p<0.05),这与吕淑霞等[27]的实验结果基本一致。
综上所述,通过单因素抑菌试验得出了茶多酚、壳聚糖和Nisin合适的抑菌浓度分别为0.10%、1.00%和0.08%。
2.2 三种天然保鲜剂协同抑菌效果的研究
三种天然保鲜剂协同抑菌正交试验因素水平表见表5,正交试验结果及极差分析见表6。
由表6可以看出,极差值中RC>RB>RA,说明各因素中影响抑菌效果的主次顺序为C>B>A。Nisin对抑菌效果影响量大,其次为壳聚糖,最次为茶多酚。Nisin和壳聚糖的添加量对抑菌效果影响大些,且具有协同作用,这与曾清清等[26]的研究结论是一致的。原因是壳聚糖分子中含有多个亲水性基团,具有很强的吸水性,减少Nisin分子的溶剂化层水,并能与Nisin之间形成氢键,保护且稳定其空间结构,提高其抑菌稳定性。由于茶多酚也具有广谱抑菌性,壳聚糖与茶多酚协同抗氧化和抑菌效果较好[28],对于抑菌效果也不可缺少。另外,正交试验中不同处理组的抑菌圈直径均大于三种天然保鲜剂单独使用时的抑菌圈直径,同样说明这三种天然保鲜剂之间存在较好的协同抑菌作用。
由正交试验得出三种天然保鲜剂的最适组合方案为A2B2C2,即茶多酚为0.10%,壳聚糖为1.00%,Nisin为0.08%。在此配比下,三种天然保鲜剂复合协同抑菌效果最理想。

表5 因素水平安排表Table 5 Factors level schedule of the orthogonal experiment

表6 正交试验结果Table 6 The orthogonal experiment results
2.3 天然保鲜剂对牛肉保鲜效果的研究
2.3.1 牛肉贮藏期间菌落总数的变化
牛肉在贮藏期间菌落总数的变化如图1所示。

图1 牛肉在贮藏期间菌落总数的变化Fig.1 Changes in total viable counts of beef during storage
由图1可看出,随着贮藏时间的延长,牛肉中菌落总数都呈上升趋势。添加保鲜剂的处理组牛肉在贮藏期间的菌落总数显著低于对照组(p<0.05)。对照组牛肉的菌数在前5 d增加较缓慢,第5 d时菌数对数值达到4.89 logCFU/g,为次鲜肉;5 d后菌数明显增长,第7 d时已超过6.0 logCFU/g,证明肉样已变质;保鲜剂处理组前3 d菌落总数呈明显下降趋势,菌数对数值由2.83 logCFU/g降至1.75 logCFU/g;第3 d至第11 d菌数开始缓慢上升,第11 d时菌数对数值达到4.44 logCFU/g,仍比较新鲜,说明茶多酚、壳聚糖与Nisin协同冷藏具有很好的抑菌作用;第13 d时牛肉菌数的对数值超过6.0 logCFU/g,证明肉样已腐败,说明天然保鲜剂可将冷藏牛肉的架期延长至11 d。
2.3.2 牛肉贮藏期间TBV-N值的变化

图2 牛肉在贮藏期间TVB-N值的变化Fig.2 Changes in TVB-N value of beef during storage
牛肉贮藏期间TVB-N的变化如图2所示。由图2可以看出,随着贮藏时间的延长,肉样的 TVB-N值均呈上升趋势。保鲜剂处理组与对照组在前3 d肉样的 TVB-N值上升缓慢,但两者之间差异显著(p<0.05),原因可能是初期肉样新鲜且温度较低,微生物和蛋白分解酶的作用较弱,使挥发性盐基氮含量增加较慢。3 d后对照组牛肉的 TVB-N值明显上升(p<0.05),第5 d为14.82 mg/100 g,已接近国家标准值15 mg/100 g;第7 d时TVB-N值已超过20 mg/100 g,说明此时肉已败坏,因此终止试验。保鲜剂处理组前9 d牛肉的TVB-N值上升较缓慢,11 d后呈上升趋势,第11 d时处理组牛肉的TVB-N值为13.53 mg/100 g(p<0.01),第13 d时已接近20 mg/100 g,第15 d时已超过20 mg/100 g,这与图1的研究趋势相一致,同样说明天然保鲜剂的复合使用可明显提高冷藏保鲜的效果。
2.3.3 牛肉贮藏期间吊挂损失率的变化

图3 牛肉在贮藏期间吊挂损失率的变化Fig.3 Changes in hang loss of different group beef during storage
牛肉贮藏期间吊挂损失的变化如图3所示。牛肉贮藏期间汁液流失会造成肉中营养成分的损失,使肉质变差,降低商品价值,且影响消费者的接受度。由图3可以看出,随着贮藏时间的延长,牛肉的吊挂损失率变化没有明显规律,但均呈逐步上升趋势。处理组牛肉的吊挂损失率显著低于对照组(p<0.05)。对照组牛肉第9 d时吊挂损失率为0.44%,而处理组牛肉第13 d时吊挂损失为0.44%。原因是由于保鲜剂中含有壳聚糖具有一定的成膜性,可在一定程度上阻止肉样中汁液的流失;而且低温保鲜能够更好地保持肌肉细胞的活体状态,对肌细胞无破坏作用,有效地减少了肌肉内营养的流失,说明保鲜剂与冷藏保鲜具有很好的协同作用。
2.3.4 牛肉贮藏期间L*值和a*值的变化
牛肉贮藏期间L*值和a*值的变化见表7。由表7可见,牛肉贮藏期间L*值基本上呈逐渐下降趋势。处理组肉的 L*值显著优于对照组(p<0.05)。对照组肉样的L*值在第5 d时为28.44,已低于30;处理组肉样的L*值在第11 d时略低于30。贮藏期间肉样的a*值呈先升高后下降趋势,原因是贮藏初期,肌红蛋白(Mb)与 O2生产鲜红色氧合肌红蛋白(MbO2),而贮藏后期由于氧分压低使肉色变暗。处理组肉样的a*值显著优于对照组(p<0.05),在第11 d时为10.67,仍为新鲜肉色。

表7 牛肉贮藏期间L*值和a*值的变化Table 7 Changes in L* and a* of beef during storage
2.3.5 牛肉贮藏期间TBARS值的变化
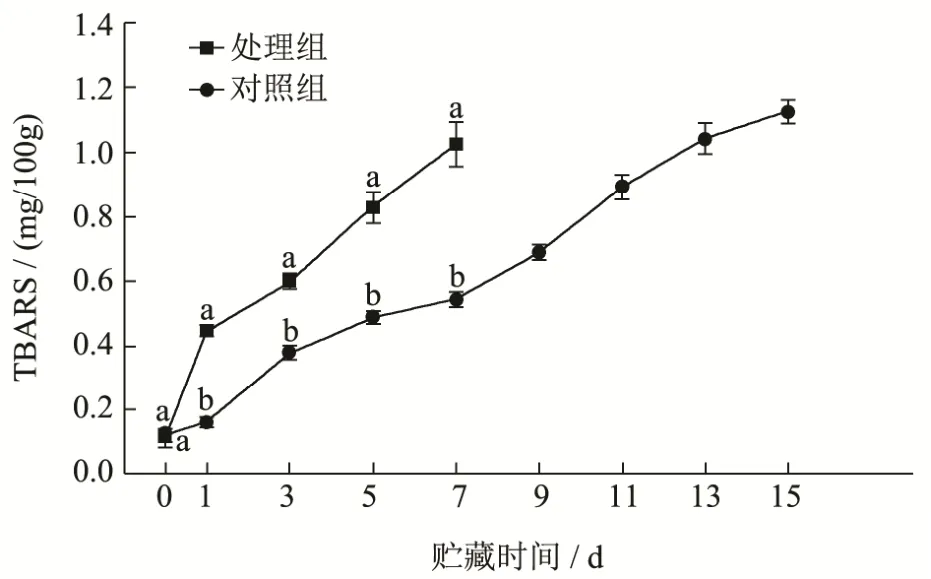
图4 牛肉贮藏期间TBARS值的变化Fig.4 Changes in TBARS of beef during storage
牛肉贮藏期间TBARS值的变化如图4所示。由图4可见,随着贮藏时间的延长,肉样的TBARS值均呈逐渐上升趋势。除第0 d对照组与处理组差异不显著(p>0.05)外,处理组肉样的 TBARS值均显著低于对照组(p<0.01),说明复合保鲜剂对牛肉贮藏期间脂肪的氧化具有很好的抑制作用。
对照组肉样的TBARS值增加较快,原因是包装盒内初期有氧气的残留,而导致TBARS值增高;而处理组肉样的TBARS值增加较缓慢,尤其是贮藏初期变化较小,原因是茶多酚和壳聚糖对牛肉具有很好的协同抗氧化作用,这与王海燕等[7]的研究结论是一致的。
2.3.6 牛肉贮藏期间感官指标的变化
牛肉贮藏期间感官指标的变化见表 8。随着贮藏时间的延长,牛肉的各项感官特性逐渐变差,对照组牛肉的总体可接受性评分下降最快。保鲜剂处理组牛肉的各项感官评分及总体可接受性均显著高于对照组(p<0.01),说明天然保鲜剂的添加与冷藏具有很好的协同作用;另外,天然保鲜剂中壳聚糖具有一定的成膜性,与茶多酚和 Nisin也具有很好的协同抑菌和抗氧化作用,不仅能够有效的抑制微生物的生长,还能抑制酶的活性,从而延缓牛肉感官特性的劣变。保鲜剂处理组牛肉的总体可接受性评分在第13 d时为60.75,仍为新鲜肉;第15 d时为50.8,已接近腐败;而对照组牛肉的总体可接受性评分在第7 d时为16.48,证明已腐败变质,因此终止试验。

表8 牛肉在贮藏期间感官指标的变化Table 8 Changes in sensory indexes of beef during storage
3 结论
近年来,国内外关于茶多酚、壳聚糖及Nisin应用于食品保鲜的研究报道很多,如 Kanatt等[29]应用0.05%的壳聚糖保鲜羊肉使其保质期提高到两周以上;Darmadji等[30]将0.50%~1.00%的壳聚糖添加在鲜肉中可有效抑制腐败菌的生长;Qin Yu-yue等[31]采用茶多酚与壳聚糖复合保鲜猪肉饼。Li tingting等[32]将含茶多酚的天然保鲜剂应用于鲅鱼的保鲜中使其保鲜期延长。Shabnam等[33]应用Nisin使用真空包装的鲑鱼4 ℃下的货架期由12 d延长至16 d。徐宝才等[28]研究发现Nisin对乳杆菌有较强的抑制作用,茶多酚、壳聚糖对肠杆菌有较好的抑菌活性等等。但关于茶多酚、壳聚糖及 Nisin三种天然保鲜剂协同对牛肉保鲜的研究还比较少。本文采用抑菌圈法进行了三种天然保鲜剂的抑菌效果实验,优化出了三种天然保鲜剂的最适配比为茶多酚0.10%、壳聚糖1.00%、Nisin 0.08%,该保鲜剂与冷藏结合可将牛肉的货架期由5 d延长至11 d。本试验开发出了一种安全、高效、健康的牛肉天然复合保鲜剂,对我国牛肉产业的发展将会起到一定的促进作用。
