巨噬细胞抑制因子1在非小细胞肺癌诊断及靶向治疗疗效预测中的临床价值
2018-07-11辛影朱晶柳影
辛影,朱晶,柳影
(吉林省肿瘤医院 肿瘤内一科,吉林 长春 130021)
非小细胞肺癌(non-small cell lung cancer, NSCLC)是常见的肺癌类型,占肺癌发病率的80%~90%。近年来肺癌治疗手段不断进步,但5年死亡率仍居高不下[1]。随着肺癌表皮生长因子受体(epithelial growth factor receptor, EGFR)的发现,EGFR酪氨酸激酶抑制剂逐渐用于NSCLC患者靶向治疗,取得一定成效[2]。巨噬细胞抑制因子1(macrophage inhibitory cytokine-1, MIC-1)属于一个转化生长因子,在诸多病理过程中起重要参与作用。研究报道显示,多数恶性肿瘤患者伴随MIC-1高表达[3],然而关于MIC-1与恶性肿瘤疗效、预后关系的报道尚少。本研究检测Ⅲb期、Ⅳ期NSCLC患者、肺部良性疾病患者及体检健康者的血清MIC-1水平,分析MIC-1与NSCLC患者临床病理特征、靶向治疗效果及预后的关系,探讨MIC-1在恶性肿瘤早期诊断、疗效评估及预后预测中的应用价值,现报道如下。
1 资料与方法
1.1 临床资料
选取2013年1月-2015年1月该院收治的NSCLC患者94例作为NSCLC组。其中,男性53例,女性41例;年龄39~81岁,平均(59.64±5.09)岁;Ⅲb期35例,Ⅳ期59例。选取同期收治的肺部良性疾病患者78例作为良性组。其中,男性41例,女性37例;年龄34~79岁,平均(57.16±4.97)岁。选取同期入院体检健康者70例作为对照组。其中,男性37例,女性33例;年龄33~85岁,平均(60.13±5.61)岁。纳入标准:①经细胞学及组织学病理确诊;②不能手术的晚期癌症,TNM分期为Ⅲb期、Ⅳ期;③无手术、放化疗治疗史,均首次接受靶向治疗,治疗时间≥2个月。排除标准:①经CT、MRI等影像学诊断无法确定TNM分期;②合并其他恶性肿瘤;③已诊断为中枢神经系统转移;④伴随肺间质疾病或严重肝肾功能障碍;⑤患有影响药物吸收的消化系统疾病;⑥预计生存周期<3个月。本研究通过医院伦理委员会批准,患者签署知情同意书。3组性别、年龄比较,差异无统计学意义(P>0.05)。
1.2 靶向治疗
参照《美国临床肿瘤学会Ⅳ期NSCLC化疗的临床实验指南》[4]和文献[5]对EGFR基因突变阴性或阳性患者均给予靶向治疗。其中,56例口服厄洛替尼(瑞士罗氏公司)150mg/次,1次/d;38例口服吉非替尼(英国Astra Zeneca有限公司)150mg/次,1次/d。所有患者持续用药直至肿瘤发生进展或难以耐受的不良反应。
1.3 NSCLC组MIC-1水平检测
NSCLC组治疗前及治疗后1、3、5及7个月,良性组、对照组均行空腹静脉采血2ml,3000r/min离心10 min,分离血清,置入-80℃冰箱冷冻保存。采用双抗体夹心酶联免疫法测定MIC-1水平,试剂盒由北京金紫晶生物技术有限公司提供。
1.4 疗效评价标准
NSCLC组靶向治疗初始治疗1个月及之后每2个月参照实体瘤疗效评价标准[6]评估疗效。本研究以治疗5个月作为近期疗效观察时间[包括完全缓解(complete response, CR)、部分缓解(partial response,PR)、稳定(stable disease, SD)及疾病进展(progressive disease, PD)],其中,CR+PR为有效,SD+PD为无效。
1.5 随访情况
末次随访时间为2017年1月,随访时间为15~42个月,中位随访时间为29个月。
1.6 统计学方法
数据分析采用SPSS 18.0统计软件,计量资料以均数±标准差(±s)表示,多组间比较采用方差分析,两两比较采用t检验或SNK-q检验;计数资料以率(%)表示,采用χ2检验;应用Kaplan-Meier法绘制生存曲线,计算中位生存时间,影响生存率比较采用Logrank检验;绘制ROC曲线筛选截点,预测3年生存率的敏感性和特异性采用Cox回归分析影响中位生存时间的影响因素,P<0.05为差异有统计学意义。
2 结果
2.1 3组血清MIC-1水平比较
NSCLC组、良性组及对照组的血清MIC-1水平分别为(1093.79±115.37)、(634.31±87.49)及(390.34±52.66)pg/ml。3组血清MIC-1水平比较,差异有统计学意义(F=20.267,P=0.000);NSCLC组高于良性组和对照组,且良性组高于对照组(P<0.05)。
2.2 NSCLC患者不同影响因素血清MIC-1水平的比较
不同TNM分期NSCLC患者的血清MIC-1水平比较,差异有统计学意义(P<0.05);不同年龄、性别、靶向治疗方案及EGPR基因突变的比较,差异无统计学意义(P>0.05)。见表1。
2.3 不同治疗时间MIC-1水平的比较
在治疗前NSCLC组的MIC-1为(1093.79±115.37)pg/ml,与治疗 1、3和 5个月 [(1071.09±106.05)、(1029.64±97.22)和(967.68±91.26)pg/ml]比较,差异有统计学意义(F=27.224,P=0.000)。NSCLC患者治疗5个月的血清MIC-1水平低于治疗1个月(P<0.05)和3个月(P<0.05),且治疗3个月低于治疗 1个月(P<0.05)。
2.4 临床治疗情况
94例NSCLC患者中,CR 4例,PR 27例,SD 18例,PD 45例,治疗有效率为32.98%。治疗有效率为32.98%。接EGFR基因突变型患者治疗有效率为64.86%,高于EGFR基因野生型的12.28%(P<0.05)。NSCLC患者中治疗有效31例,无效63例;治疗有效 患 者 的 MIC-1水 平 为(837.34±76.35)pg/ml,无效患者的MIC-1水平为(1128.31±102.38)pg/ml。两者的MIC-1水平比较,差异有统计学意义(t=22.089,P=0.000),治疗有效患者的MIC-1水平低于治疗无效患者,见图1。
2.5 血清MIC-1水平与NSCLC患者总生存率的关系
以1390pg/ml为临界值分为≤1390pg/ml组(59例)和>1390pg/ml组(35例),≤1390pg/ml组和>1390pg/ml组3年生存率分别为33.90%(20/59)、14.29%(5/35),两组3年生存率比较,差异有统计学意义(χ2=4.328,P=0.037)。见图2。经ROC曲线绘制和分析,NSCLC患者中位生存时间(median survival time, MST)为17.9个月。当MIC-1临界值为1390pg/ml,预测3年生存率的敏感性和特异性分别为80.1%和69.3%。
2.6 影响靶向治疗NSCLC组中位生存时间的单因素和多因素分析
单因素分析显示,TNM分期、MIC-1水平与NSCLC组MST有关(P<0.05);多因素分析显示,TNM分期、EGFR基因突变及MIC-1水平是影响NSCLC组MST的危险因素。见表2。
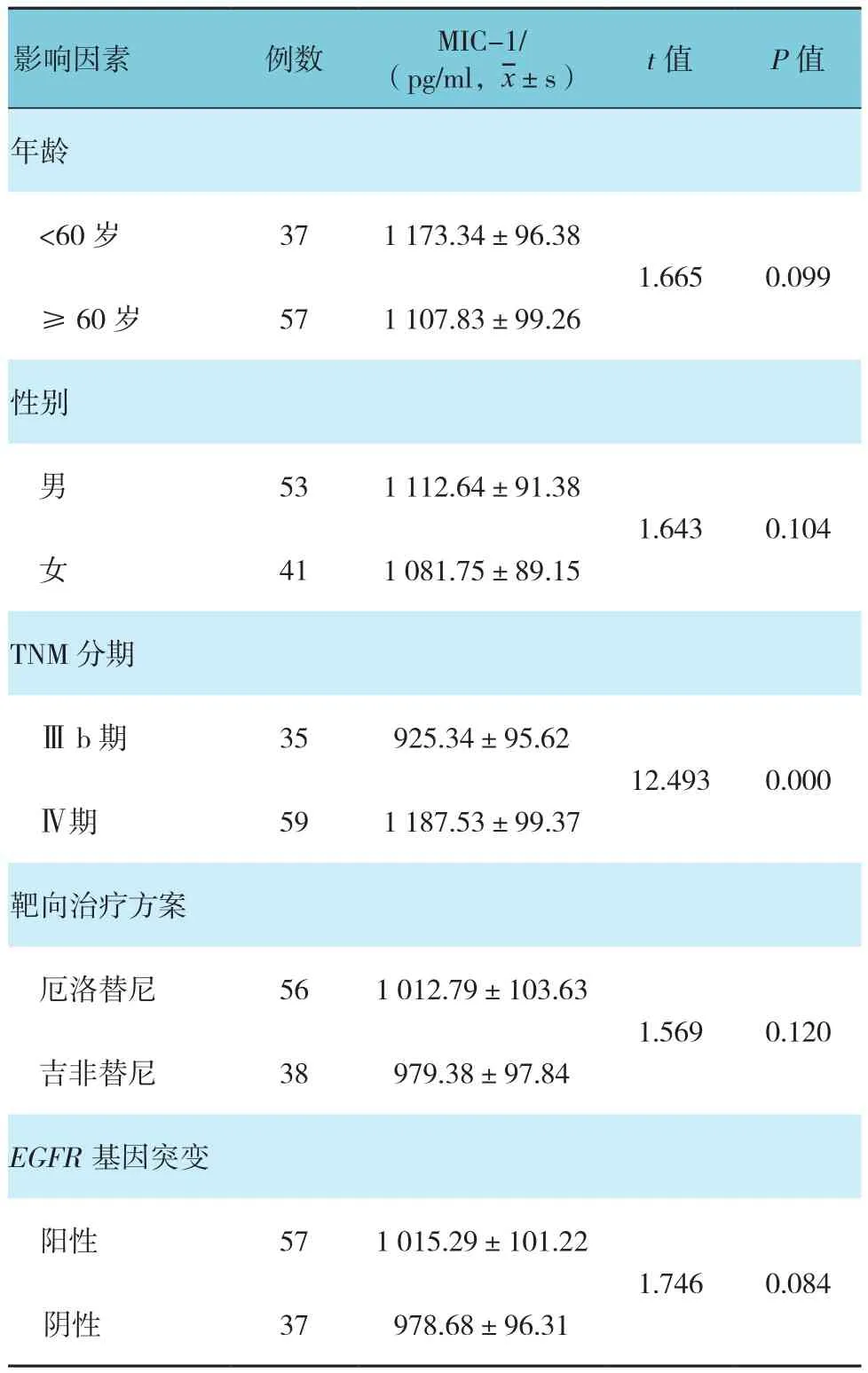
表1 不同病例特征的NSCLC患者血清MIC-1水平比较
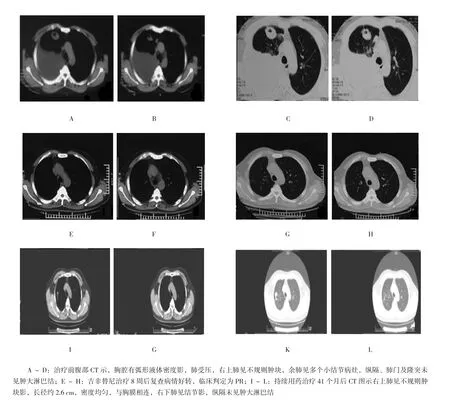
图1 典型病例:男性,50岁,临床诊断右肺上叶腺癌(T4N0M1a)Ⅳ期,右侧胸膜转移,双肺转移
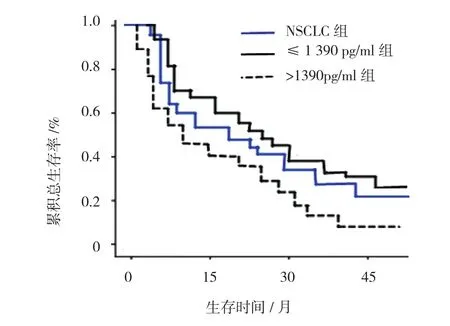
图2 ≤1 390 pg/ml组和>1 390 pg/ml组3年生存率及NSLCC组生存曲线
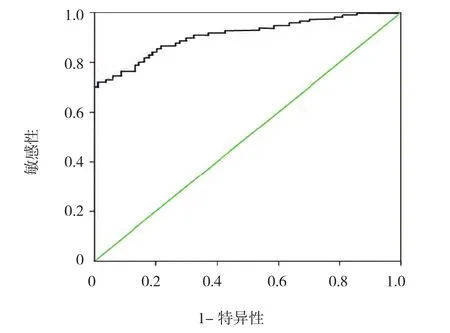
图3 NSCLC患者与对照组患者MIC-1水平ROC曲线
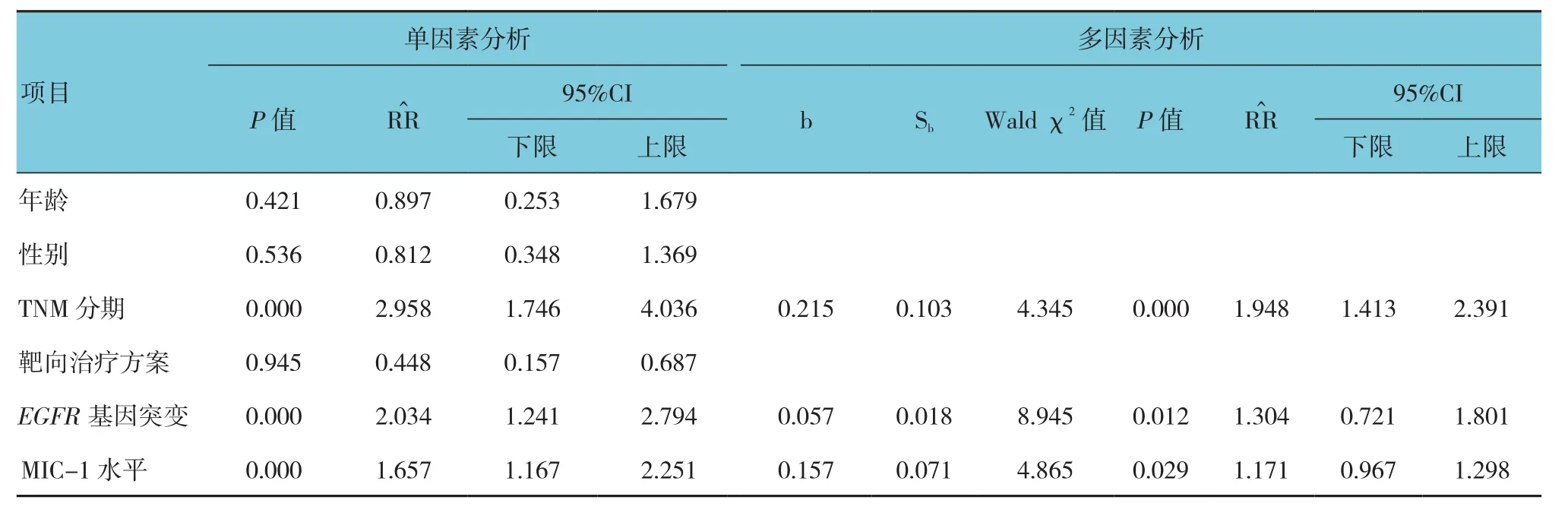
表2 影响靶向治疗NSCLC患者MST的单因素和多因素分析
3 讨论
MIC-1是转化生长因子β超家族的重要成员,在胚胎发育、细胞外基质形成及组织损伤修复等中起重要作用。正常人体内MIC-1呈稳定低水平表达,但在炎症细胞刺激、癌症进展及机体应激反应等作用下,MIC-1表达上调。MIC-1在恶性肿瘤发展过程中起双向调节作用,癌症早期MIC-1可通过诱导肿瘤细胞凋亡,抑制肿瘤生长;癌症中晚期会促使癌细胞远处转移,在肿瘤进展中起重要参与作用[7]。多项研究指出,胃癌、结肠癌及肝癌等患者MIC-1水平高表达[8]。刘力新等[9]指出,肺癌患者MIC-1水平高于健康者。邵丹琪等[10]认为,MIC-1在子宫内膜癌组织中呈高表达,阳性率≥90%,且与淋巴结转移密切相关。陆兴热等[11]指出,胃癌患者MIC-1水平呈高表达,吴佳等[12]通过ROC曲线绘制和分析,指出约登指数最大时,MIC-1临界值为574 pg/ml,诊断胃癌的敏感性和特异性分别为82%和83%。本研究发现,NSCLC组MIC-1水平最高,说明MIC-1可能参与NSCLC发生、进展。
中晚期NSCLC无法行手术治疗,接受传统化疗的有效率也较低。随着临床对NSCLC患者潜在致癌驱动基因的识别(如EGFR、KRAS基因图片及RET融合基因等),靶向治疗成为临床治疗中晚期无法手术NSCLC患者的有效手段之一[13]。目前,NSCLC靶向治疗主要集中在EGFR抑制剂和ALK抑制剂,其安全性和有效性已得到临床证实。吉非替尼、厄洛替尼为第一代表皮生长因子受体酪氨酸激酶抑制剂,有利于延长晚期中位生存周期。郭惠庄等[14]采用厄洛替尼治疗中晚期NSCLC的有效率为35.5%。2015年美国国立综合癌症网络指南指出,口服吉非替尼与厄洛替尼治疗进展的患者仍可从继续治疗中获益,停止服药后疾病进展加快[15]。本文选择吉非替尼或厄洛替尼进行靶向治疗。
本研究中,MIC-1可用于评估NSCLC患者靶向治疗疗效。马洪波等[16]指出,MIC-1阳性率与胰腺癌患者临床治疗效果有关。多项研究报道显示,EGFR基因突变位点主要集中在外显子18、19、21,这些位点的基因突变可引起EGFR酪氨酸激酶活性增强[17]。PETERS等[18]指出,EGFR基因突变情况与NSCLC组靶向治疗效果密切相关。本研究分析EGFR基因突变与靶向治疗近期疗效的关系,发现突变型患者治疗有效率高于野生型,与既往研究结果一致[19]。
国外一项研究指出,口服吉非替尼与厄洛替尼靶向治疗的Ⅲ期NSCLC组中位疾病无进展生存时间、总生存时间无差异[20],与本研究结果相符。多因素分析显示,MIC-1可作为评估NSCLC组预后的重要指标之一。MEHTA等[21]指出,高MIC-1水平预示着结直肠癌患者有更高的死亡率。刘宇宁等[22]分析MIC-1对NSCLC组预后的预测价值,发现MIC-1可能是影响患者预后的独立危险因素。除MIC-1外,NSCLC组TNM分期、EGFR基因突变情况也与患者预后密切相关,与韦文娥等[23]和高月霞等[24]研究结果一致。
本研究存在一定局限性(单中心、小样本研究及随访时间短),因此还需进行大规模、前瞻性及多中心研究,提高研究结果客观性。本研究选取Ⅲb期、Ⅳ期NSCLC患者,MIC-1水平与NSCLC患者临床病理特征的关系可能存在偏倚,有待选取Ⅰ、Ⅳ期NSCLC患者作进一步分析。
综上所述,MIC-1可作为一种新的肿瘤标志用于辅助NSCLC早期诊断、疗效评估及预后预测。
