塞来昔布对急性出血坏死性胰腺炎炎症介质的影响
2018-07-10李明轩王忠琼西南医科大学临床医学院四川泸州646000西南医科大学附属医院四川泸州646000
李明轩,辛 辰,王忠琼,△(.西南医科大学临床医学院,四川泸州646000;.西南医科大学附属医院,四川泸州646000)
重症急性胰腺炎(SAP)是临床常见的急腹症,其起病急、病情重、进展快、病死率高、预后相对较差。近年来的研究表明,促炎性细胞因子及炎症介质介导的炎症级联反应在急性胰腺炎(AP)发生、发展中发挥着重要作用,在胰腺局部和胰腺外脏器功能的损害中扮演重要角色,与全身炎症反应综合征(SIRS)乃至多器官功能不全的发生、发展密切相关[1]。塞来昔布(Celecoxib)是新一代的非甾体解热、镇痛、抗炎药物,其可选择性抑制环氧化酶2(COX-2)的生成和活性,使得前列腺素类物质的合成与释放减少,尤其是前列腺素E2的抑制作用,从而发挥生物学效应。本研究拟采用急性出血坏死性胰腺炎(AHNP)大鼠模型,观察其血清中炎症介质的动态变化,并观察COX-2特异抑制剂Celecoxib的干预效应,期望对临床治疗AHNP提供新的思路。
1 材料与方法
1.1实验材料健康成年SD大鼠,体重100~150 g,由西南医科大学动物实验中心提供。L-精氨酸购自Sigma公司,Celecoxib购自Searle公司,血清一氧化氮(NO)测试盒(硝酸还原法)购自南京建成生物工程研究所,肿瘤坏死因子α(TNF-α)放射免疫测试盒购自解放军总医院东亚免疫技术研究所,BET-32M内毒素测定仪购自天津大学无线电厂。
1.2方法
1.2.1实验分组将36只SD大鼠随机分为对照组(S组)、AHNP组和Celecoxib预处理组(C+AHNP组),每组 12 只,观察 4 个时相点(3、6、12、24 h),每个时相点3只。实验开始前12 h,三组大鼠均严格禁食,但不禁饮。AHNP组:10%戊巴比妥(4 mL/kg)腹腔注射,选择中上腹正中切口开腹,暴露胰腺和十二指肠,依次找到肝门、胆总管,并用动脉夹夹闭,使用4号半针头穿刺进入胆胰管,距离约0.5 cm,以250 mg/kg的剂量缓慢注入20%的无菌L-精氨酸,并立即夹闭远端胆胰管,数分钟后可见胰腺组织充血、肿胀,松开动脉夹使胆胰管复通,立即用纱布压迫穿刺孔,查无胆漏后关腹。S组:经胆胰管逆行注射等量灭菌生理盐水,其他操作同AHNP组。C+AHNP组:用灭菌注射用水配制成1.0%的Celecoxib溶液,充分混匀后,以100 mg/kg剂量在诱导AHNP前1小时灌胃,其他操作不变。在相应时相点处死大鼠。
1.2.2样本收集及处理
1.2.2.1血液样本处死大鼠前心脏采血5 mL,以2 000 r/min离心,取得上清液即血清1.5~2.0 mL,-20℃冰箱中保存备用。每组自然死亡大鼠不行上述步骤。
1.2.2.2血清NO测定采用硝酸还原酶法测定血清NO水平,按操作说明依次加入试剂后,混旋均匀,室温下静置15 min,蒸馏水调零,上机检测(540 nm,0.5 cm光径)各管吸光度值(OD值)。计算公式如下:

1.2.2.3血清TNF-α检测采用放射免疫分析法(RIA)。使用放射测定仪计数放射性核素标记的汞-铅,即cpm值,通过剂量反应曲线(标准曲线)得出样本抗原含量,cpm值与样品内测定抗原浓度呈负相关。
1.2.2.4血清内毒素测定根据内毒素与鲎试剂反应产生凝胶的原理,采用动态浊度法定量检测血清内毒素含量,通过生成凝胶的时间(临界时间,T)来反映内毒素水平。方法如下。(1)实验准备:为了除去可能存在的外源性内毒素,使用250°干烤实验器具,时间为2 h。(2)标准曲线的绘制:准备1支20 EU细菌内毒素标准品,精确加入1 000µL单层分子水(BET),振荡混匀15 min,使浓度为20.0 EU/mL,依次稀释成内毒素标准溶液,浓度分别为 4.00、1.50、0.50、0.05 EU/mL,每一个浓度组分别吸取250µL于反应试管中,并加入1 500µL鲎试剂,混合均匀,快速插入内毒素仪检测孔,测定T。每一浓度作2个平行试管,设置BET为阴性对照。(3)实验曲线的绘制:取大鼠血浆1 500µL,并加入200µL生理盐水和200µL Tris-HCl缓冲液混匀,100℃水浴锅加热共8 min,3 000 r/min离心8 min,取上清液200µL,加入200µL鲎试剂中,其浓度为0.5 EU/mL,混合均匀后迅速插入内毒素仪检测孔,测定T,每一浓度作2个平行试管。
1.3统计学处理应用SPSS24.0统计软件进行数据分析,计量资料以表示,采用t检验;独立样本采用Mann-Whitne检验及多样本非参数比较。P<0.05为差异有统计学意义。
2 结 果
2.1各组大鼠血清NO水平的动态变化S组大鼠血清NO水平在3、6 h较高,6 h后缓慢下降;AHNP组大鼠血清NO水平呈逐渐增高趋势,12 h前缓慢上升,12 h后明显增高;在3、6 h均明显低于其余两组,12 h的水平与S组相近,但24 h的水平明显高于S组,差异均有统计学意义(P<0.05);C+AHNP组大鼠血清NO水平在3、6 h与S组相近,但显著高于AHNP组,12 h后达到高峰,随后下降,在24 h与S组接近,同时显著低于AHNP组。三组24 h的NO水平比较,差异无统计学意义(P>0.05)。见表1、图1。
表1 各组大鼠各时相点血清NO水平比较(±s,µmol/L)

表1 各组大鼠各时相点血清NO水平比较(±s,µmol/L)
注:与 S 组比较,aP<0.05;与 AHNP 组比较,bP<0.05
组别3 h 6 h 12 h 24 h S组AHNP组C+AHNP组n 3 3 3 NO 36.60±3.97 18.86±4.41a35.69±9.81bn 3 3 3 NO 38.30±3.20 24.70±1.62a38.60±4.84bn 3 3 3 NO 34.68±4.14 35.81±1.43a63.06±1.99bn 3 3 3 NO 31.84±1.28 47.85±0.23 33.61±7.38
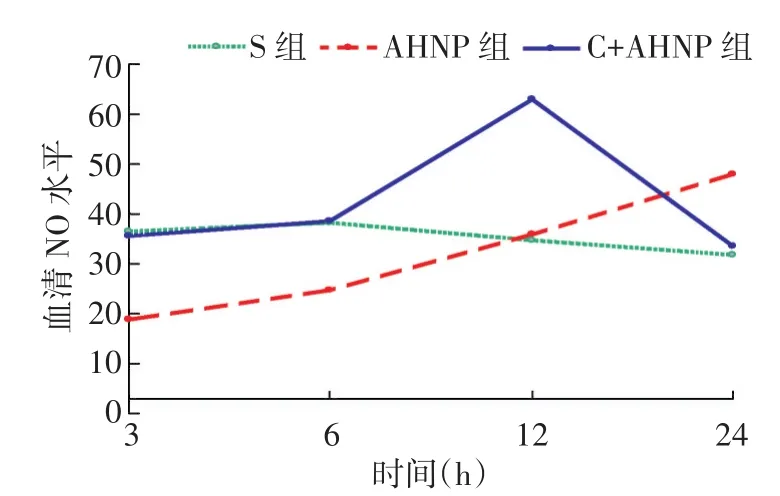
图1 各组大鼠各时相点血清NO的动态变化
2.2各组大鼠各时相点血清TNF-α水平动态变化AHNP诱导3 h后,血清TNF-α水平显著增高,呈时间依赖性;而C+AHNP组在各个时相点有所降低,但是其作用强度逐渐加强,6 h最强,12 h后逐渐减弱,见图2。与S组比较,AHNP组大鼠各时相点TNF-α水平明显升高,差异均有统计学意义(P<0.05);而C+AHNP组大鼠各时相点TNF-α水平明显低于AHNP组,但仅6、12 h时差异有统计学意义(P<0.05),3、24 h时差异无统计学意义(P>0.05)。见表2、图3。
表2 各组大鼠各时相点血清TNF-α水平比较(±s,ng/mL)
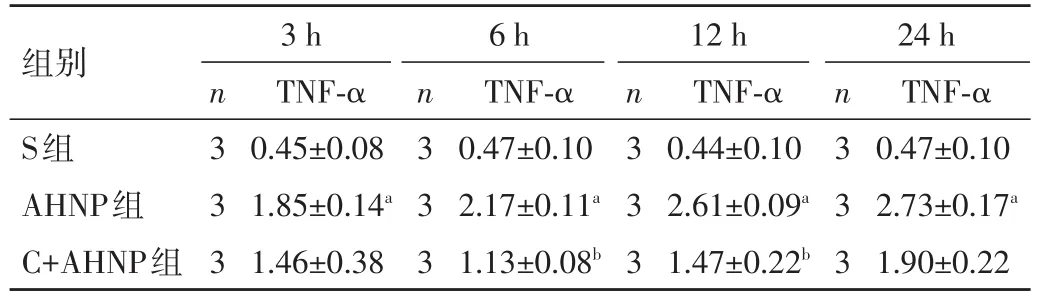
表2 各组大鼠各时相点血清TNF-α水平比较(±s,ng/mL)
注:与 S组比较,aP<0.05;与 AHNP 组比较,bP<0.05
组别S组AHNP组C+AHNP组3 h 6 h 12 h 24 h TNF-α 0.47±0.10 2.73±0.17a1.90±0.22n3 3 3 TNF-α 0.45±0.08 1.85±0.14a1.46±0.38n3 3 3 TNF-α 0.47±0.10 2.17±0.11a1.13±0.08bn3 3 3 TNF-α 0.44±0.10 2.61±0.09a1.47±0.22bn3 3 3

图2 C+AHNP组降低大鼠血清TNF-α水平的动态变化
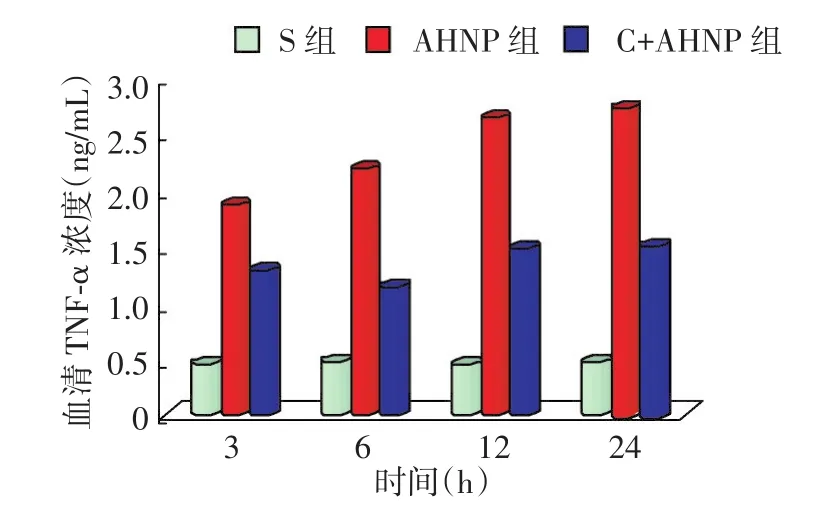
图3 各组大鼠血清TNF-α水平的动态变化
2.3各组大鼠血清内毒素水平的变化使用线性回归法分析内毒素标准品浓度与反应T,设计标准曲线方程为:lgT=2.835 02+(-0.250 96 lgN),相关系数(r)=-0.996 3(要求r<-0.98),显示内毒素在 0.04~5.00 EU/mL,与 T 呈线性关系。AHNP组血清内毒素水平持续升高,尤其12 h后上升最明显,S组与AHNP组各时相点内毒素水平比较,差异均有统计学意义(P<0.05),C+AHNP 组与AHNP组各时相点内毒素水平比较,差异均无统计学意义(P>0.05)。见表3、图4。
表3 各组大鼠各时相血清内毒素水平变化(±s)

表3 各组大鼠各时相血清内毒素水平变化(±s)
注:与S组比较,aP<0.05
组别S组AHNP组C+AHNP组S组AHNP组C+AHNP组S组AHNP组C+AHNP组S组AHNP组C+AHNP组n3 3 3 3 3 3 3 3 3 3 3 3时相点3 h 6 h内毒素水平(10-5EU/mL)5.67±0.19 61.94±8.04a54.98±3.81 5.58±0.51 222.82±40.99a249.61±12.95 6.40±0.47 276.57±29.39a222.70±83.68 5.92±0.45 995.24±161.59a847.73±31.92 12 h 24 h T(s)7 957.86±67.343 4 372.89±142.901 4 501.55±79.847 7 997.39±81.442 3 178.98±145.402 3 078.59±40.814 7 724.31±143.321 3 004.21±86.176 3 152.24±28.227 7 874.56±147.339 2 182.53±86.920 2 250.17±38.044

图4 各组大鼠血清内毒素水平比较
3 讨 论
AP起病后体内胰酶、细胞因子及炎症介质大量释放,形成SIRS,抗炎性细胞因子同步产生,促炎-抗炎平衡紊乱,胰腺弥漫性出血和组织坏死,最终导致病情不断恶化[2]。有研究认为,各种细胞因子并非直接发挥作用,而是通过调节COX-2的表达来启动炎性反应[3]。因此,如果抑制COX-2,就有可能改变AP体内的炎症介质的表达,改善患者预后。
NO参与血管炎性反应、免疫反应,并与炎症免疫细胞因子相互调节。AP是多种免疫细胞参与的炎症免疫反应。生理剂量的NO可以舒张血管平滑肌,增加维持胰腺血流灌注,抑制血小板聚集等,而过量的NO直接导致血管难治性扩张,胰腺灌注减少,加重胰腺组织损伤。此外,NO也有增加血管通透性的作用,与组织水肿有一定的关系[4-7]。可见,在AP的病情进展中,NO表现出双重生物学行为[8-10]。本研究观察了AHNP造模后3、6、12、24 h大鼠血清NO水平的动态变化,结果发现在3、6 h,AHNP组明显低于S组,但随后上升显著,于12 h与后者持平,并继续增高,在24 h显著高于S组,呈现先降低后升高的现象。C+AHNP组在3、6 h与S组血清NO水平十分接近,12 h明显增高,随后逐渐下降,24 h接近后者,呈现先升高后降低的双相变化,提示Celecoxib可通过调节NO水平,显著改善微循环,增加组织血流灌注,减轻缺血、缺氧性损伤,改善全身炎性反应和器官组织损伤。
TNF-α激活巨噬细胞并促进其释放,在炎症级联放大效应中发挥主要作用,是导致AP并发SIRS的主要促炎性细胞因子。其结果是引起代谢亢进、微血管损伤、血流动力学障碍等一系列病理生理改变,甚至导致器官衰竭[11-15]。本研究结果显示,AHNP诱导后3 h,血清TNF-α水平即显著增加,并呈进行性增高趋势;而Celecoxib预处理后各时相点血清TNF-α水平均显著降低,其中以3、6 h的作用强度较高,表明Celecoxib有助于改善全身炎性反应、下调器官功能损伤。
有研究发现,在SAP发病早期,因全身大量炎症介质、细胞因子的释放,肠道黏膜屏障功能受损,肠源性内毒素移位,形成内毒素血症,对血管内皮细胞和巨噬细胞均具有损伤和活化作用,反馈激发更多炎症介质的释放,故内毒素是加重AP的重要因素[16-18]。本研究结果显示,S组大鼠血清内毒素水平极低,仅有微量且动态恒定;在AHNP组造模后3 h,血清内毒素水平显著增高,呈持续增高趋势,尤其在12 h增高最为明显,表明在SAP发病后相对较晚时期,内毒素发挥主要损伤作用。而在炎性反应的早期,内毒素水平无明显变化,波动较小,因此,Celecoxib对AP后内毒素水平无明显影响,但是否通过激活某种细胞内信号转导通路发挥抗炎作用,尚需进一步研究。
综上所述,Celecoxib在AHNP中具有抑制TNF-α、双向调节NO等炎症介质的转录与释放作用,是AP治疗的新思路。