豫南烟区烟草青枯病菌拮抗内生细菌的筛选及其防病效果初探
2018-07-10李小杰李成军胡亚静李淑君白静科陈玉国
李小杰,李成军,胡亚静,李淑君,邱 睿,白静科,陈玉国
(河南省农业科学院 烟草研究所 烟草行业黄淮烟区烟草病虫害绿色防控重点实验室,河南 许昌 461000)
烟草青枯病是由青枯雷尔氏菌(Ralstoniasolanacearum)引起的危害世界烟草生产的重要根茎部细菌性病害,在我国长江流域及其以南烟区普遍发生,造成了巨大损失[1-2]。同时由于气候等方面的原因,该病害已向北扩展蔓延。截至目前,在河南、安徽、山东、陕西等地已有烟草青枯病的发生并造成不同程度的损失[3-6]。
在生产上防治烟草青枯病主要依赖化学农药,且到目前为止尚无有效的化学药剂可防治青枯病。另外,大量使用化学农药不仅污染环境,而且破坏生态[7-8]。随着烟草及其制品逐渐向绿色安全化方向发展,生物防治成为烟草病害防治研究的热点,尤其是全国烟草绿色防控重大专项的启动实施,为烟草病害的防治提供了新思路和新方法,为烟区农产品质量和生态环境安全提供了有力保障。
用于植物病害生物防治的因子有很多,总体来说主要包括拮抗微生物、抗生素和植物诱导因子等,其中拮抗微生物的种类主要有细菌、真菌、放线菌和病毒等。关于生防细菌的筛选,大多数是从土壤或健康植物根际土壤中分离,这些土壤微生物的拮抗效果常受到外界环境的影响而稳定性较差[9]。目前利用内生细菌防治烟草青枯病受到国内外专家的广泛关注,并有很多相关文献报道[10-12],这些研究结果表明,大部分的内生细菌不仅可以抑制病原菌生长,同时还具有促生作用等[13-14],且拮抗效果稳定,具有很好的开发应用前景。但这些生防菌大多还处于试验阶段,实现商品化应用的很少。因此,在不同生态环境及不同植物中挖掘和发现新的有益内生细菌是很有必要的。豫南烟区是河南省烟草青枯病的发生区,为了得到对烟草青枯病菌具有较好拮抗效果且稳定的内生细菌菌株,本研究对豫南烟区烟草栽培品种中烟100和云烟87的内生细菌进行了大量分离筛选和鉴定,并对其拮抗效果进行了初步分析,为河南烟区烟草青枯病的生物防治提供理论依据。
1 材料和方法
1.1 试验材料
1.1.1供试烟草品种豫南烟区烟草栽培品种中烟100和云烟87,培育至5~6片真叶备用。
1.1.2供试菌株烟草青枯病菌菌株TXLLJ14-3由烟草行业黄淮烟区烟草病虫害绿色防控重点实验室分离纯化,用30%甘油保存于-80 ℃冰箱。
1.1.3供试培养基拮抗细菌的分离、培养用LB培养基,烟草青枯病菌的培养用NA培养基。
1.1.4供试试剂拮抗细菌总DNA提取、16S rDNA片段扩增所用试剂均购自天根生化科技有限公司。
1.2 试验方法
1.2.1内生细菌的分离与纯化分别取健康烟草的根、茎0.1 g进行表面消毒,然后用无菌水漂洗1次,再用有效氯为1%的次氯酸钠溶液浸泡3 min,立即转入无菌水中漂洗4次。将消毒好的根或茎放入灭菌的研钵中进行研磨,研磨液离心后取上清用无菌水进行不同梯度的稀释。取稀释后的液体0.1 mL 涂布于LB培养基上,置于28 ℃恒温培养箱中培养。挑取培养特征明显不同的单菌落,于LB平板进行划线纯化,将纯化好的菌株保存于4 ℃冰箱备用。
1.2.2拮抗细菌的筛选将NA培养基冷却至45 ℃左右,按2%的比例加入过夜培养的烟草青枯病菌菌株TXLLJ14-3(浓度为1×1010cfu/mL),摇匀后倒平板,用无菌牙签在每个平板上均匀点接5个左右的参试内生菌株,置于恒温培养箱中,28 ℃培养48 h后观察并测定抑菌圈直径。选取抑菌圈明显或对病原菌生长影响较大的菌株保存备用。复筛方法同初筛,再次筛选抑菌圈大且效果稳定的菌株。
1.2.3拮抗细菌的16S rDNA 鉴定用细菌基因组DNA提取试剂盒提取拮抗菌株的基因组DNA,并以细菌16S rRNA基因的通用引物[4](F: 5′-AGAGTTTGATCCTGGCTCAG-3′,R: 5′-AAGGAGGTGATCCAGCCGCA-3′)对菌株的16S rRNA基因进行PCR扩增,引物由上海生工生物有限公司合成。PCR反应体系(25 μL)为:Taq酶0.3 μL,10×Buffer(Mg2+)2.5 μL,dNTP(2.5 mmol/L)2 μL,引物各1 μL,模板1 μL,ddH2O 17.2 μL。PCR反应条件为:95 ℃ 5 min;95 ℃ 45 s,56 ℃ 40 s,72 ℃ 90 s,28个循环;72 ℃延伸10 min。用1%琼脂糖凝胶对PCR 扩增产物进行电泳检测,测序后将结果在NCBI上进行Blast比对,并选择同源性较高的序列用MEGA软件的Neighbor-Joining法构建系统发育树。
1.2.4不同方式处理的拮抗菌Rsa3发酵液对烟草青枯病菌的抑制作用测定将拮抗菌Rsa3在LB液体培养基中28 ℃培养24 h后,分别配制成拮抗菌LB发酵液(OD600=1.0)、拮抗菌无菌水悬液(OD600=1.0)、无菌发酵液(0.22 μm滤膜过滤),同时采用梯度稀释法,分别制备10-1、10-2、10-3、10-4稀释发酵液,用移液器吸取2 μL点接于含2%烟草青枯病菌的NA培养基平板上,置于恒温培养箱中,28 ℃培养48 h后观察并测定抑菌圈直径。
1.2.5盆栽接种试验将烟苗移栽于盛有无菌土的花盆中,5~7 d后每株浇10 mL拮抗菌发酵液100倍液(1×109cfu/mL),24 h后接种烟草青枯病菌,采用伤根灌根法,每株灌菌悬液(3×108cfu/mL)10 mL,设置3个重复,每个重复接种10株烟苗,3 d后再浇施1次拮抗菌发酵液,用量及浓度与第1次相同,以清水为空白对照。接种后观察烟株的发病情况,其分级标准参照全国烟草行业烟草病害调查分级标准YC/T 39—1996进行。病情指数和防治效果按烟草病害药效试验方法YC/T 40—1996计算。
青枯菌在烟苗组织内的含菌量测定:于接种后15 d取样,取样部位为烟株茎基部。每0.1 g样本加入1 mL无菌水进行充分研磨,按10倍梯度稀释,分别取不同稀释液0.1 mL涂布于TTC培养基上,28 ℃培养72 h后进行平板菌落计数,然后换算成每克鲜质量青枯菌数。公式如下:
青枯菌活菌数(cfu/g)=
1.2.6拮抗细菌发酵液促进烟苗根系生长的测定将中烟100的种子用拮抗菌发酵液(浓度为3×108cfu/mL)进行浸种处理,然后置于MS培养基上,于(25±2)℃、光照12 h/d、光强3 000 lx条件下培养。待种子萌发后,用相同浓度的拮抗菌发酵液再喷雾1次,以清水作对照,每个处理3个重复。取生长20 d的幼苗,用直尺测量其根系长度。
1.3 数据分析
使用分析软件DPS 7.05进行差异显著性检验,采用Duncan’s新复极差法进行多重比较。
2 结果与分析
2.1 烟草青枯病菌拮抗内生细菌的分离和筛选
采用平板梯度稀释法共分离出208株内生细菌菌株,经过初筛和复筛,共得到9株对烟草青枯病菌具有拮抗效果的细菌菌株,其编号分别为Rsa3、Rsa14、Rsa22、Rsa30、Rsa31、Rsa39、Rsa118、Rsa164、Rsa167,其中菌株Rsa3、Rsa22、Rsa30、Rsa39的拮抗效果较好(图1),尤其以Rsa3的抑菌效果最好,抑菌圈半径达到7 mm,且在转移5~6代后,其抑菌能力无明显变化。
2.2 拮抗菌的16S rRNA 基因序列分析
将拮抗菌的16S rRNA基因序列在GenBank数据库中进行比对分析,然后通过MEGA 6.0软件绘制系统发育树。结果表明,筛选出的9株拮抗菌可归为3个不同的属。菌株Rsa3、Rsa22、Rsa30、Rsa31、Rsa39、Rsa164、Rsa167的16S rRNA基因序列与假单胞菌属(Pseudomonas)同源相似度都在98%以上,其中拮抗效果最强的内生细菌菌株Rsa3与荧光假单胞菌(Pseudomonasfluorescens)属于同一进化分支(图2);菌株Rsa14的16S rRNA 基因序列与解淀粉芽孢杆菌(Bacillusamyloliquefaciens)同源相似度为99%;菌株Rsa118的16S rRNA 基因序列与节杆菌属(Arthrobacter)同源相似度为93%。
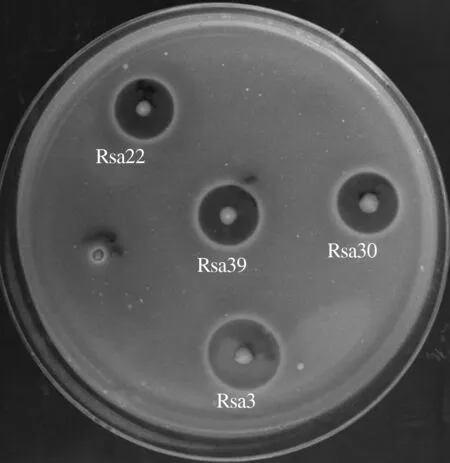
图1 烟草青枯病菌拮抗内生细菌的平板筛选结果
2.3 不同方式处理的拮抗菌Rsa3发酵液对烟草青枯病菌的拮抗效果
不同方式处理的Rsa3拮抗菌发酵液对烟草青枯病菌的平板抑制效果不同,其中拮抗菌LB发酵液和拮抗菌无菌水悬液对烟草青枯病菌具有较强的抑制作用,而无菌发酵液对烟草青枯病菌几乎没有抑制效果(图3A)。当拮抗菌LB发酵液稀释1 000倍时,拮抗效果几乎没有变化,稀释到10-5时对烟草青枯病菌仍具有抑制效果(图3B)。由此可以说明,拮抗菌Rsa3对烟草青枯病菌具有较好的抑制效果,且其抑制作用主要在于菌体本身,而非其代谢产物。
2.4 拮抗菌Rsa3发酵液对烟草青枯病的防治效果
选取对烟草青枯病菌拮抗作用最强的菌株Rsa3进行盆栽接种试验,从结果可以看出,接种后10 d,浇施拮抗菌发酵液处理的烟株未见发病症状。接种后15 d,浇施拮抗菌发酵液处理的烟株明显比对照烟株发病轻(图4A),拮抗菌Rsa3对青枯病的平均防治效果达79.17%(表1)。

图2 拮抗内生细菌的系统发育树

A:不同方式处理的Rsa3发酵液对烟草青枯病菌的抑制效果(1.拮抗菌Rsa3 LB发酵液;2.拮抗菌Rsa3 无菌水悬液;3.无菌发酵液);B:不同浓度的拮抗菌Rsa3 LB发酵液对烟草青枯病菌的抑制效果

A:接种后15 d不同处理的烟株发病情况;B:接种后15 d不同处理的烟株体内菌量统计分析

处理接种后10 d发病率/%病情指数防治效果/%接种后15 d发病率/%病情指数防治效果/%Rsa30B0B100.0012.50B11.11B79.17CK80.00A26.67A-80.00A53.34A-
注:同列不同大写字母表示差异达1%显著水平。
接种后15 d烟株体内的菌量分析结果表明,浇施拮抗菌发酵液处理的烟株体内青枯病菌含量明显比对照烟株体内的青枯病菌含量低,且两者之间具有极显著差异(图4B)。由此说明,拮抗菌Rsa3对烟草青枯病有较好的室内防治效果,具有潜在的应用价值。
2.5 拮抗菌Rsa3发酵液对烟苗根系的促生长效果
从图5可以看出,烟草种子经Rsa3发酵液处理后20 d,烟苗根系平均长度为6.0 cm,明显比对照(平均根长为2.3 cm)长。结果初步表明,拮抗菌Rsa3具有促进烟苗根系生长的能力。

图5 拮抗菌Rsa3对烟苗根系的平板促生效果
3 结论与讨论
本研究从豫南烟区烟草栽培品种中烟100和云烟87的根茎中分离烟草青枯病菌的拮抗内生细菌,利用平板共培养法筛选出9株对烟草青枯病菌具有较好拮抗效果的细菌菌株,其中菌株Rsa3对烟草青枯病菌的抑菌效果最好,抑菌圈半径达7 mm,且拮抗效果稳定。通过分子生物学手段,将拮抗菌Rsa3鉴定为荧光假单胞菌(Pseudomonasfluorescens)。该菌对烟草青枯病菌有明显的拮抗作用,且这种拮抗作用主要在于菌体本身,而非其代谢产物。拮抗菌Rsa3对烟草青枯病具有较好的防治作用,在温室盆栽试验中防病效果达到79.17%,具有较大的应用价值。
生物防治已成为现代农业生产中防治有害生物的一项重要措施,目前青枯病的生物防治措施主要包括利用无致病力菌株和拮抗微生物等,其中利用拮抗菌对青枯病进行防治的研究很多,尤其是内生拮抗细菌[13,15-17]。但由于拮抗菌的生长容易受环境和寄主植物的影响,因此分离适合当地植物病害防治的拮抗菌是必要和有益的。本研究从豫南烟区烟草栽培品种中烟100和云烟87的根茎中分离筛选到9株对烟草青枯病菌具有拮抗效果的细菌菌株,为豫南烟区烟草青枯病的生物防治奠定了有力基础。
目前研究报道,分离到的植物内生细菌主要有芽孢杆菌属(Bacillus)、黄单胞菌属(Xanthomonas)、假单胞菌属(Pseudomonas)、欧文氏菌属(Erwinia)及短小杆菌属(Curtobacterium)等,其中以芽孢杆菌属内生细菌对植物病害防治的报道较多[18-21]。本研究分离筛选到9株烟草青枯病的拮抗内生细菌菌株,其中有7株为假单胞菌属,1株为节杆菌属,还有1株为芽孢杆菌属,这与前人的报道[18-21]一致,同时也初步说明防治豫南烟区烟草青枯病的拮抗内生细菌的优势种群为假单胞菌属。本研究中属于荧光假单胞菌的细菌菌株Rsa3对烟草青枯病菌的抑菌效果最好,且拮抗效果稳定,同时对烟草青枯病具有较好的室内防治效果,可作为烟草青枯病生防菌的候选资源。
有研究表明,假单胞菌的作用机制之一是通过可泌出胞外的细菌素、抗生素等次生代谢产物实现[22],其中假单胞菌中的著名抑菌活性物质申嗪霉素在国内已实现商品化[23-24]。但在本研究中,荧光假单胞菌Rsa3对烟草青枯病菌的拮抗作用主要在于菌体本身,而非其代谢产物,分析原因可能是不同地域、不同寄主植物中分离到的细菌菌株不同,其抑菌机制也就不同。
拮抗菌的防病和促生作用大都是相辅相成的,充分开发和利用自然界中的拮抗菌,可有效保护和促进植物生长。本研究筛选获得的拮抗细菌菌株Rsa3对烟草青枯病具有较好的抑菌和防病作用,同时对烟苗的根系有明显的促生长效果,具有较高的开发利用价值。
