NaClO2/尿素复合吸收剂脱除SO2和NO反应动力学
2018-07-09陈琴珠王学生
刘 炼, 陈琴珠, 王学生, 衡 涛, 弓 辉
(华东理工大学 机械与动力工程学院,上海 200237)
0 引 言
SO2和NOx的排放量随着中国能源工业的发展不断增长,预计不到3年其年排放总量将超过0.5亿t[1]。为了降低SO2和NOx(95%以上的NOx以难溶于水的NO形式存在)的排放量,学者对干法、生物法和湿法等脱除方法进行了许多的研究[2],其中,湿法脱硫脱硝系统是先进的空气污染控制技术之一,其中包括氧化法、还原法、络合法和碱液吸收法等[3]。常见的液体吸收剂有Fe(II)EDTA、Co(II)(NH3)6、H2O2、NaClO2、KMnO4等,其中,NaClO2吸收率高,水解过程中生成的ClO2可以将NO氧化为NO2[4],提高NOx的氧化度,促进了反应吸收[5],并且其废水相对易于管理,只需调整其pH值和COD即可排放[6]。目前,有学者[7-11]在NaClO2中加入NaClO、NaOH、Ca(OH)2、(NH4)2CO3等添加剂进行脱硫脱硝研究,研究发现,在NaClO2溶液中添加适当浓度的弱碱性溶液更有助于NOx的吸收[12]。其中,尿素呈弱碱性[13],成本较低,且与NaClO2在弱碱和酸性条件下不发生反应[14]。因此,在成本较高的NaClO2强氧化剂中加入单独使用脱硝的能力较差尿素复配,用来脱除烟气中的SO2和NO,以更低的成本下实现较高的脱除效率。
本文研究了NaClO2/尿素复合溶液脱除SO2和NO的宏观反应动力学,探索吸收过程中的反应数率常数、分级数和活化能等参数,为工业应用提供参考依据。
1 脱除原理及动力学基础
1.1 反应机理

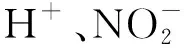
NaClO2(aq)+2SO2(g)+2H2O(l)→
2H2SO4(aq)+NaCl(aq)
(1)
2(NH2)2CO(aq)+2SO2(g)+O2(g)+
4H2O(l)→2(NH4)2SO4(aq)+2CO2(g)
(2)
3NaClO2(aq)+4NO(g)+2H2O(l)→
4HNO3(aq)+3NaCl(aq)
(3)
2(NH2)2CO(aq)+6NO(g)→5N2(g)+
2CO2(g)+4H2O(l)
(4)
1.2 化学反应动力学研究方法
SO2和NO的脱除效率按下式计算,
η=[(Cin-Cout)/Cin]×100%
(5)
式中:η为脱除效率;Cin、Cout分别为进口和出口浓度。
对于任一反应,反应物的消耗数率可以用以下方程式[18]来表达:
(6)
式中:υA为组分A的消耗速率;CA、CB、CC分别为反应物A、B、C的浓度;α、β、γ分别表示反应组分A、B、C的反应级数,量纲为一;k为组分A的反应速率常数,定义为一个有量纲的量,该数值不受浓度的影响,能够直接反映组分消耗的快慢。
由此可以根据烟气浓度随温度的变化曲线得出反应数率常数和组分的反应分级数。
在NaClO2/尿素复合吸收系统中,相对吸收气体,NaClO2与尿素的浓度是过量的,其浓度和溶液中的H2O变化可忽略不计。因此,反应物SO2和NO的反应速率方程可以分别转化为:
(9)
(10)
阿累尼乌斯(Arrhenius)公式给出:
(11)
式中:R为摩尔气体常数,数值为8.314 J/(mol·K);Ea为反应活化能,表示发生化学反应的难易程度,数值为反应需克服的能量障碍,其本身为与温度无关的常数,J/mol;A为指前因子,不受反应条件影响,由本身的化学性质决定,同k量纲一致。
将式(11)进行积分变换转化得:
(12)
因此,由式(8)~(10)根据反应气体在不同的浓度下的反应速率进行线性拟合,即可求得NaClO2/尿素复合吸收剂脱除SO2和NO的反应级数与反应数率常数;同时,根据式(11)、(12)可知,通过两个温度下的lnk-1/T的关系,求出反应的活化能Ea与指前因子A。
2 实 验
2.1 实验装置与流程
图1为实验流程图,整个实验平台由烟气模拟单元、反应单元、监测分析单元三部分构成。实验流程:通过调节各个转子流量计,让SO2、NO和N2等气体按一定比例进入缓冲瓶中混合稀释,制得模拟烟气;混合气体从喷淋塔底部稳定地以预设流量逆流进入,预先配置好的复合吸收液在循环泵的作用下从储液槽流至喷淋塔顶部于喷嘴喷出,从而进行气液反应。使用烟气分析仪分别对进口烟气和出口烟气浓度进行测量,采用加热器对复合吸收液的加热来控制整个反应温度,利用H2SO4-NaOH缓冲液调节复合吸收体系的pH。

1-氧气瓶,2-氮气瓶,3-NO气瓶,4-SO2气瓶,5-转子流量计,6-气体缓冲瓶,7-烟气分析仪,8-喷淋塔,9-加热器,10-储液槽,11-循环泵
图1 实验流程示意图
2.2 仪器与试剂
实验所用的仪器、设备及其规格:转子流量计(LZB-10W),烟气分析仪(Testo350),温控仪(JTC-905),pH计(PHS-3C),循环泵(chlf4-20),电子天平(MP5002)。试剂及纯度要求:NaClO2≥90%,尿素≥99.0%,硫酸AR,氢氧化钠AR,N2≥99.99%,O2≥99.99%,SO2≥99.99%,NO≥99.99%。
3 结果与讨论
3.1 温度对SO2 和NO反应速率的影响
3.1.1温度对SO2反应速率的影响
SO2初始浓度为2.0 g/m3,NO的初始浓度为0.5 g/m3,烟气总流量为150 L/h,NaClO2浓度为4 mmol/L,尿素浓度为0.5 mol/L,吸收液流量为3 L/h,氧含量为6%,溶液pH值为7,温度分别为20 ℃、40 ℃、50 ℃、60 ℃时,对应的SO2的浓度随时间的变化关系如图2所示。
由图2可知,低于50 ℃时,反应温度越高SO2消耗速率也越大;超过50 ℃时,SO2脱除速率缓慢下降。这是由于在一定范围内,温度的升高提高了分子活化程度,促进了单位时间内活化分子有效碰撞,增加了反应接触面积,使得反应速率增大。当超过50℃时,复合吸收剂中尿素水解的反应速率增加,有效吸收成分降低,从而使吸收反应速率下降。因此,SO2反应吸收的最适温度为50 ℃,此时,反应速率最快。
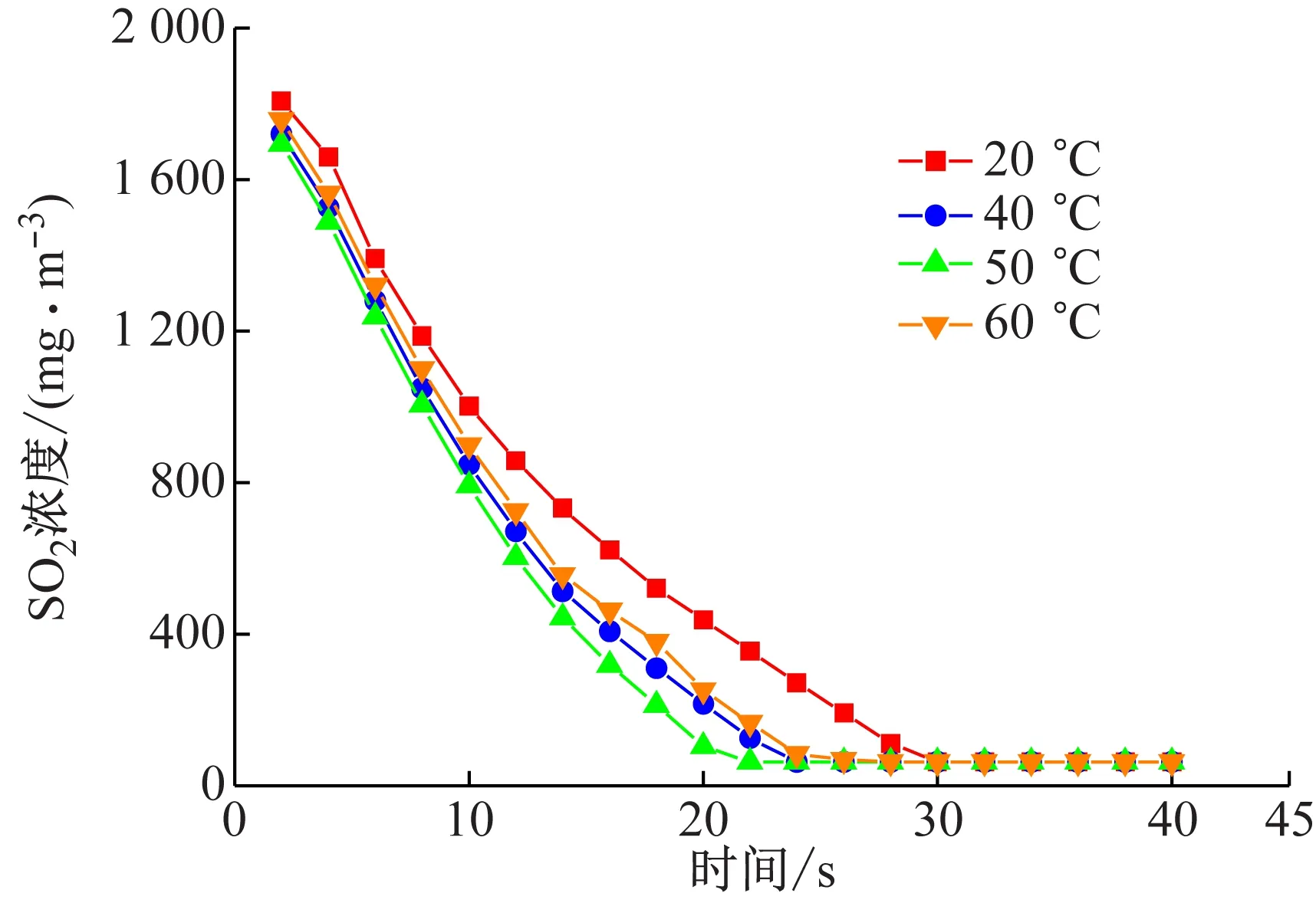
图2 温度对SO2反应速率的影响
3.1.2温度对NO反应速率的影响
SO2初始浓度为2.0 g/m3,NO的初始浓度为0.5 g/m3,烟气总流量为150 L/h,NaClO2浓度为4 mmol/L,尿素浓度为0.5 mol/L,吸收液流量为3 L/h,氧含量为6%,溶液pH值为7,当反应温度分别为20 ℃、40 ℃、50 ℃、60 ℃时,对应的NO浓度随时间的变化关系如图3所示。

图3 温度对NO反应速率的影响
由图3可知,NO的脱除率在20 ℃时最低,为90.2%,在50 ℃时达到最高值95.3%。此外,低于50 ℃时,温度越高NO脱除得越快,但超过50 ℃时,NO脱除速率缓慢下降。与SO2的脱除同理,当提高反应温度,相当于提高了单位时间单位面积内的有效碰撞,使得促进反应吸收。超过50 ℃时,NO脱除率和反应速率均下降,主要是由于原始烟气中的NO、NaClO2水解产生的氧化性能更高的ClO2以及反应中间产物NO2、N2O3等气体的在溶液中溶解度迅速降低;温度升高还提高了HNO2的分解;同时,在这个阶段NaClO2与可能与尿素发生副反应;所以,温度超过一定范围反而阻碍了NaClO2/尿素溶液与烟气中NO的反应吸收。综上,NO反应吸收的最适温度为50 ℃,此时,反应速率最快。
3.2 烟气初始浓度对SO2 和NO反应速率的影响
3.2.1SO2初始浓度对反应速率的影响
实验条件:NO的初始浓度为0.5 g/m3,烟气总流量为150 L/h,NaClO2浓度为4 mmol/L,尿素浓度为0.5 mol/L,吸收液流量为3 L/h,氧含量为6%,溶液pH值为7时,反应温度为50 ℃,SO2初始浓度分别为0.5、1.0、1.5、2.0、3.0 g/m3时,SO2的浓度随时间的变化关系如图4所示。
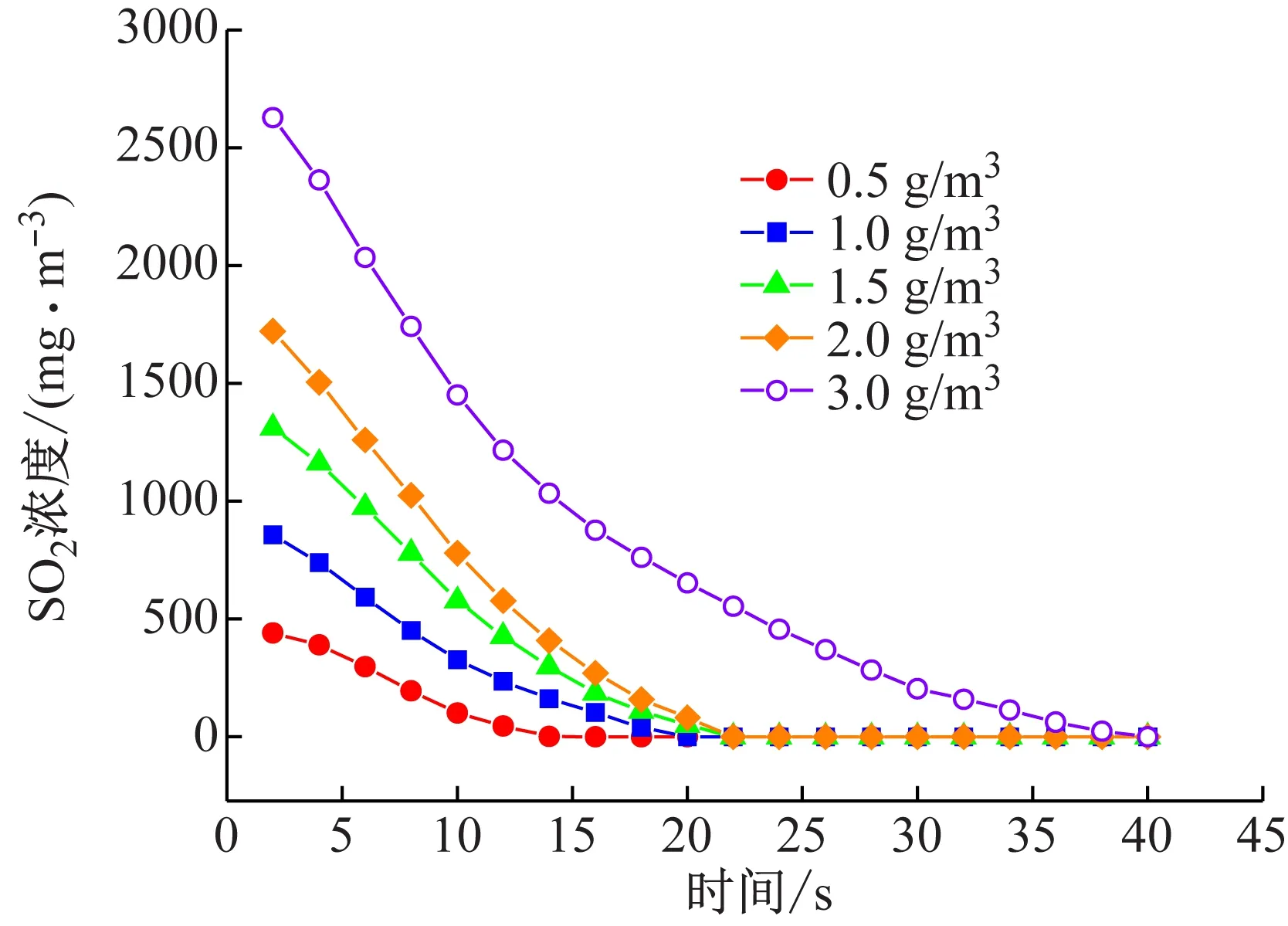
图4 SO2浓度随时间的变化
在图4中,SO2浓度不断降低,脱除率可达99%;图中各条曲线的各点的切线斜率即为此时SO2的反应速率。SO2的反应速率由大变小,其主要原因是随反应的进行,复合吸收液中有效成分浓度不断下降;且在反应体系中,SO2气体的分压不断减小,从而降低了SO2在气膜中的扩散速率,所以SO2反应速率也在缓慢降低。由此根据反应速率大小将整个吸收过程分为快、慢2个区间。在快速反应区中,SO2初始浓度越大其气相推动力也大,所以它的反应速率大;而在慢速反应区也仍在维持相对缓慢的动态反应。
3.2.2NO初始浓度对反应速率的影响
实验条件:SO2初始浓度为2.0 g/m3,烟气总流量为150 L/h,NaClO2浓度为4 mmol/L,尿素浓度为0.5 mol/L,吸收液流量为3 L/h,氧含量为6%,溶液pH值为7时,反应温度为50 ℃,NO的初始浓度分别为0.10,0.43,0.50,0.73,0.93 g/m3时,NO浓度随时间的变化关系如图5所示。
在图5中,NO浓度不断降低,每条曲线上的各点的切线斜率即为此时NO的反应速率,NO的反应速率随时间的增加不断减小,并且存在一个明显的转折点,将该过程分为快、慢速两个反应区。在不同NO初始浓度下,20 s内反应速率都较快;NO的反应速率由大变小,其主要原因是随反应的进行,NaClO2和尿素浓度不断下降;且在反应体系中,NO气体的分压不断减小,从而降低了NO在气膜中的扩散速率,所以NO反应速率也在缓慢降低。而在慢速反应区也仍在维持缓慢的动态反应。

图5 NO浓度随时间的变化
3.3 SO2 反应动力学
3.3.120℃时SO2反应分级数
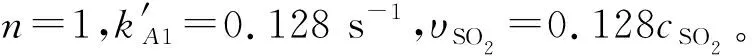

图6 温度为20 ℃快速反应区SO2分级数

3.3.250℃时SO2反应分级数
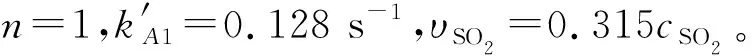
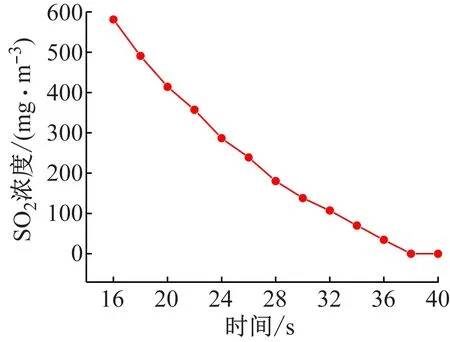
图7 温度为20 ℃慢速反应区SO2分级数

图8 温度为50 ℃快速反应区SO2分级数
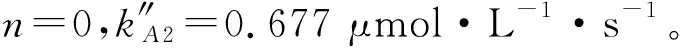

图9 温度为50 ℃慢速反应区SO2分级数
因此,由上面分别求得快、慢速反应区两个不同温度下各个动力学参数,根据式(12)计算得到快速反应区里SO2的Ea为23.62 kJ/mol,在慢速反应区Ea为12. 40 kJ/mol。
3.4 NO反应动力学
3.4.120℃时NO反应分级数
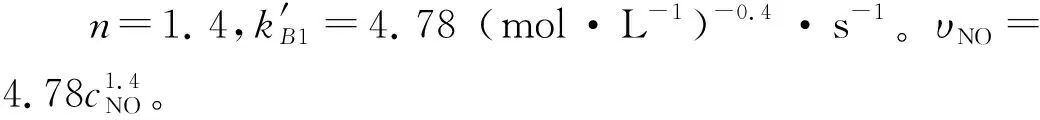


图10 温度为20 ℃快速反应区NO分级数

图11 温度为20 ℃慢速反应区NO分级数
3.4.250℃时NO反应分级数

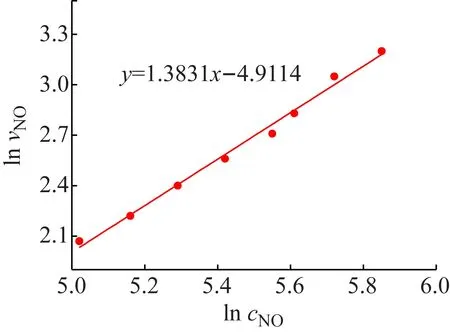
图12 温度为50 ℃快速反应区NO分级数

因此,由上面分别求得的在快、慢速反应区的两个不同温度下各个动力学参数,根据式(12)计算得到快速反应区里NO的Ea为10.78 kJ/mol,在慢速反应区Ea为2.96 kJ/mol。

图13 温度为50 ℃慢速反应区NO分级数
4 结 论
本文从宏观反应动力学的角度出发,研究了SO2和NO在复合剂吸收过程中反应分级数、速率常数及表观活化能等参数。结果表明:
(1) NaClO2/尿素复合吸收剂去除烟气中的SO2和NO的过程均存在快、慢速两个反应区。且在快速反应区中,SO2和NO的初始浓度越大,它的反应速率也越大。
(2) 分别研究了在复合吸收体系中SO2与NO的反应分级数,并由此计算了它们的反应数率常数。快速反应区中, SO2在20 ℃和50 ℃时的反应级数均为1,NO在同样两个温度下的分级数均为1.4;而在慢速反应区中,两种气体在不同温度下的分级数均为0。
(3) 研究了SO2和NO的表观活化能。在快速反应区,SO2表观活化能Ea为23.62 kJ/mol,在慢速反应区,SO2表观活化能Ea为12.40 kJ/mol;在快速反应区,NO的Ea为10.87 kJ/mol,在慢速反应区,NO的Ea为2.96 kJ/mol。
参考文献(References):
[1] 鱼智霞.中国大陆区域2020、2030年SO2、NOx排放总量情形预测[D].西安:西安建筑科技大学,2016.
[2] 赵 毅,刘 凤,赵 音,等.亚氯酸钠溶液同时脱硫脱硝的热力学研究[J].化学学报,2008,66(15):1827-1832.
[3] 耿春香,张 雨,刘文蓉,等. EDTA-(NH4)2FeSO4络合剂脱除烟气中的氮氧化物[J].环境工程学报,2012, 6(12):4615-4618.
[4] 谢 珊,李新杰,高宏亮,等.ClO2溶液去除烟气中NO的效果及工程应用[J].化工环保,2016,36(1):84-89.
[5] 乔慧萍,杨 柳.湿法同时脱硫脱硝工艺中脱硝吸收剂的研究现状[J].电力环境保护, 2009,25(1):1-3.
[6] Wei Jinchao, Yu Ping, Cai Bo,etal. Absorption of NO in aqueous NaClO2/Na2CO3solutions[J]. Chem Eng Echnol, 2009, 32(1): 114-119.
[7] Chu Hsin, Chien Tsung-Wen, Twu Bour-Wei. Simultaneous absorption of SO2and NO in a stirred tank reactor with NaClO2/NaOH solutions[J].Water, Air and Soil Pollu, 2003, 143(1): 337-350.
[8] 赵 静. NaClO2/NaClO复合吸收剂烟气脱硫脱硝一体化技术及机理研究[D].杭州:浙江工业大学,2012.
[9] Chu Hsin, Chien Tsung-Wen, Twu Bour-Wei. The absorption kinetics of NO in NaClO2/NaOH solutions[J]. Journal of Hazardous Materials, 2001, 84(2-3): 241-252.
[10] Sada Eizo, Kumazawa Hidehiro, Tsubol Norio,etal. Absorption of NO in aqueous mixed solutions of NaClO2and NaOH[J]. Chem Eng Sci, 1978, 33(3): 315-318.
[11] 张小波. NaClO2/(NH4)2CO3溶液脱除SO2和NO的基础研究[D].上海:上海电力学院,2012.
[12] 赵 音.新型复合吸收剂液相同时脱硫脱硝的实验研究[D].北京:华北电力大学,2011.
[13] 尹凤交.尿素/Ca(ClO)2湿法同时脱硫脱硝技术的试验研究[D].济南:山东大学,2007.
[14] Wei Jinchao, Luo Yunbai, Yu Ping. Removal of NO from flue gas by wet scrubbing with NaClO2/(NH2)2CO solutions[J]. Journal of Ind and Eng Chem, 2009, 15(1): 16-22.
[15] 刘 凤. 喷射鼓泡反应器同时脱硫脱硝实验及机理研究[D]. 北京:华北电力大学(河北), 2009.
[16] Zhao Yi, Guo Tianxiang, Chen Zhouyan,etal. Simultaneous removal of SO2and NO using M/NaClO2complex absorbent[J]. Chem Eng Journal, 2010, 160: 42-47.
[17] Fang Ping, Cen Chaoping, Tang Zhixiong,etal. Simultaneous removal of SO2and NOxby wet scrubbing using urea solution[J]. Chem Eng Journal, 2011,168(1): 52-59.
[18] 许 越. 化学反应动力学[M]. 北京:北京化学上业出版社,2005.
