仪器法检测碱性磷酸酶的测量不确定度的评估
2018-07-09李升和宁康健姜锦鹏
李 磊,刘 畅,李升和,宁康健,姜锦鹏
(安徽科技学院动物科学学院 农业农村部猪肉质量安全控制重点实验室,安徽 凤阳 233100)
碱性磷酸酶(alkaline phosphatase,ALP)可以通过水解磷酸单酯,从而去掉核酸、蛋白质、生物碱等底物分子中的磷酸基团,同时生成自由基。ALP广泛存在于组织与体液中,又以骨组织、肝脏、乳腺等分布浓度最高,是一组同工酶而非单一酶。当上述组织器官出现病变时,ALP的活性显著增强,因此,通过测量血清中的ALP值,可有效反映相关脏器组织的状态。ALP的检测是临床重要的检测项目,对于诊断相关脏器的病变状态具有重要的作用。
测量不确定度作为与测量结果相联系的重要参数,可表征被测量值的分散性,具有合理性。近年来,测量不确定度的应用场景不断增加,在越来越多的正式场合中替代相对偏差(SD)来表述结果的可信程度。越来越多的研究人员认为测量结果中应附有不确定度的说明,这样的结果才是完整且有意义的,不确定度在一定程度上决定了测量结果的可信程度。根据ISO 15189的相关要求,承担临床检测任务的实验室应该对临床检测结果的测量不确定度进行评估。
该研究依据计量技术规范JJF 1059.1—2012《测量不确定度评定与表示》的相关要求,以ALP检测为例,对全自动血清生化分析仪检测血清中ALP的检测结果不确定度进行评定,探讨在检测过程中测量不确定度的评定过程,熟悉测量不确定度在仪器法检测血清学指标中的应用,以期找到合理的表征仪器法检测结果不确定度的评定模式。

表1 CV内数据结果
1 材料与方法
1.1 仪器与试剂
全自动血液生化分析仪 (深圳迈瑞生物医疗电子股份有限公司);ALP测定试剂盒 (批号:140317001);常规生化复合校准品 (批号:150117001,标定浓度为212 U/L);常规生化复合定值质控品(批号:050217002,标定浓度为77.8U/L);质控血清由笔者所在实验室提供。
1.2 测定过程
试验过程中,按照仪器使用说明书对仪器进行维护和保养,确保仪器的性能状态良好;以仪器使用说明书及项目的SOP进行检测,质控规则选择westgard多规则。
1.3 检测方法
全自动血液生化分析仪对于ALP测定主要采用AMP缓冲液法。该方法的检测原理如反应方程式所示:
磷酸对硝基酚+对硝基酚+磷酸盐
该反应生成的对硝基酚可引起405 nm处吸光度上升,其变化速率与ALP的活性成正比。因此,可用下式计算ALP浓度。
ΔA/min=ΔA/min样本管/校准管-ΔA/min空白管
1.4 测量不确定度来源分析
对不确定度进行分析时,仍是从人员、设备、材料、方法及环境进行分析。由于使用全自动检测设备,并且根据检测方法的原理,影响吸光度变化率值的主要因素是检测体系中的质控品的定值。根据仪器操作规程,上式中的样本管可以是样品或质控品。最终所测得的ΔA/min不确定度由以下分量组成:①批内精密度引入的不确定度分量CV内;②批间精密度引入的不确定度分量CV间;③偏倚(正确度)引入的不确定度分量CVbias。其中CV内、CV间、CVbias需要通过检测获取,计算公式如下:
(1)方法学偏倚带来的不确定度:

式中▽为相对差值平均值为测定次数,ai%为测定值与已知定值的相对偏差;xi为质控血清实验室测定值,xs为质控血清的已知定值;SD为相对差值标准差
(2)合成不确定度:
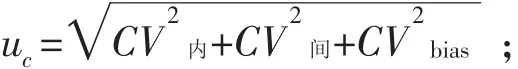
(3)扩展不确定度:U=kuc,取 95%置信水平时,k=2,U=2uc。
2 结果与分析
2.1 评定测量不确定度分量
2.1.1 CV内测定结果:单日内,对质控品重复测定30次,对所得ALP质控结果计算标准差和变异系数,其变异系数即为CV内,具体数据结果见表1。
2.1.2 CV间测定结果:整理收集2016年1月—2017年9月期间的质控品质控数据,统计分析ALP质控结果,计算SD和CV,该CV即为CV间,结果见表2。
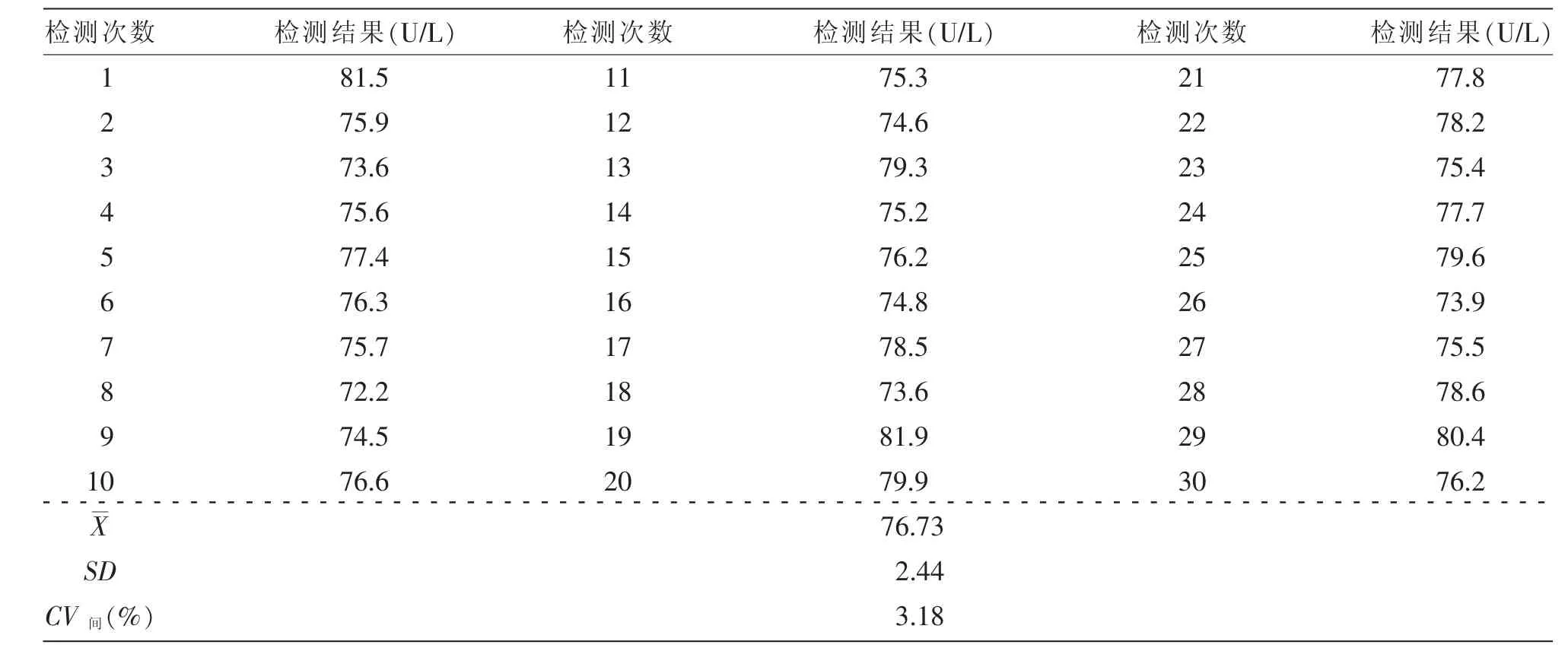
表2 CV间数据结果
2.1.3 CVbias测定结果:单日内重复测定质控样本血清,连续测定5次,通过质控样本血清的已知定值来计算CVbias,具体数据结果见表3。
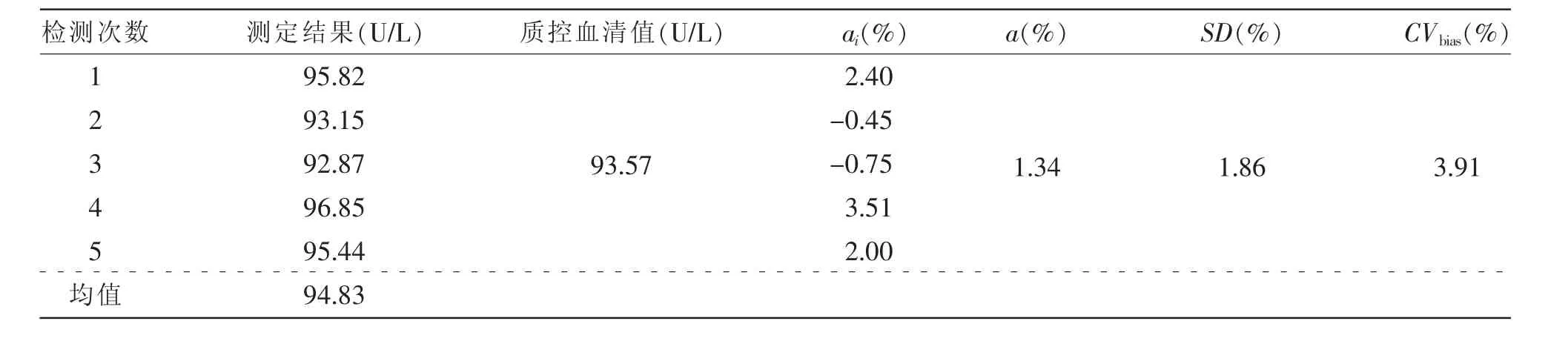
表3 CVbias数据结果
2.2 合成不确定度及拓展不确定度
根据上述结果得到的CV内、CV间与CVbias,按照下式可计算出合成不确定度uc及相对拓展不确定度U:
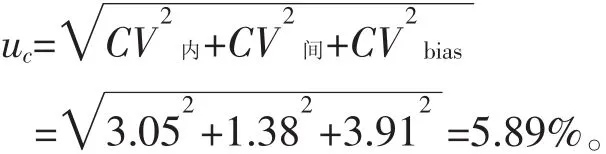
当置信区间为 95%时,k=2,则 U=kuc=2×5.89%=11.78%。
2.3 检验结果表达
质控样本血清测量均值为94.83 U/L,则uc=94.83×6.12%=5.59 U/L;U=2×5.80=11.18 U/L;ALP含量测定结果:(94.83±11.18)U/L(k=2)。
3 讨论
近年来,随着实验室认可制度的大力推广,不确定度的概念及应用不断普及,越来越多的检测实验室及检测人员对于不确定度的认知更加全面,在临床相关领域的应用不断加大。同一检测项目在不同实验室间的结果互认对于实现检验一致化和标准化至关重要,这也是实验室认可及循证检验医学的基本要求。
作为一项系统性的工作,检测工作涉及多个环节[1],检测结果的不确定度来源广泛,人、物、设备、方法、环境等各方面都是产生不确定度的因素,而这些环节产生的不确定度分量的大小并不一致,因此,需要对这些不确定度在分析之后进行计算,最终形成合成不确定度[2-3]。测量不确定度的应用对于将实验室检测结果控制在一个合理范围内具有重要作用[4]。通过对人员、机器、材料、方法、环境等方面进行分析[5-8],对检测过程中的各环节所形成的不确定度的分量进行确定,并计算uc及U。通过研究不确定度分量对uc贡献的大小,不仅可以确定影响检测结果质量的主要因素,更可以有针对性地进行控制并改善相关因素,实现检验工作的持续改进[9],从而提高检测质量,保证实验室数据的可信度。
该研究以测量不确定度相关规范为基础[10-11],以血清中ALP含量检测为研究指标,对全自动血液生化分析仪的测量不确定度进行了研究,通过开展试验,计算、整理、分析、试验数据,确定CV内、CV间、CVbias等指标的不确定度大小,最终获得uc及U,为判断相关动物的生理状态以及计算其他指标提供值得借鉴的思路。
[1]刘密凤,刘蔚,郭海,等.临床生物化学指标测量不确定度的评估 [J]. 检验医学与临床,2013,10(23):3153-3154.
[2]李新建.酶联免疫法检测血清丙肝抗体的测量不确定度的评估[J].中国输血杂志,2013,26(7):630-632.
[3]WHITE G H,FARRANCE I.Uncertainty of measurement in quantitative medical testing:a laboratory implementation guide[J].Clin Biochem Rev,2004,25(4):1-24.
[4]徐润灏,张洁.8项生化指标测量不确定度评估及允许范围的初步研究[J].上海交通大学学报(医学版),2016,36(12):1777-1783.
[5]梅敏,李海珠,帅虎.血清谷丙转氨酶、谷草转氨酶测定分析中的测量不确定度评定 [J].实验与检验医学,2010,28(4):371-372.
[6]吕赛平,刘琴,王春阳,等.自建检测系统测定血清总蛋白测量不确定度的评估 [J].实验与检验医学,2014,32(2):137-138.
[7]崔骊,李向东.酶标分析仪检定结果的不确定度分析评定[J].中国医学装备,2017,14(11):42-44.
[8]李娴,季伙燕,苏建友,等.14项临床化学检验指标分析前不确定度评定[J].临床检验杂志,2014,32(6):460-462.
[9]吴斌,李一松,贺勇,等.25项临床生物化学指标测量不确定度的评估 [J]. 临床检验杂志,2012,30(5):378-379.
[10]赵芳,季伙燕,李海泉,等.医学实验室血清球蛋白不确定度评定[J].中国现代医生,2015,53(27):8-11.
[11]WESTGARD J O.Managing quality vs.measuring uncertainty in the medical laboratory [J].Clin Chem Lab Med,2010,48(1):31-40.
