Uhrf1与Dppa3相互作用调节印记基因的表达
2018-07-09杜娟吴博殷松娜史海燕王爱红赵菊梅
杜娟,吴博,殷松娜,史海燕,王爱红,赵菊梅
(延安大学医学院生物化学与分子生物学教研室,延安 716000)
印记基因是子代体细胞中仅父源或母源一方同源等位基因表达而另一方不表达的基因,主要存在于真兽类哺乳动物和有袋类动物中。个体发育过程中,基因印记在子代配子形成过程中建立,配子携带的亲本印记在受精、卵裂过程中一直保持,至胚胎发育为8细胞和囊胚期时,亲本印记在性腺中发生大规模擦除[1]。早期胚胎发育过程中,印记基因对胎儿和胎盘的生长具有调节作用,单一染色体来源的核移植胚胎因只含父源或母源一方染色体基因,印记基因表达异常,胚胎不能正常发育[2,3];个体发育过程中,印记基因与组织器官的建成、肿瘤等疾病的发生、发展相关,印记基因的缺失或异常表达可使组织器官发育异常,促进肿瘤的形成和发展[4-6]。因此,探究印记基因的表达调控机制有助于胚胎发育、肿瘤疾病的发生发展等生理、病理过程揭示作用机制。
印记基因的表达主要受甲基化调控。胚胎发育过程中发育多能关联3(developmental pluripotency associated 3,Dppa3,又称为Stella或Pgc7)能够抑制Tet2和Tet3介导的母源基因组去甲基化, 维持父源基因组中特定印记区的DNA甲基化状态[7];Uhrf1(又称为NP95)是连接DNA甲基化与组蛋白甲基化的枢纽,能够与增殖细胞核抗原、G9a、Dmnt1等协同作用促进DNA的甲基化[8,9]。Dppa3和Uhrf1对DNA甲基化的维持和促进作用提示:Dppa3和Uhrf1协同表达可能对印记基因的表达具有调节作用。前期研究中,我们通过蛋白质免疫共沉淀联合质谱分析法发现人HEK293T细胞中Dppa3与Uhrf1存在相互作用[10],然而二者相互作用是否对胚胎发育过程中印记基因的表达具有调控作用还不清楚。本研究拟通过Dppa3和Uhrf1外源表达载体的构建探究二者协同作用对印记基因表达的影响,以期为印记基因的表达调控提供研究基础。
材料与方法
1 材料
小鼠畸胎瘤F9细胞系购自中国科学院细胞库,培养于0.1%明胶包被的含10%胎牛血清(FBS,Gibco),100μmol/L非必须氨基酸和2mmol/L L-谷氨酰胺的DMEM培养液中。小鼠胚胎干细胞系J1购自美国模式培养物集存库(American Type Culture Collection,ATCC),培养于0.1%明胶包被的C57BL/6×129小鼠胚胎干细胞完全培养基(购自赛业生物科技有限公司)中。
2 质粒构建
为了构建Uhrf1过表达载体pCMV-Myc-Uhrf1和Dppa3过表达载体pCDH-Flag-Dppa3,以J1小鼠胚胎干细胞为材料,Trizol法提取总RNA,经反转录获得J1细胞的cDNA。以上述cDNA为模板,Uhrf1-EcoR1-F和Uhrf1-Xhol-R,Flag-Dppa3-Nhe1-F和Dppa3-NotI-R分别为扩增引物(引物序列见表1),PCR扩增法获得Uhrf1和Dppa3的表达序列,酶切后分别与pCMV-myc和pCDH-CMV-MCS-EF1-Puro载体连接。将连接产物经热激转化入DH5α菌体中,小提测序鉴定正确后用去内毒质粒提取试剂盒提取Uhrf1和Dppa3的体外过表达载体pCMV-Myc-Uhrf1和pCDH-Flag-Dppa3用于细胞转染。
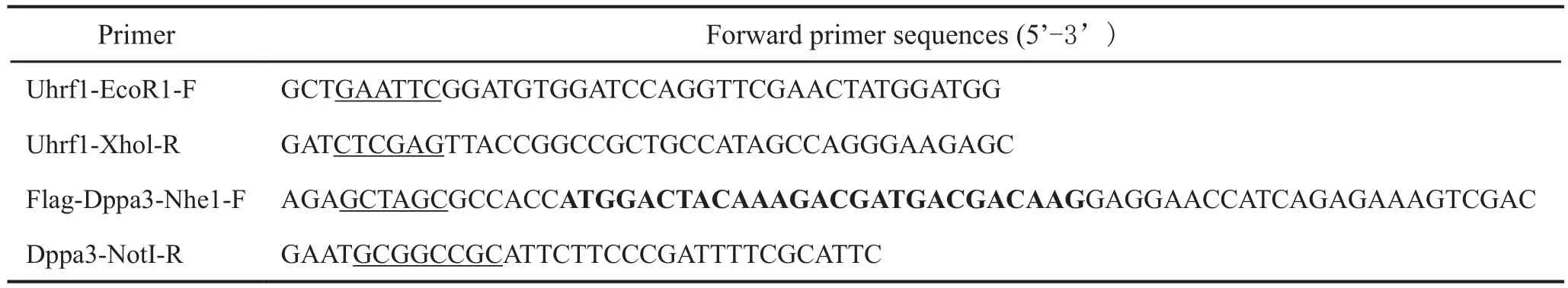
表1 质粒构建引物序列Tab.1 Primer sequences for plasmids construction
3 免疫共沉淀法(Co-IP)
为检测Dppa3与Uhrf1之间是否有相互作用,收集J1细胞,加入含全蛋白酶抑制剂的NP-40细胞裂解液,冰上裂解15min,12000r离心15min,取上清。预留少量裂解物,剩余裂解物分两份,一份加入Dppa3抗体和proteinA+G agarose,另一份加入IgG和proteinA+G agarose,4℃过夜旋转孵育,离心弃上清,用含全蛋白酶抑制剂的NP-40裂解液洗涤上述沉淀3次,向沉淀中加入1×SDS蛋白上样缓冲液,95℃煮10min,8000r/min离心10min,取上清进行Western Blot检测。
4 qPCR检测基因的相对表达量
Trizol法提取各处理细胞总RNA,反转录后获得cDNA。以GAPDH为内参基因,实时荧光定量PCR法检测各基因的相对表达量(内参基因和各基因的定量引物序列见表2)。反应体系如下:2×SYBR premix Ex Taq(10ul),primer(上下游各 1μl),cDNA(1μl), Rox(1μl),加水补至 20μl。反应条件为:[95℃ 3min,(95℃ 5s, 60℃ 30s)×40 cycles](扩增条件),95℃ 5 s,(60℃ 1 min,持续升温至95℃,荧光检测间隔为5℃)(融解曲线测定条件)。各检测基因的表达量变化以2-△△CT进行计算,P<0.05为显著,P<0.01为极显著。

表2 实时荧光定量PCR引物序列Tab.2 Real-time PCR primer sequences
5 免疫荧光染色
脂质体转染法将pCMV-Myc-Uhrf1和pCDH-Flag-Dppa3分别转染至F9细胞中,36h后,PBS洗涤两次,免疫染色固定液室温固定15min,免疫染色洗涤液洗涤3次(每次5min),弃洗涤液,加入免疫染色封闭液室温封闭90min,弃封闭液,分别加入鼠源Myc和Flag标签一抗(1∶500稀释)4℃过夜封闭。弃一抗,分别加入Cy3标记的山羊抗小鼠二抗(1∶500稀释),室温避光孵育2h,免疫染色洗涤液洗涤3次(每次5min),加入DAPI染液,室温避光染核5min,免疫染色洗涤液洗涤3次(每次5min)。倒置荧光显微镜观察法Uhrf1和Dppa3的分布,拍照记录。
结 果
1 小鼠多能性干细胞中Uhrf1与 Dppa3存在相互作用
Uhrf1和Dppa3均参与基因的甲基化修饰,二者是否能够协同作用调节印记基因的表达还不清楚。在前期研究中,为确定Dppa3对胚胎干细胞多能性的调节作用,我们以小鼠J1胚胎干细胞为材料,利用免疫沉淀联合质谱法(Co-IP—MS)分离鉴定了J1细胞中Dppa3的相互作用蛋白,质谱鉴定结果显示Uhrf1与Dppa3存在相互作用[10]。在此,为探究Dppa3和Uhrf1对印记基因表达的调控作用,首先对Dppa3和Uhrf1之间是否存在相互作用进行了验证,结果显示(图1):以小鼠J1胚胎干细胞为实验材料,用Dppa3抗体进行Co-IP,Western Blot可检测到Uhrf1,即Dppa3与Uhrf1蛋白间存在相互作用,二者可能通过协同作用调节基因的表达,该结果与实验室前期研究结果一致。
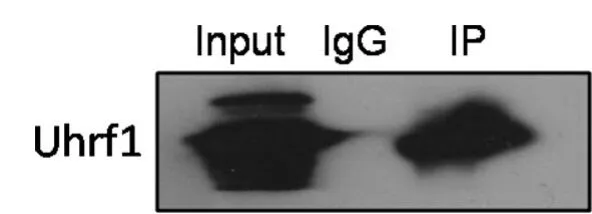
图1 Co-IP检测Dppa3与Uhrf1间的相互作用Fig.1 Interaction between Dppa3 and Uhrf1 was analyzed using co-immunoprecipitation assay
2 Dppa3与Uhrf1协调作用调节印记基因的表达
为探究Dppa3和Uhrf1协同作用对印记基因的表达影响,首先利用基因体外克隆技术构建了Dppa3和Uhrf1的过表达载体pCDH-Flag-Dppa3和pCMV-Myc-Uhrf1。将经测序鉴定正确的Dppa3和Uhrf1表达载体pCDH-Flag-Dppa3和pCMV-Myc-Uhrf1以脂质体转染至F9细胞中,24h后,用Flag和Myc标签抗体对上述细胞进行免疫染色,观察Flag-Dppa3和Myc-Uhrf1在F9细胞中的表达情况。结果显示(图2):体外构建的pCDH-Flag-Dppa3和pCMV-Myc-Uhrf1载体可正常表达Flag-Dppa3和Myc-Uhrf1融合基因,Flag-Dppa3在细胞核与细胞质中均有分布,Myc-Uhrf1仅存在于细胞核中,这与內源Dppa3和Uhrf1的分布一致[11,12]。该结果表明,实验构建的pCDH-Flag-Dppa3和pCMV-Myc-Uhrf1载体能够表达Dppa3和Uhrf1基因,可用于后续研究。
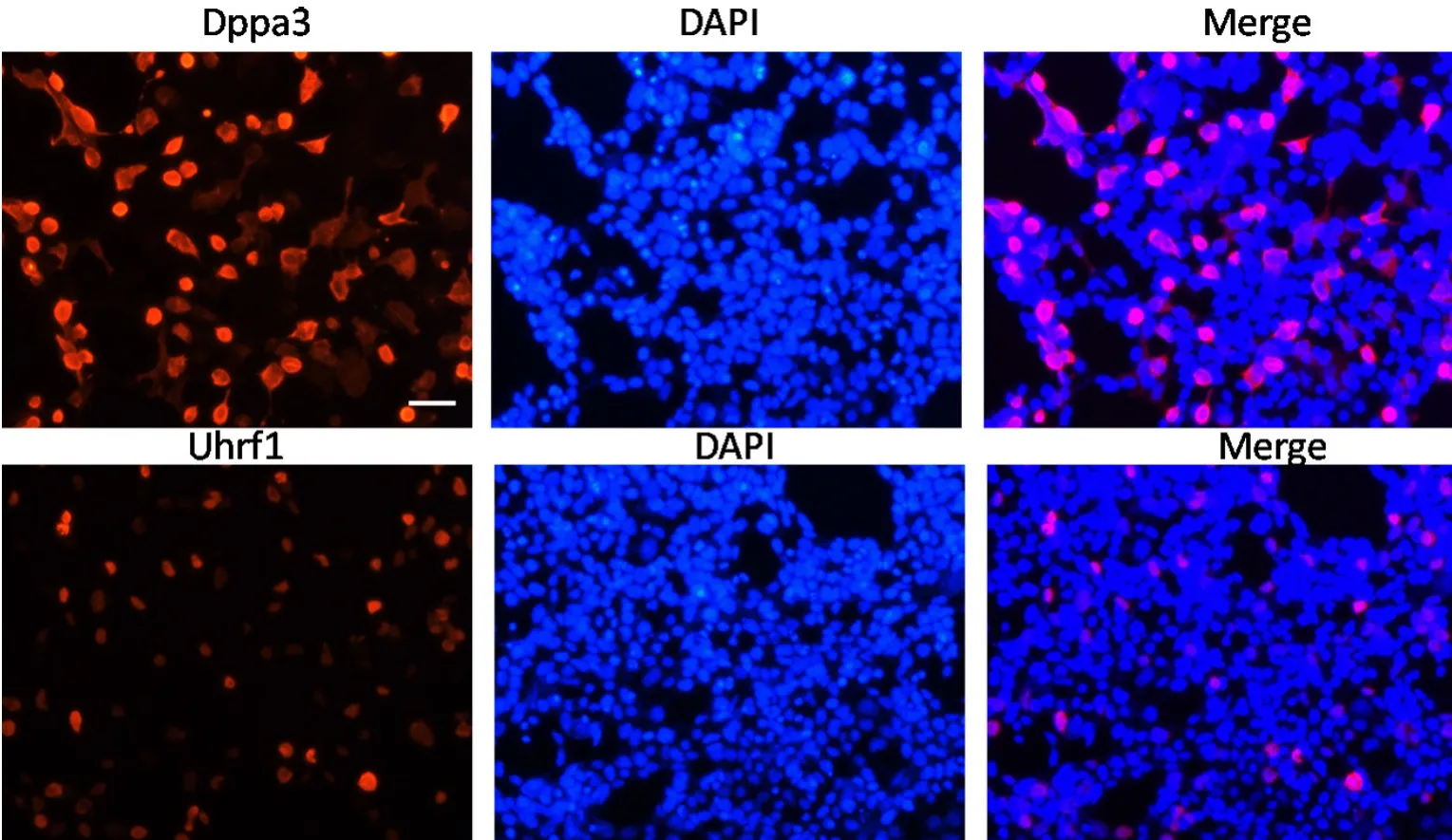
图2 免疫荧光染色检测pCDH-Flag-Dppa3和pCMV-Myc-Uhrf1载体基因在F9细胞的表达。比例尺,100µmFig.2 Immunofluorescent examination for expression of pCDH-Flag-Dppa3 and pCMV-Myc-Uhrf1 in F9 cells.Scale bar, 100µm

图3 Dppa3与Uhrf1协调作用调节印记基因的表达。A,乙醇(RA的溶剂,用作对照,CT)和1μmol/L RA处理后的J1细胞形态;比例尺:100µm; B,qPCR检测RA处理J1细胞后Dppa3、Uhrf1、Peg3和Igf2基因的表达变化;C和D,qPCR检测RA诱导J1细胞分化过程中Dppa3(2Vmyc+Dppa3+RA)、Uhrf1(Vpcdh+Uhrf1+RA)、Dppa3和Uhrf1(Uhrf1+Dppa3+RA)过表达对印记基因Peg3(C)和Igf2(D)表达的影响,以空载转染的RA溶剂处理组细胞(2V+CT)为正常对照组,空载转染的1μmol/L RA处理组细胞(2V+RA)为RA处理组;*P<0.05;**P<0.01Fig.3 Imprinted gene expression was regulated by Dppa3 and Uhrf1.A, morphology of J1 cells that were treated with ethanol (CT), or treated with 1μmol/L RA; scale bar∶ 100µm; B, relative expression change of Dppa3, Uhrf1, Peg3 and Igf2 in RA treated J1 cells was detected using real-time PCR;C and D, real-time PCR examination for two imprinting gene Peg3 (C) and Igf2 (D) expression, J1 cells pre-transfected with empty vectors(2V),pCDH-Flag-Dppa3(Dppa3), pCMV-Myc-Uhrf1(Uhrf1), pCDH-Flag-Dppa3 and pCMV-Myc-Uhrf1(Uhrf1+Dppa3) were treated with ethanol(CT)or 1μmol/L RA (RA)separately; * P<0.05; ** P<0.01
印记基因的表达会随胚胎发育阶段的不同而改变,为明确Dppa3和Uhrf1协同表达对胚胎发育过程中印记基因的调节作用,首先以全反式维甲酸(RA)为诱导剂诱导J1胚胎干细胞进行分化[13]。结果显示:RA可诱导J1小鼠胚胎干细胞分化,加入RA后J1细胞的克隆样结构消失、细胞向外迁移呈单层生长、细胞形态由近圆形变为扁平梭状或多角状(图3A)。在RA诱导J1细胞分化的过程中,Dppa3基因表达下调,Uhrf1基因表达无明显变化,印记基因Peg3表达上调、Igf2表达下调(图3B)。然而,分别以pCDH-Flag-Dppa3、pCMV-Myc-Uhrf1、pCDH-Flag-Dppa3和pCMV-Myc-Uhrf1转染J1细胞,用1μM RA诱导J1细胞分化时发现:过表达Dppa3或Uhrf1均可抑制RA诱导的印记基因Peg3上调、Igf2下调;同时过表达Dppa3和Uhrf1可显著增强Dppa3或Uhrf1对印记基因Peg3(图3C)和Igf2(图3C)调节作用。这些结果表明Dppa3和Uhrf1在胚胎发育过程中对印记基因的表达具有调节作用。
讨 论
印记基因的表达模式为单等位基因表达,即双亲来源的等位基因仅父源或母源一方表达,另外一方不表达。单等位基因的表达模式使得印记基因异常表达更易引起机体生命活动网络的紊乱—印记基因的异常表达不能够通过等位基因的调节进行“平衡”或“补偿”。因此,印记基因异常表达常与个体异常发育、疾病的发生发展相关。胚胎发育过程中有研究结果显示:母源印记基因如Peg3、Igf2和Peg10等可促进胎儿和胎盘的生长,父源印记基因如H19、Igf2r和Grb10等可抑制胚胎的发育,父源或母源印记基因的缺失都可引起胚胎异常发育[14]。在疾病的发生发展过程中,印记基因异常表达不仅参与疾病的形成,也与肿瘤等疾病的临床分期、预后相关,如已有研究显示染色体15q11–q13区印记基因的异常表达与Prader-Willi/Angelman综合征的形成相关[15,16], Igf2、Peg10、H19等印记基因的表达与胃癌、肺癌、Wilms 肿瘤等肿瘤的临床分期、预后相关[17,18]。印记基因与异常胚胎发育、肿瘤等疾病发生发展的关系提示:印记基因表达调控网络的绘制有助于胚胎发育和肿瘤等印记异常相关疾病作用机理和调节机制的揭示[19]。
印记基因的表达调控以DNA甲基化修饰为主。已有报道显示Uhrf1和Dppa3均能够参与DNA甲基化的调节。Uhrf1广泛表达于生长旺盛的组织如早期胚胎和肿瘤组织中[20,21]。胚胎发育早期,Uhrf1能够通过其SRA结构域与半甲基化的DNA结合,募集G9a和Dmnt1促进DNA的甲基化[8,22,23],与亲子代细胞间DNA甲基化的传递相关。肿瘤等组织中,Uhrf1通过其RING结构域发挥泛素E3连接酶活性,促进Dmnt和Dmnt3的泛素化降解,诱导全基因组DNA的低甲基化[24-26]。Dppa3的表达于印记基因甲基化直接相关。胚胎形成过程中,Dppa3表达于成熟卵母细胞、着床前的胚胎和原始生殖细胞形成期(E7.25至E15.5),其表达过程与印记基因的差异甲基化形成相关——等位基因的甲基化差异在卵母细胞和精子形成过程中出现(与Dppa3表达于胚胎原始生殖细胞形成期对应),卵子与精子结合后在2细胞期发生父源基因组的主动去基甲基化(与Dppa3表达于着床前的胚胎相对应)[7,12]。受精卵中,Dppa3能够直接抑制Tet3介导DNA主动去甲基化,保护母源印记基因的DNA的甲基化[7]。Uhrf1对DNA甲基化的调节作用和Dppa3对印记基因DNA甲基化的保护作用提示:Uhrf1和Dppa3协调表达可能对印记基因的表达具有调控作用。
前期研究中,我们通过Co-IP联合质谱检测发现Dppa3与Uhrf1间存在相互作用[10],然而二者相互作用是否影响印记基因的表达还不清楚。为确定Dppa3和Uhrf1对印记基因表达的调控作用,本研究首先通过实验证实Dppa3与Uhrf1间存在相互作用,随后以甲酸诱导分化前后的J1小鼠胚胎干细胞为模型,通过Dppa3和Uhrf1过表达实验证实:Dppa3和Uhrf1协调表达能够调节印记基因表达。该研究结果的发现一方面有助于印记基因表达调控机制的阐明,另一方面为Dppa3、Uhrf1和印记基因表达异常相关疾病发病机制的揭示,治疗方式的选择具有积极作用。
目前,本研究尽管通过实验证实Dppa3和Uhrf1协调表达可以调节印记基因的表达,但二者协同作用是通过印记基因DNA甲基化修饰亦或其它基因表达调控方式调节印记基因的表达还不清楚。今后,我们将进一步通过DNA甲基化测序等方法探究Dppa3与Uhrf1协调表达调节印记基因表达的机制。
[1]Sato M, Kimura T, Kurokawa K, et al.Identification of PGC7, a new gene expressed specifically in preimplantation embryos and germ cells.Mech Dev, 2002, 113(1)∶ 91-94.
[2]McGrath J, Solter D.Completion of mouse embryogenesis requires both the maternal and paternal genomes.Cell, 1984,37(1)∶ 179-183.
[3]Payer B, Saitou M, Barton SC, et al.Stella is a maternal effect gene required for normal early development in mice.Curr Biol, 2003, 13(23)∶ 2110-2117.
[4]Arima T, Hiura H, Okae H, et al.Genomic imprinting and carcinogenesis.Gan To Kagaku Ryoho, 2011, 38(11)∶ 1745-1749.
[5]Silva D, Venihaki M, Guo WH, et al.Lopez.Igf2 deficiency results in delayed lung development at the end of gestation.Endocrinology, 2006, 147(12)∶ 5584-5591.
[6]Ribarska T, Bastian KM, Koch A, et al.Specific changes in the expression of imprinted genes in prostate cancer--implications for cancer progression and epigenetic regulation.Asian J Androl, 2012, 14(3)∶ 436-450.
[7]Nakamura T, Liu YJ, Nakashima H, et al.PGC7 binds histone H3K9me2 to protect against conversion of 5mC to 5hmC in early embryos.Nature, 2012, 486(7403)∶ 415-419.
[8]Ferry L, Fournier A, Tsusaka T, et al.Methylation of DNA Ligase 1 by G9a/GLP Recruits UHRF1 to Replicating DNA and Regulates DNA Methylation.Mol Cell, 2017, 67(4)∶550-565.e5.
[9]Maenohara S, Unoki M, Toh H, et al.Role of UHRF1 in de novo DNA methylation in oocytes and maintenance methylation in preimplantation embryos.PLoS Genet, 2017,13(10)∶ e1007042.
[10]Liu H, Zhang L, Wei Q, et al.Comprehensive Proteomic Analysis of PGC7-Interacting Proteins.J Proteome Res,2017, 16(9)∶ 3113-3123.
[11]Miura M, Watanabe H, Sasaki T, et al.Dynamic changes in subnuclear NP95 location during the cell cycle and its spatial relationship with DNA replication foci.Exp Cell Res, 2001,263(2)∶ 202-208.
[12]Nakashima H, Kimura T, Kaga Y, et al.Effects of dppa3 on DNA methylation dynamics during primordial germ cell development in mice.Biol Reprod, 2013, 88(5)∶ 125.
[13]Podlesny-Drabiniok A, Sobska J, de Lera AR, et al.Distinct retinoic acid receptor (RAR) isotypes control differentiation of embryonal carcinoma cells to dopaminergic or striatopallidal medium spiny neurons.Sci Rep, 2017, 7(1)∶ 13671.
[14]Babak T, DeVeale B, Tsang EK, et al.Genetic conflict reflected in tissue-specific maps of genomic imprinting in human and mouse.Nat Genet, 2015, 47(5)∶ 544-549.
[15]Kim Y, Lee HM, Xiong Y, et al.Targeting the histone methyltransferase G9a activates imprinted genes and improves survival of a mouse model of Prader-Willi syndrome.Nat Med, 2017, 23(2)∶ 213-222.
[16]Langouet M, Glatt-Deeley HR, Chung MS, et al.Zinc finger protein 274 regulates imprinted expression of transcripts in Prader-Willi syndrome neurons.Hum Mol Genet, 2018,27(3)∶ 505-515.
[17]Tian F, Tang Z, Song G, et al.Loss of imprinting of IGF2 correlates with hypomethylation of the H19 differentially methylated region in the tumor tissue of colorectal cancer patients.Mol Med Rep, 2012, 5(6)∶ 1536-1540.
[18]Jelinic P, Shaw P.Loss of imprinting and cancer.J Pathol,2007, 211(3)∶ 261-268.
[19]Paulsen M, Ferguson-Smith AC.DNA methylation in genomic imprinting, development, and disease.J Pathol, 2001,195(1)∶ 97-110.
[20]Ashraf W, Ibrahim A, Alhosin M, et al.The epigenetic integrator UHRF1∶ on the road to become a universal biomarker for cancer.Oncotarget, 2017, 8(31)∶ 51946-51962.
[21]Sidhu H, Capalash N.UHRF1∶ The key regulator of epigenetics and molecular target for cancer therapeutics.Tumour Biol, 2017, 39(2)∶ 1010428317692205.
[22]Bashtrykov P, Jankevicius G, Jurkowska RZ, et al.The UHRF1 protein stimulates the activity and specificity of the maintenance DNA methyltransferase DNMT1 by an allosteric mechanism.J Biol Chem, 2014, 289(7)∶ 4106-4115.
[23]Berkyurek AC, Suetake I, Arita K, et al.The DNA methyltransferase Dnmt1 directly interacts with the SET and RING finger-associated (SRA) domain of the multifunctional protein Uhrf1 to facilitate accession of the catalytic center to hemi-methylated DNA.J Biol Chem, 2014, 289(1)∶ 379-386.
[24]Jia Y, Li P, Fang L, et al.Negative regulation of DNMT3A de novo DNA methylation by frequently overexpressed UHRF family proteins as a mechanism for widespread DNA hypomethylation in cancer.Cell Discov, 2016, 2∶ 16007.
[25]Nakamura K, Baba Y, Kosumi K, et al.UHRF1 regulates global DNA hypomethylation and is associated with poor prognosis in esophageal squamous cell carcinoma.Oncotarget, 2016, 7(36)∶ 57821-57831.
[26]Mudbhary R, Hoshida Y, Chernyavskaya Y, et al.UHRF1 overexpression drives DNA hypomethylation and hepatocellular carcinoma.Cancer Cell, 2014, 25(2)∶ 196-209.
