MiR-706通过TAOK1信号通路抑制小鼠肝纤维化
2018-07-09张舒娴谢川平张秀英周德山
张舒娴,谢川平,张秀英*,周德山*
(首都医科大学1人体解剖与组织胚胎学系,2临床医学长学制2015级, 北京 100069)
慢性病毒性肝炎、脂肪肝、酒精及慢性脂肪型肝病、药物以及毒物等慢性损伤刺激肝脏,引起炎症反应,细胞外基质(extracellular matrix, ECM)合成降解与沉积不平衡后形成肝纤维化,进而会发展为肝硬化、肝功能衰竭[1]。肝纤维化是一种可逆性病变, 发展至肝硬变则不可逆。在某些情况下, 肝移植术可治愈终末期肝病,但缺乏供体、费用昂贵及受体体质差等因素严重限制了这一技术的应用。因此阻断肝纤维化像肝硬化进展,并加强肝纤维化研究与防治更具有重要的实际意义,也是当今国际肝病界研究之热点。
MicroRNA是小RNA的最主要组成部分,与小干涉RNA一样,能序列特异性地调节转录后基因的表达。MicroRNA在核内形成,经过一系列的剪切和运输后形成成熟的约有22nt的非编码RNA,进而与下游靶基因的3’UTR区部分或完全配对结合,通过降低靶mRNA的稳定性或抑制翻译而下调目的基因的表达。 MicroRNA对某种特定基因产生的直接靶向抑制作用为某些疾病的治疗提供了大量的分子生物学依据[2-4]。
有丝分裂原活化蛋白激酶(mitogen-activated protein kinase, MAPKs)通路是细胞内最主要的信号传导通路之一,介导细胞产生相应的生物学效应,主要由以下3个途径组成:细胞外信号调节激酶(ERK)、蛋白调节激酶p38(P38MAPK)和cjun末端调节激酶(JNK)。其中,p38MAPK信号传导通路作为MAPK家族中重要的成员,其在细胞凋亡、细胞炎症反应、细胞表型转化及氧化应激反应等方面都发挥着重要的作用[5]。近年来,有研究表明,p38MAPK信号传导通路可能通过诱导HSC的活化、增殖促进肝纤维化的发生发展[6],且TGF-β可调控p38MAPK途径,进而激活下游的Smad3通路,导致细胞外基质的分泌及胶原的沉积[7]。而TAOK1作为p38/MAPK14转录激活因子,可以应激性活化下游的MAPK信号通路,加速肝纤维化的形成[8,9]。前期工作中,我们通过基因芯片技术发现,在小鼠CCl4肝纤维化组织中miR-706表达显著低;并且通过双荧光素酶报告基因证明miR-706可通过与下游靶基因的3’UTR区部分配对结合,抑制TAOK1基因的表达[10]。而胆总管结扎(bile duct ligation,BDL)肝纤维化模型不同于CCl4肝纤维化模型,其主要通过结扎所引起的胆道梗阻,胆管扩张压迫肝内血管,肝细胞缺血坏死,胶原大量沉积而引发纤维组织出现大量增生,并包绕肝小叶,形成肝纤维化[11]。本研究我们将在小鼠BDL肝纤维化模型中,分析miR-706下游靶基因TAOK1所调控的信号通路中相关因子的变化,明确miR-706是否在胆汁淤积性肝纤维化进程中发挥重要作用。
材料与方法
1 实验动物
C57BL/6小鼠(动物许可证号:SCXK20120001)于首都医科大学实验动物部购置,雄性,体重约18~22g,6~8周龄,在SPF级别标准化动物房饲养。
2 主要试剂
Masson试剂盒(南京建成生物工程研究所);RNA提取试剂盒(Invitrogen);micro-RNA茎环引物(生物工程有限公司);micro-RNA逆转录试剂盒(taqman);SYBER Green Mix Real-time PCR试剂盒及96孔板(Invitrogen);BCA试剂盒(Thermo);兔抗TAOK1多克隆抗体(Cell Signaling);鼠抗α-SMA单克隆抗体(Sigma);鼠抗p38、MEK3多克隆抗体(Abcam);兔抗Collagen I多克隆抗体(Abcam);兔抗β-actin多克隆抗体(Cell Signaling);HRP标记的山羊抗兔抗体(Cell Signaling);HRP标记的山羊抗小鼠抗体(Cell Signaling);免疫组织化学试剂盒(福州迈新生物技术开发有限公司);ECL显色试剂盒(美国Bio-Rad公司)。
3 BDL肝纤维化模型建立
将20只小鼠随机分为假手术对照组和BDL肝纤维化模型组(BDL组)两组,每组10只小鼠。对BDL组小鼠以4% 水合氯醛麻醉后固定于手术台,剖腹后分开肝叶,将胆囊与十二指肠相连的小管(胆总管)分离结扎,缝合关腹;对假手术组小鼠麻醉后打开腹腔,游离胆总管后缝合关腹腔。术后仍在标准化动物房饲养。术后4周处死小鼠,并取肝组织用于HE 及Masson染色、免疫组织化学染色、Western blot及Real-time检测。在形态学水平上,用HE 及Masson两种方式验证造模是否成功。
4 小鼠肝脏形态学水平检测
小鼠肝组织取材后放入10%福尔马林中固定,常规脱水、透明、浸蜡包埋后制作石蜡切片,后进行一系列HE和Masson染色,用于确定肝纤维化造模是否成功,最后于光镜下观察其病理变化并照相。
5 免疫组织化学染色
小鼠肝组织石蜡切片经过脱蜡后,浸泡入蒸馏水,用枸橼酸钠缓冲进行抗原修复后,其余步骤遵循福建迈新试剂公司免疫组织化学染色步骤进行。一抗浓度分别为:TAOK1(1:100)、p38(1:200)、MEK3(1:200),4℃孵育过夜;次日滴加生物素化的二抗,期间洗涤液均为PBS,之后每张切片滴加约50ul链霉菌抗生物素-过氧化物酶溶液,并用DAB进行显色,镜下观察,适时用自来水进行中止;苏木素复染、自来水冲洗反蓝、酒精脱水、二甲苯透明等后用树胶封片,镜检、拍照。
6 Western blot检测
于造模4周时取正常组和BDL模型组肝组织50mg,加入约600μl RIPA蛋白裂解液(主要成分:25mmol/L Tris-HCl pH 7.6, 150mmol/L NaCl, 1% NP-40, 1% 脱氧胆酸钠, 0.1% SDS,1mmol/L PMSF和蛋白酶抑制剂复合物),充分裂解并用匀浆器匀浆,12000r/min离心后取上清(即为提取的总蛋白)分装于1.5ml EP管中,后用BCA法测定蛋白浓度。取约20μg蛋白进行10% SDS-PAGE电泳,后以0.3A恒流转印至PVDF膜。第一抗体4°C孵育过夜,次日,用与HRP偶联的第二抗体室温孵育1h,ECL化学发光法显示条带,使用生物分子凝胶成像仪曝光、拍照。
7 实时定量PCR检测(Real-time PCR)
根据RNA提取试剂盒中的具体步骤提出肝组织中的总RNA,统一浓度后,利用颈环引物将RNA逆转为与miR-706对应的DNA。Real-time PCR检测中体系总体积为20μl,其中含有SYBR Green Super Mix、上下游引物、DEPC水及20ng DNA;扩增条件为95℃(5min),然后95℃(20s)、56℃(20s)和72℃(20s),共40个循环,所有检测过程均在ABI公司7500机器中进行。将相应CT值利用(2-ΔΔCT)进行统计并分析。实验中涉及到的颈环引物及microRNA引物见表1。

表1 microRNA引物序列Tab.1 primer sequences of microRNA
8 统计学分析
Western blot实验中,利用Image J测定条带光密度值,以β-actin为内参,以目的蛋白光密度值/β-actin光密度值计算目的蛋白相对表达水平,实验数据采用±s表示;RT-PCR实验中,利用(2-ΔΔCT)公式进行统计;并利用SPSS 17.0软件进行统计学分析,P<0.05的差异被认为具有统计学意义。
结 果
1 胆总管结扎小鼠模型肝纤维化明显

图1 小鼠BDL肝纤维化模型的组织学(A)与Western blot(B)检测鉴定。比例尺,100μm;*,P<0.01(n=4)Fig.1 Histology (A) and Western blotting (B) evaluation of BDL-induced liver fibrosis mouse model.Scale bar, 100μm; *, P<0.01 (n = 4)
对小鼠进行胆总管结扎手术后,取材时发现,与对照组小鼠相比,BDL模型组小鼠肝脏表面出现较为明显的颗粒感;HE及Masson染色结果显示(图1A):与对照组相比,BDL模型组组中出现明显的纤维增生,纤维包绕肝细胞形成大小不等的肝细胞团,并伴随有一定的肝细胞变性及炎症反应。提取Sham组及BDL模型组肝组织蛋白,Western blot结果显示(图1B),BDL肝纤维化组中α-SMA、Collagen I的表达含量明显增加。以上数据表明BDL肝纤维化造模成功。
2 肝纤维化小鼠肝组织内miR-706表达量下降
胆总管结扎4周后取材,RT-PCR结果显示,与本课题组前期基因芯片结果相同[7],与对照组相比,miR-706在4周及6周BDL肝纤维化小鼠肝组织内的表达量显著下降(图2)。
3 肝纤维化小鼠肝组织内TAOK1及其下游MAPK信号通路相关蛋白表达增加
免疫组织化学染色结果显示(图3):肝纤维化组中肝组织内TAOK1的表达含量显著增加,同时,因TAOK1作为p38/MAPK14转录激活因子,可以应激性活化下游的MAPK信号通路,p38、MEK表达量都有所增加。
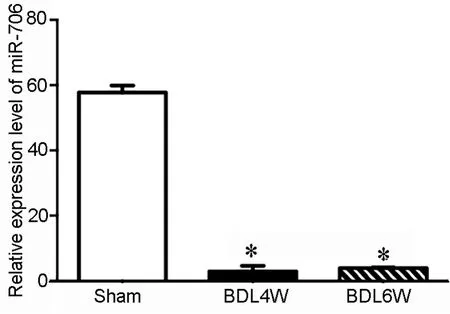
图2 肝纤维化4周和6周小鼠肝组织内miR-706表达的Real-time RT-PCR检测。*,P<0.01(n=4)Fig.2 Real-time RT-PCR analysis of miR-706 expression in the fibrotic livers of 4- and 6- weeks old mice.*, P<0.01 (n=4)
讨 论
肝纤维化是一种复杂的病理生理过程,在长期损伤因素的刺激下,肝脏在修复愈合的过程中慢慢向纤维化进展。目前有大量研究表明,对于肝纤维化发生发展中的细胞和分子学机制,可能与各种途径所导致的肝星状细胞(HSC)的激活[12,13],金属蛋白酶组织抑制因子(TIMP)-基质金属蛋白酶(MMP)平衡失调所致的细胞外基质(ECM)的沉积[14,15],肝内EMT的发生有关[16-18]。近几年来,随着各个领域对miRNA研究越发增多,也有部分研究表明,miRNA与肝纤维化的发生密切相关,例如,现有临床研究表明,在慢性乙型肝炎患者体内血清中miR-125a-5p的表达水平明显升高[19],更有发现表明乙肝患者血清中miR-29水平可以作为肝纤维化阶段的分级相关标志物[20]。Miyaaaki课题组也发现非酒精性脂肪肝患者血清中miR-122的含量可作为肝纤维化的诊断依据[21]。miRNA对肝纤维化起到的治疗作用,有研究表明,miR-125A-5p、miR-29a等的下调可以抑制HSC的活化与增殖[22,23];而过表达miR-378a-3p、miR-370可以诱导细胞凋亡,有治疗肝纤维化的潜力[24,25]。更有研究表明miR-155可以抑制EMT以及ERK信号通路[26]。在前期工作中,我们通过基因芯片的筛选及RT-PCR两种方式发现,miR-706在CCl4造模的小鼠肝纤维化组织中显著低表达,并且为首次报道[10]。其下游靶基因 TAOK1为丝氨酸/苏氨酸蛋白激酶,可通过 p38 / Mapk14应激激活MAPK级联反应,从而调控DNA损伤反应、细胞骨架的稳定性、介导细胞增殖和分化及细胞凋亡[27]。现已有研究表明,其下游介导的p38/Mapk14通路的激活能够引起HSC的大量增殖,从而促进肝纤维化的进展[28]。本次研究发现,在BDL肝纤维化模型中,miR-706的表达含量显著下降,其可通过激活下游靶基因TAOK1介导的p38/MAPK信号通路,促进肝纤维化的发生与发展。同时,本次研究也为miR-706在肝纤维化的中的治疗提供理论依据。
[1]Friedman SL.Molecular regulation of hepatic fibrosis, an integrated cellular response to tissue injury.J Biol Chem,2000, 275(4)∶ 2247-2250
[2]Lagos QM, Rauhut R, Lendeckel W, et al.Identification of novel genes coding for small expressed RNAs.Science,2001, 294(5543)∶ 853-858.
[3]Wu LG, Fan JH, Belasco JG, et al.MicroRNAs direct rapid deadenylation of mRNA.Proc Natl Acad Sci USA, 2006,103 (11) ∶4034-4039.
[4]Lund E, Guttinger S, Calado A, et al.Nuclear export of microRNA precursors.Science, 2004, 303(5654)∶ 95~98
[5]Ono K, Han J.The p38 signal transduction pathway∶ activation and function.Cell Signal, 2000, 12(1)∶ 1-13
[6]吴文娟,杨妙芳,许小兵,等.p38 MAPK在大鼠实验性肝纤维化发生中的表达及其意义.世界华人消化杂志,2008,16(34):3822-3827
[7]Schnabl B1, Bradham CA.TAK1/JNK and p38 have opposite effects on rat hepatic stellate cells.Hepatology, 2001,34(5)∶ 953-963.
[8]Wu WJ, Yang MF.Expression and its location of p38MAPK in CCl4 -induced hepatic fibrosis in rats.World Clin J Digestol, 2008, 16(34)∶ 3822-3827.
[9]谭利平,许峰,匡凤梧,等.高氧性肺损伤中 MAPK 信号途径的表达及其作用机制.第四军医大学学报,2007,28(12):1061-1064.
[10]Yin RL, Guo D, Zhang XY et al.miR-706 inhibits the oxidative stress-induced activation of PKCα/TAOK1 in liver fbrogenesis.Sci Rep,23(6)∶37509.
[11]Gu XH, Fang DC, Chen DF.Isolation and culture of rat hepatic stellate cells and expression of proteinase—activated receptors in the experimental model of hepatic fibrosis induced by bile duct ligation.Chin J Gastroenterol Hepatol,2006, 15(5)∶ 474 -477.
[12]Lewindon PJ, Pereira TN, Hoskins AC, et al.Role of hepatic stellate cells and transforming growth factor-β in cystic fibrosis liver disease.Am J Pathol, 2002, 160(5)∶ 1705 -1715.
[13]Gao R, Brigstock DR.Activation of nuclear factor kappa B(NF-kappa B) by connective tissue growth factor (CCN2)is involved in sustaining the survival of primary rat hepatic stellate cells.Cell Commun Signal, 2005, 22(3)∶14.1-9
[14]Zhou X, Murphy FR, Gehdu N,et al.Engagement of alphavbeta3 integrin regulates proliferation and apoptosis of hepatic stellate cells.J Biol Chem, 2004, 279(23)∶ 23996-24006
[15]Jiang YF, Sun HL, Zhang JJ, et al.Effect of shRNA-mediated silencing of CTGF and TIMP-1 on mRNA expression of CTGF, TIMP-1, and PC I and secretion of extracellular matrix in rat hepatic stellate cells.Zhonghua Gan Zang Bing Za Zhi, 2012, 20(8)∶ 576-580
[16]Kalluri R1, Neilson EG.Epithelial-mesenchymal transition and its implications for fibrosis.J Clin Invest, 2003, 112(12)∶1776-1784.
[17]Chu AS, Diaz R, Hui JJet al.Lineage tracing demonstrates no evidence of cholangiocyte epithelial-to-mesenchymal transition in murine models of hepatic fibrosis.Hepatology, 2011, 53(5)∶ 1685-1695.
[18]Toda, S, Matsumura, Fujitani N, et al.Transforming growth factor-beta1 induces a mesenchyme-like cell shape without epithelial polarization in thyrocytes and inhibits thyroid folliculogenesis in collagen gel culture.Endocrinology,1997, 138(12)∶ 5561-5575.
[19]Zheng J, Zhou Z, Xu Z, et al.Serum microRNA-125a-5p,a useful biomarker in liver diseases, correlates with disease progression.Mol Med Rep, 2015, 12(1)∶ 1584-1590.
[20]Huang C, Zheng JM, Cheng Q,et al.Li N.Serum microRNA-29 levels correlate with disease progression in patients with chronic hepatitis B virus infection.J Dig Dis,2014, 15(11)∶ 614-621.
[21]Miyaaki H, Ichikawa T, Kamo Y, et al.Significance of serum andhepatic microRNA-122 levels in patients withnon-alcoholic fatty liver disease.Liver Int, 2014, 34(7)∶ e302-e307.
[22]Li G, Li J, Li C, et al.MicroRNA-125a-5p Contributes to Hepatic Stellate Cell Activation through Targeting FIH1.Cell Physiol Biochem, 2016, 38(4)∶ 1544-1552 .
[23]Matsumoto Y, Itami S, Kuroda M, et al.MiR-29a assists in preventing the activation of human stellate Cells and promotes recovery from liver fibrosis in mice.Mol Ther, 2016,24(10)∶ 1848-1859.
[24]Hyun J, Wang S, Kim J,et al.MicroRNA-378 limits activation of hepatic stellate cells and liver fibrosis by suppressing Gli3 expression.Nat Commun, 2016, 7∶ 10993 .
[25]Lu CH, Hou QR, Deng LF, et al.MicroRNA-370 attenuates hepatic fibrogenesis by targeting smoothened.Dig Dis Sci,2015, 60(7)∶ 2038-2048.
[26]Dai W, Zhao J, Tang N et al.MicroRNA-155 attenuates activation of hepatic stellate cell by simultaneously preventing EMT process and ERK1 signalling pathway.Liver Int, 2015,35(4)∶ 1234-1243.
[27]Lee KH, Choi EY, Kim MK, et al.Regulation of hepatocyte growth factor-mediated urokinase plasminogen activator secretion by MEK/ERK activation inhuman stomach cancer cell lines.Exp Mol Med, 2006, 38(1)∶ 27-35.
[28]Kostadinova R, Montagner A, Gouranton E,et al.GW501516-activated PPARβ/δ promotes liver fibrosis via p38-JNK MAPK-induced hepatic stellate cell proliferation.Cell Biosci, 2012, 2(1)∶ 1-16
