经尿道电切术联合膀胱灌注化疗在老年膀胱癌患者中的应用研究
2018-07-09罗源周娟田良张志杰
罗源,周娟,田良,张志杰
武汉市红十字会医院1泌尿外科,2骨外科,武汉430015
膀胱癌是临床常见的一种恶性肿瘤,其发病率位居泌尿系统肿瘤首位[1]。膀胱癌的生物学行为极为复杂,而且容易转移和复发,因此临床治疗较为困难[2]。膀胱癌的传统治疗方式为根治性切除术,该术式可以切除病灶,但由于其造成的创伤较大,常会影响膀胱的正常功能,尤其是对老年膀胱癌患者[3]。临床研究发现,经尿道电切术(transurethral resection,TUR)可以在切除病灶的同时保留膀胱功能,若联合膀胱灌注化疗则疗效更为显著[4]。为了探究TUR联合膀胱灌注化疗治疗膀胱癌的临床疗效,武汉市红十字会医院于2012年7月至2015年6月展开了TUR联合膀胱灌注化疗治疗老年膀胱癌的临床研究,效果满意,现报道如下。
1 资料与方法
1.1 一般资料
选取2012年7月至2015年6月于武汉市红十字会医院接受治疗的老年膀胱癌患者118例。纳入标准:①均经CT、超声、膀胱镜联合病理学检查确诊为原发性膀胱癌;②肿瘤未累及膀胱颈及尿道黏膜。排除标准:①有既往化疗史者;②有重症尿道狭窄者;③有远处转移及淋巴结转移者;④合并重要脏器严重疾病者;⑤合并其他部位恶性肿瘤者;⑥非肌层浸润性膀胱癌。根据治疗方法的不同将患者分为观察组与对照组,每组59例。观察组患者行TUR联合膀胱灌注化疗,对照组患者行根治性膀胱切除术。两组患者的性别、年龄、病程等一般资料比较,差异均无统计学意义(P>0.05),具有可比性,详见表1。
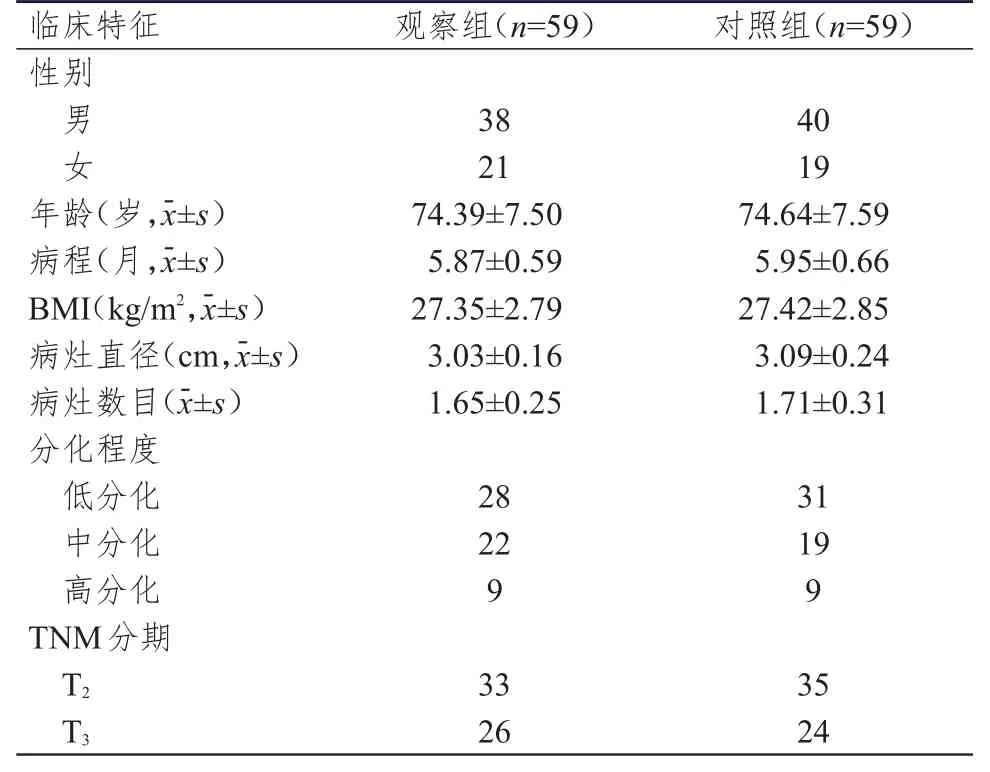
表1 两组患者的基本临床特征
1.2 治疗方法
1.2.1 观察组 观察组患者行TUR联合膀胱灌注化疗。TUR:患者行全身麻醉或硬膜外麻醉,取截石位,依据术前掌握的影像学资料进行操作。对于直径<2.0 cm的病灶,于病灶基底部电切,至膀胱外脂肪层;对于直径≥2.0 cm的病灶,先电切病灶表面,待病灶体积减小,瘤蒂显露后再以等离子电切镜切至膀胱外脂肪层,并将病灶基底部2.0 cm范围内的正常膀胱黏膜切除。术后以蒸馏水反复冲洗膀胱,电灼病灶周围正常黏膜及基底创面,待无出血后常规留置尿管。膀胱灌注化疗:TUR术后1周行吉西他滨膀胱灌注化疗,以注射用盐酸吉
西他滨(200 mg)1.0 g+50 ml生理盐水注入膀胱后留置,为保证灌注充分,嘱患者每20 min变换1次卧位,灌注液在膀胱内保留时间大于2 h。每周1次,6次后,改为每2周1次,再6次后,改为每4周1次;再6次后,改为每8周1次,膀胱灌注化疗的时间为2年。
1.2.2 对照组 对照组患者行根治性膀胱切除术。患者行全身麻醉,将腹膜切开后行输尿管分离,直至膀胱后结扎,行膀胱周围韧带分离,切断侧韧带及膀胱动脉,盆腹膜横向切开,男性需于靠近耻骨位将耻骨前列腺韧带切断,将盆内筋膜剪开,分离并切断尿道膜及前列腺外血管蒂。距回盲部约15 cm处将游离回肠袢切断,分离肠系膜,恢复肠管连续性,游离并吻合输尿管后行回肠造口,妥善固定回肠膀胱引流管,留置腹腔引流管。术后常规化疗。
1.3 观察指标及检测方法
采用酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)检测术前及术后1周两组患者的血清血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)、尿液膀胱癌特异性核基质蛋白-4(bladder cancer-associated nuclear matrix protein-4,BLCA-4)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、C反应蛋白(C-reactive protein,CRP)、白细胞介素-6(interleukin-6,IL-6)水平;采用放射免疫分析法检测血清胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1);采用流式细胞仪检测免疫因子 CD3+、CD4+、CD8+水平,检测严格参考试剂盒说明书进行操作。比较两组患者术前与术后1周VEGF、BLCA-4、IGF-1、炎性因子(CRP、IL-6、TNF-α)、免疫因子(CD3+CD4+、CD3+CD8+、CD4+/CD8+)水平的差值,并对两组患者的术后不良反应发生情况及1~2年生存情况进行比较。
1.4 统计学分析
采用SPSS 19.0软-件对数据进行分析。计量资料以均数±标准差(±s)表示,组间比较采用独立样本t检验;计数资料以率(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 VEGF、IGF- 1、BLCA- 4水平的比较
两组患者术前与术后1周血清VEGF、血清IGF-1、尿液BLCA-4水平的差值比较,差异均无统计学意义(P>0.05)。(表2)
表2 两组患者术前与术后 1周VEGF、IGF- 1、BLCA- 4水平的差值(±s)

表2 两组患者术前与术后 1周VEGF、IGF- 1、BLCA- 4水平的差值(±s)
组别观察组(n=59)74.65±7.48 43.52±4.41 41.63±4.22 73.58±7.37 VEGF(µg/L)IGF-1(µg/L)BLCA-4(ng/mL)对照组(n=59)42.87±4.3740.89±4.14
2.2 炎性因子水平的比较
观察组患者术前与术后1周CRP、TNF-α、IL-6水平的差值均明显低于对照组,差异均有统计学意义(P<0.01)。(表3)
表3 两组患者术前与术后 1周炎性因子水平差值的比较(±s)
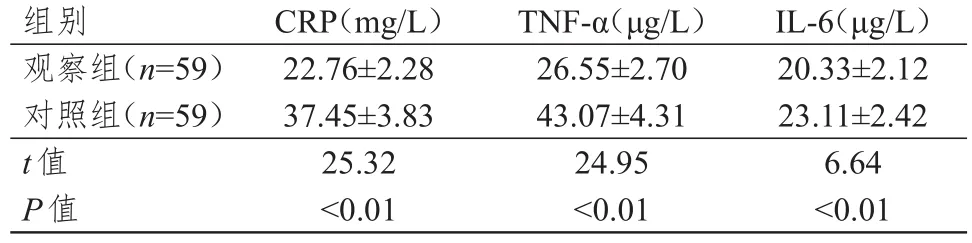
表3 两组患者术前与术后 1周炎性因子水平差值的比较(±s)
组别观察组(n=59)对照组(n=59)t值P值CRP(mg/L)22.76±2.28 37.45±3.83 25.32<0.01 TNF-α(μg/L)26.55±2.70 43.07±4.31 24.95<0.01 IL-6(μg/L)20.33±2.12 23.11±2.42 6.64<0.01
2.3 免疫因子水平的比较
观察组患者术前与术后1周CD3+CD4+、CD3+CD8+、CD4+/CD8+水平的差值均明显高于对照组,差异均有统计学意义(P<0.01)。(表4)
表4 两组患者术前与术后 1周免疫因子水平差值的比较(±s)

表4 两组患者术前与术后 1周免疫因子水平差值的比较(±s)
组别观察组(n=59)对照组(n=59)t值P值CD3+CD4+(%)14.49±1.57 9.10±0.93 22.69<0.01 CD3+CD8+(%)10.00±1.04 6.89±0.69 19.14<0.01 CD4+/CD8+1.45±0.16 1.32±0.14 4.70<0.01
2.4 术后不良反应发生率的比较
观察组患者术后总不良反应发生率为11.9%,明显低于对照组的44.1%,差异有统计学意义(χ2=15.19,P<0.01)。(表5)

表5 两组患者的术后不良反应发生情况[ n(%)]
2.5 生存情况的比较
观察组患者术后1年、2年的无瘤生存率和总生存率均高于对照组,差异均有统计学意义(P<0.05)。(表6)
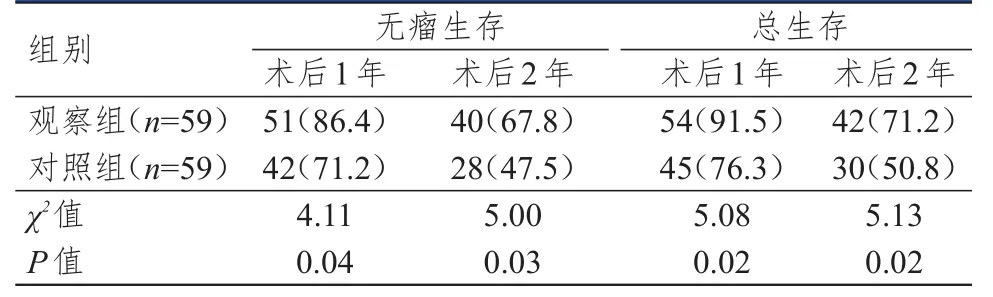
表6 两组患者术后 1年、 2年生存情况的比较[ n(%)]
3 讨论
手术切除是治疗膀胱癌的一种重要方式,主要包括不保留膀胱功能的根治性膀胱切除术和保留膀胱功能的TUR,这两种手术方式的疗效均较好,但术后均存在较高的复发率,尤其是老年膀胱癌患者,由于其免疫机制衰退,因而术后复发率更高[5]。研究表明,导致膀胱癌复发的因素主要有以下几点:①高级别、多发病灶;②病灶周围黏膜内分布着活跃的微小原位癌;③术中病灶脱落种植及残存等[6]。术后膀胱灌注化疗可以使化疗药物作用于术中脱落或残存的病灶,以及病灶周围黏膜内的微小原位癌,促使肿瘤细胞凋亡,从而达到避免或延迟术后复发的目的[7]。与常规化疗相比较,术后膀胱灌注化疗具有以下优势:①膀胱灌注化疗可以使化疗药物直接作用于微小病灶,对肿瘤细胞的杀灭能力更强[8];②膀胱黏膜组织吸收能力差,难以吸收化疗药物,化疗药物不易进入血液,不良反应少[9];③灌注药物浓度大,可高效杀灭肿瘤细胞,避免其转移及复发[10]。
相关研究表明,对于老年膀胱癌患者,理想的化疗药物对病灶的杀灭能力强,局部不良反应少,膀胱黏膜吸收量小,而药物的分子量大小是决定膀胱黏膜药物吸收量的主要因素[11]。吉西他滨为二氟核苷酸类药物,可以通过干预DNA的正常合成与复制,促使肿瘤细胞凋亡[12]。在机体内,吉西他滨可以分解为磷酸盐,其中二磷酸盐可以增加肿瘤细胞内药物活性成分,三磷酸盐可以抑制DNA复制,影响DNA合成[13]。吉西他滨对核苷酸还原酶具有灭活作用,能够有效抑制肿瘤细胞的DNA修复与合成,最终达到促使肿瘤细胞凋亡的目的[14]。张逸[15]研究发现,TUR联合膀胱灌注化疗治疗老年膀胱癌可以有效提高患者的术后2年生存率,降低不良反应发生率。董圣芳[16]对TUR后吉西他滨与吡柔比星膀胱灌注化疗治疗老年膀胱癌的临床疗效进行比较,结果表明吉西他滨与吡柔比星均可提高患者的术后2年生存率,但吉西他滨组术后不良反应发生率更低。
VEGF能够特异性地促进血管内皮细胞与肿瘤细胞膜受体结合,促进肿瘤新生血管生成,在恶性肿瘤的复发与转移过程中发挥着重要作用[17]。IGF-1是一种癌基因,高表达于多种肿瘤细胞,可以促进肿瘤细胞的分化,提高肿瘤细胞合成DNA的能力,有效促进肿瘤细胞的分裂、增殖与转移[18]。BLCA-4是膀胱癌的一种重要标志物,常特异性表达于膀胱癌患者的膀胱组织[19]。相关研究表明,肿瘤细胞具有较强的自我保护能力,能够合成并分泌免疫抑制因子,使肿瘤细胞不受免疫效应细胞的攻击,免疫抑制因子对机体抗肿瘤免疫进行抑制,为肿瘤细胞的生存创造了有利的环境[20]。此外,肿瘤细胞还可以通过竞争性掠夺机体营养导致免疫系统疲弱,进而降低机体免疫能力[21]。在本研究中,观察组术前与术后1周免疫因子水平的差值明显高于对照组(P<0.01),提示TUR联合膀胱灌注化疗治疗老年膀胱癌可以有效清除肿瘤细胞,纠正免疫失衡。观察组患者术前与术后1周各炎性因子水平的差值均明显低于对照组(P<0.01),表明相对于根治性膀胱切除术,TUR的创伤较小,可以有效避免术后炎性反应的发生。此外,观察组患者术后总不良反应发生率明显低于对照组(P<0.01),术后1年、2年无瘤生存率和总生存率均高于对照组(P<0.05),提示TUR联合膀胱灌注化疗治疗老年膀胱癌的疗效较好,可以有效降低术后不良反应发生率,较根治性膀胱切除术更适合应用于老年膀胱癌患者。
综上所述,TUR联合膀胱灌注化疗治疗老年膀胱癌可以有效清除恶性肿瘤细胞,纠正免疫失衡,且创伤小,不良发应发生率低,有利于患者转归。
[1]Nasr R,Temraz S,Mukherji D,et al.Distribution and role of N-acetyltransferase 2 genetic polymorphisms in bladder cancer risk in a lebanese population[J].Asian Pac J Cancer Prev,2017,18(9):2561-2568.
[2]顾德伦.再次经尿道电切术在非肌层浸润性膀胱癌临床治疗中的价值研究[J].中国处方药,2016,14(2):6-7.
[3]Sugiura S,Noto N,Koizumi M,et al.Post-operative single immediate intravesical instillation chemotherapy as prophylaxis for reccurence after transurethral resection of low risk non-muscle-invasive bladder cancer[J].Hinyokika Kiyo,2017,63(5):183-187.
[4]白云金,杨玉帛,韩平,等.吉西他滨膀胱灌注治疗复发性非肌层浸润性膀胱癌的疗效分析[J].现代泌尿外科杂志,2016,21(1):9-11.
[5]Bijalwan P,Pooleri GK,Thomas A.Comparison of sterile water irrigation versus intravesical mitomycin C in preventing recurrence of nonmuscle invasive bladder cancer after transurethral resection[J].Indian J Urol,2017,33(2):144-148.
[6]罗庆妮,刘英巧.经尿道电切术联合吉西他滨膀胱灌注治疗89例膀胱癌患者的临床疗效分析[J].浙江创伤外科,2017,22(4):769-770.
[7]胡森,童占彪.消痔灵联合羟喜树碱术后膀胱灌注防治初发非肌层浸润性膀胱癌术后复发的临床疗效[J].中国老年学杂志,2014,34(18):5132-5133.
[8]Lerner SP,Bajorin DF,Dinney CP,et al.Summary and recommendations from the national cancer institute’s clinical trials planning meeting on novel therapeutics for non-muscle invasive bladder cancer[J].Bladder Cancer,2016,2(2):165-202.
[9]吴肖冰,葛力源,戴黎阳.上尿路尿路上皮癌术后预防性膀胱灌注化疗的临床意义[J].中华泌尿外科杂志,2017,38(4):286-289.
[10]Onishi T,Sugino Y,Shibahara T,et al.Randomized controlled study of the efficacy and safety of continuous saline bladder irrigation after transurethral resection for the treatment of non-muscle-invasive bladder cancer[J].BJU Int,2017,119(2):276-282.
[11]王俞,李煜罡.经尿道膀胱肿瘤电切术后辅助膀胱热灌注化疗的应用进展[J].临床肿瘤学杂志,2016,21(6):560-563.
[12]Schultheis B,Reuter D,Ebert MP,et al.Gemcitabine combined with the monoclonal antibody nimotuzumab is an active first-line regimen in KRAS wildtype patients with locally advanced or metastatic pancreatic cancer:a multicenter,randomized phase IIb study[J].Ann Oncol,2017,28(10):2429-2435.
[13]Kim E,Kim K,Kyu Chie E,et al.Chemoradiotherapy after gemcitabine plus erlotinib in patients with locally advanced pancreatic cancer[J].J BUON,2017,22(4):1046-1052.
[14]Cahan B,Leong L,Wagman L,et al.Phase I/II trial of anticarcinoembryonicantigen radioimmunotherapy,gemcitabine,and hepatic arterial infusion of fluorodeoxyuridine postresection of liver metastasis for colorectal carcinoma[J].Cancer Biother Radiopharm,2017,32(7):258-265.
[15]张逸.经尿道电切术联合吉西他滨膀胱灌注治疗老年膀胱癌的临床疗效[J].中国老年学杂志,2016,36(2):358-360.
[16]董圣芳.膀胱癌患者术后行吡柔比星与吉西他滨膀胱灌注化疗的疗效分析[J].中国肿瘤临床与康复,2016,23(7):839-841.
[17]陈金华,梁昌卫,梁培育,等.吡柔比星联合顺铂膀胱灌注化疗对早期膀胱癌VEGF和HER-2表达的影响[J].河北医药,2017,39(6):840-843.
[18]谭宇彦,周恩相.IGF-I与Ki-67在乳腺癌细胞中表达的临床意义[J].西部医学,2012,24(7):1249-1252.
[19]王路加,冯陈陈,高鹏,等.尿液BLCA-1与BLCA-4检测对膀胱癌早期无创性诊断和复发监测的价值[J].现代泌尿生殖肿瘤杂志,2017,9(2):84-88.
[20]杨辉,江皓.新辅助TAC化疗对早期乳腺癌患者疗效、细胞免疫功能和Ki-67的影响[J].中华全科医学,2017,15(4):555-557.
[21]赵芳,张睿,刘静,等.DC-CIK疗法联合细胞因子对老年乳腺癌患者外周血CD4+CD25+Tr细胞水平和免疫功能的影响[J].中国老年学杂志,2015,35(16):4450-4451.
