动态对比增强磁共振成像对急性胰腺炎血流灌注的研究
2018-07-06胡然陈勇解超莲汤梦月曾南林陈天武张小明李昕
胡然,陈勇,解超莲,汤梦月,曾南林,陈天武,张小明*,李昕
急性胰腺炎(acute pancreatitis,AP)是常见的急腹症之一,并发症多,发病率高,在过去10年内发病率至少增加了20%[1]。微循环障碍在急性胰腺炎的发生发展过程中起着重要的作用[2]。目前CT灌注成像,MRI多种技术成像均可直接或间接反映胰腺的微循环变化。然而,相对于MRI来说,CT的辐射剂量大,软组织分辨率差,胆胰管显示欠佳。目前新发展起来的动态对比增强磁共振成像(dynamic contrast enhanced MRI,DCEMRI)通过静脉团注对比剂后快速获取一系列T1加权图像,可动态监测对比剂从血管进入病变组织的情况,从而反映病变组织的微循环及血流灌注状态[3]。该项技术在胰腺方面的应用中,主要集中在正常胰腺、胰腺肿瘤等方面的研究[4-8]。虽然目前DCE-MRI在急性胰腺炎方面的研究尚未见报道,但是我们有理由相信DCE-MRI凭借其独特的优势,有望用于评价及监测急性胰腺炎发生发展过程中微循环变化情况。本研究旨在通过DCEMRI量化评估急性胰腺炎患者胰腺的微循环灌注情况,从而为进一步研究急性胰腺炎灌注奠定理论和实践基础。
1 材料与方法
1.1 一般资料
本研究获得本院伦理委员会批准,且受检者均签署知情同意书。急性胰腺炎组(AP组):搜集2016年11月至2017年8月在我院住院治疗的急性胰腺炎患者,纳入标准:(1)首次发作典型急性上腹痛的病史;(2)血清淀粉酶和(或)脂肪酶活性高于正常值3倍以上;(3)腹部影像学检查符合AP影像学改变;(4)入院3 d内行MRI检查;(5)无MRI检查禁忌证。排除标准:(1)慢性胰腺炎病史;(2)胰腺癌、腹膜后肿瘤、腹腔肿瘤等引起的胰腺炎;(3)合并慢性肝病、低蛋白血症及腹膜透析等疾病。共纳入45例,男27人,女18人,年龄20~81岁,中位年龄47岁。对照组:搜集2016年11月至2017年8月在我院体检、或因CT或超声提示肝血管瘤、肝囊肿、肾囊肿而行上腹部MRI平扫+增强扫描的受检者,所有受检者均无胰腺及其相关的系统性疾病。共纳入20例,男8人,女12人,年龄31~67岁,中位年龄47岁。
1.2 扫描方法及序列
采用美国GE公司的Discovery 750 3.0 T超导性磁共振成像扫描仪,32通道相控阵表面线圈。所有受检者空腹6~8 h。在MRI检查前对患者进行呼吸训练,训练患者平稳均匀呼吸,呼吸频率、幅度尽量保持一致,同时训练患者在呼气或吸气末进行屏气,要求患者坚持20 s,并对患者常规加用腹带。对所有受检者均行常规的横断位T1WI、T2WI及脂肪抑制T2WI扫描,初步观察胰腺的形态及信号。符合纳入标准的受检者行多反转角T1WI-LAVA及T1WI-LAVA动态对比增强扫描序列。横轴面多反转角T1WI-LAVA序列扫描参数:TR 3.3 ms,TE 1.5 ms,层厚6.0 mm,矩阵256×192,FOV 360 mm×280 mm,带宽83.33 Hz/pixel,依次扫描反转角为3°、6°、9°、12°、15°。后采用横轴面T1WI-LAVA序列行DCE-MRI扫描,扫描参数为:TR 3.3 ms,TE 1.5 ms,层厚 6.0 mm,矩阵 256×192,FOV 360 mm×280 mm,带宽83.33 Hz/pixel,反转角为15°。平扫3期后,以双筒高压注射器于肘前静脉留置通道团注对比剂欧乃影(GE Healthcare Ireland生产),注射剂量为0.1 mmol/kg,速率为2.5 ml/s,随后以相同速率注入生理盐水20 ml,共行40期连续扫描,用时304 s。由于DCE-MRI扫描总共用时304 s,受检者无法一次屏气完成,故嘱受检者在平静状态下屏气,然后以最小动度换气后再继续屏气,如此重复至扫描完成。
1.3 图像分析
通过Omni-Kinetics Version V2.0.10后处理软件OmitkDCEMRITool工具,对多反转角T1WI-LAVA及T1WI-LAVA动态对比增强扫描序列进行处理分析。首先将多反转角的图像及动态增强图像导入后处理软件中。再于腹主动脉勾画ROI,计算动脉输入函数(AIF)。最后分别在胰头、胰体、胰尾勾画圆形ROI (大小在20 mm×20 mm~40 mm×40 mm,保证所取的感兴趣区大小不超过10%,尽量避开主胰管及大血管,且不靠近胰腺边缘),同时多层面多点勾画ROI,一般选取3层,每层选取3个ROI。若发现胰腺坏死,则测量对应非坏死区域,选取非坏死区域的灌注参数值作为急性胰腺炎患者胰腺的灌注参数值,方法同前。选取Extended Tofts Linear模型计算定量及半定量参数:容积转运常数(volume transfer constant,Ktrans)、血浆容积(plasma volume,Vp)、曲线下面积(area under the curve,AUC),并取每个区域所有ROI参数值的均值作为该区域最终参数值。
1.4 统计学分析
采用SPSS 13.0统计学软件进行分析。计量资料采用(M,四分位间距)表示。采用Wilcoxon符号秩和检验方法,分析比较对照组胰头、体、尾灌注参数两两之间的差异。采用Wilcoxon秩和检验方法,分析比较对照组与AP组灌注参数的差异。P<0.05认为差异有统计学意义。
2 结果
2.1 患者情况
45例AP患者中,由胆源性引起的有25例(55.56%),高脂血症引起的有9例(20%),酗酒引起的有4例(8.89%),不明原因的有7例(15.56%)。急性间质水肿型胰腺炎43例,坏死型胰腺炎2例。
2.2 对照组胰腺的灌注参数值
20例受检者胰腺的Ktrans值为(0.762,0.389~0.918) ml/min,Vp值为(0.222,0.111~0.347),AUC值为(6.597,4.646~9.226)。胰腺灌注图见图1。对照组胰头、胰体、胰尾的Ktrans、Vp、AUC值见表1,对照组胰头、体、尾的Vp值两两比较差异无统计学意义,对照组胰头的Ktrans值、AUC值要高于胰体与胰尾,且差异有统计学意义,而胰体与胰尾的Ktrans值、AUC值的差异无统计学意义。
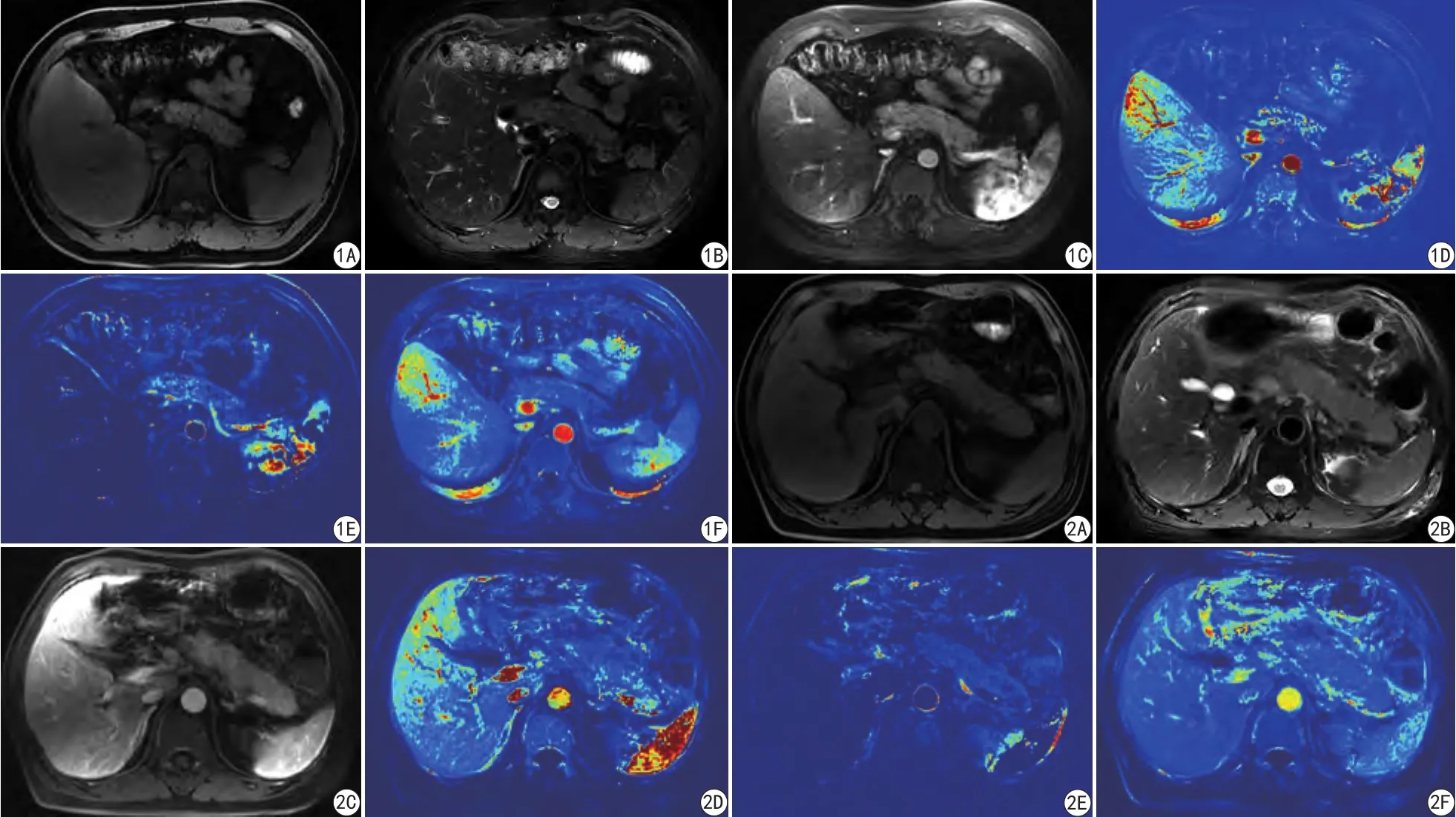
图1 男,42岁,正常胰腺。A:脂肪抑制T1WI;B:脂肪抑制T2WI;C:增强扫描T1WI;D:Ktrans图;E:Vp图;F:AUC图 图2 男,53岁,AP患者。A: 脂肪抑制T1WI;B:脂肪抑制T2WI;C:增强扫描T1WI;D:Ktrans图;E:Vp图;F:AUC图Fig. 1 A 42-year-old male patient, and the pancreas is normal. A: T1WI. B: Fat suppression T2WI. C: MRI enhanced map. D: Ktrans map. E: Vp map. F: AUC map. Fig. 2 A 53-year-old male patient with AP. A: T1WI. B: Fat suppression T2WI. C: MRI enhanced map. D: Ktrans map. E: Vp map. F: AUC map.

表1 胰腺不同部位DCE-MRI灌注参数值比较(20例,M,四分位间距)Tab. 1 Comparison of DCE-MRI perfusion parameters in different parts of pancreas (n=20, M, interquartile)

表2 AP组与对照组胰腺灌注参数的比较(M,四分位间距)Tab. 2 Comparison of pancreatic perfusion parameters between AP group and control group (M, interquartile)
2.3 AP组与对照组胰腺灌注参数的比较
AP组的胰腺的Ktrans、Vp,AUC值分别为(0.417,0.132~0.746) ml/min、(0.058,0.028~0.12)、(4.467,3.594~7.447)。AP组胰腺的Ktrans、Vp,AUC值均低于对照组,且差异有统计学意义(P均<0.05)。详见表2,胰腺灌注图见图2。
3 讨论
DCE-MRI是由一系列连续动态增强的T1WI图像构成,其通过模型构建及计算,可得到反映组织微循环灌注情况的定量及半定量参数。本研究选取了DCE-MRI所得的定量参数Ktrans、Vp及半定量参数AUC,对AP患者胰腺血流灌注情况进行分析。容积转运常数(Ktrans):描述的是对比剂从血管流向血管外细胞外间隙(extravascular extracellular space,EES)的速率,它可评估毛细血管的渗透性和感兴趣组织中的血流灌注量。血浆容积:反映功能性血管容量,随着血管生成而增加[9]。AUC可整体反映感兴趣区的血流量情况,其大小不受灌注参数模型的影响[10]。
3.1 DCE-MRI对正常胰腺灌注的评估
胰腺是一个血供较丰富的器官。胰头和胰体尾部的供血有所不同。胰头主要是由来自于胃十二指肠动脉的胰十二指肠上动脉和来自于肠系膜上动脉的胰十二指肠下动脉相互吻合供血;胰体尾部的血液则是来自于脾动脉或直接来自腹腔动脉的胰背动脉及其分支胰横动脉,以及由脾动脉的分支胰大动脉和胰尾动脉供应。本研究结果显示对照组20例受检者胰头与胰体、胰头与胰尾的Ktrans、AUC值的差异有统计学意义,而胰体与胰尾的Ktrans、AUC值差异无统计学意义,提示胰腺不同部位Ktrans、AUC值的差异可能与胰腺血供差异有关。赵娓娓等[4]通过DCE-MRI量化评估68名健康志愿者胰腺的灌注,发现胰腺不同部位的Ktrans值无差异,而胰头的Vp值高于胰体尾部,而本研究中胰头的Ktrans值高于胰体尾部,胰腺不同部位的Vp值无差异。除此之外本研究的Ktrans值要高于赵娓娓等[4]研究的Ktrans值。推测其原因可能有:(1)扫描的参数、对比剂的种类及其的注射速率不同;(2)本组研究样本量不够大;(3)不同地区不同人群胰腺灌注有一定的差异。
3.2 DCE-MRI对急性胰腺炎患者胰腺灌注的评估
本研究中急性胰腺炎患者胰腺的灌注参数Ktrans、Vp、AUC值均要低于对照组,且差异有统计学意义。该发现也清楚的反映了急性胰腺炎的病理特征。在急性胰腺炎发生发展的过程中,胰腺腺泡细胞受损,从而激活胰蛋白酶原及其他蛋白水解酶,并产生氧自由基,这些激活的蛋白水解酶及氧自由基又会刺激促炎细胞因子及血管活性因子的释放(如:白细胞介素、一氧化氮等)。释放的蛋白水解酶、促炎细胞因子及血管活性物质可损伤内皮,引起微循环功能的障碍,从而导致胰腺水肿,胰腺灌注不良及内皮功能障碍[11-12]。本研究结果与之前CT灌注结果也有相似之处。Tian等[13]对39例轻症急性胰腺炎与18名正常胰腺行灌注CT,发现轻症急性胰腺炎患者的胰腺血流量及血容量均要低于正常胰腺,但是其平均通过时间及渗透面积高于正常胰腺。本研究中可表示血管渗透性的Ktrans却是降低的,推测其可能得原因有:(1)本研究45例急性胰腺炎患者并非只含有轻度胰腺炎;(2) Ktrans值取决于毛细血管渗透性和感兴趣组织中的血流灌注量之间的平衡[9],Ktrans的降低也可能是由于血流灌注量的减少抵消了血管渗透性的增加所致。
3.3 本研究的不足
本研究样本量较小,尚不能阐明急性胰腺炎不同严重程度、不同种类及不同病因是否有不同灌注表现,为此,我们将会搜集临床病例进一步研究。在DCE-MRI连续重复的扫描中,病人无法通过一次屏气完成扫描,病人的呼吸伪影可能会影响图像质量,从而影响灌注参数值。DCE-MRI成像方法尚没有统一,不同机构使用的设备、扫描序列都有所不同,这可能会影响到各机构间研究结果的比较。
3.4 小结
总之,DCE-MRI可以无创、无辐射的量化评估胰腺的微循环灌注情况,从而为进一步研究急性胰腺炎灌注奠定理论和实践基础。
参考文献 [References]
[1] Forsmark CE, Vege SS, Wilcox CM. Acute Pancreatitis. N Engl J Med, 2017, 376(6): 598-599.
[2] Kovalska I, Dronov O, Zemskov S, et al. Patterns of pathomorphological changes in acute necrotizing pancreatitis. Int J In flam, 2012, 2012:508915.
[3] Sourbron SP, Buckley DL. Classic models for dynamic contrastenhanced MRI. NMR Biomed, 2013, 26(8): 1004-1027.
[4] Zhao WW, Ren J, Yin H, et al. Feasibility of quantitative assessment of pancreatic perfusion with dynamic contrast-enhanced MRI in healthy volunteers. Chin J Med Imaging Technol, 2017, 33(6):893-896.赵娓娓, 任静, 印弘, 等. 动态增强磁共振成像定量评估健康志愿者胰腺灌注的可行性. 中国医学影像技术, 2017, 33(6):893-896.
[5] Yao X, Zeng M, Wang H, et al. Evaluation of pancreatic cancer by multiple breath-hold dynamic contrast-enhanced magnetic resonance imaging at 3.0 T. Eur J Radiol, 2012, 81(8): e917-e922.
[6] Kim H, Arnoletti PJ, Christein J, et al. Pancreatic adenocarcinoma: a pilot study of quantitative perfusion and diffusion-weighted breathhold magnetic resonance imaging. Abdom Imaging, 2014, 39(4):744-752.
[7] Kim JH, Lee JM, Park JH, et al. Solid pancreatic lesions:characterization by using timing bolus dynamic contrast-enhanced MR imaging assessment: a preliminary study. Radiology, 2013,266(1): 185-196.
[8] Huh J, Choi Y, Woo DC, et al. Feasibility of test-bolus DCEMRI using CAIPIRINHA-VIBE for the evaluation of pancreatic malignancies. Eur Radiol, 2016, 26(11): 3949-3956.
[9] Tofts PS, Brix G, Buckley DL, et al. Estimating kinetic parameters from dynamic contrast-enhanced T1-weighted MRI of a diffusable tracer: standardized quantities and symbols. J Magn Reson Imaging,1999, 10(3): 223-232.
[10] Khalifa F, Soliman A, El-Baz A, et al. Models and methods for analyzing DCE-MRI: a review. Med Phys, 2014, 41(12): 124301.
[11] Klar E, Werner J. New pathophysiologic knowledge about acute pancreatitis. Chirurg, 2000, 71(3): 253-264.
[12] Karne S, Gorelick FS. Etiopathogenesis of acute pancreatitis. Surg Clin North Am, 1999, 79(4): 699-710.
[13] Tian C, Xu X. Multislice spiral perfusion computed tomography to assess pancreatic vascularity in mild acute pancreatitis. J Comput Assist Tomogr, 2017, 41(2): 284-288.
