生理性进食之后静息态fMRI脑功能连接的变化
2018-07-06杜乐霞张改云李勃钱绍文刘锴薛岩姜庆军
杜乐霞,张改云,李勃,钱绍文,刘锴,薛岩,姜庆军*
大脑通过复杂而相互协作的神经系统调节营养摄入和能量消耗,在维持全身的能量平衡方面起关键作用[1]。近年来,大量功能磁共振成像(functional MRI,fMRI)和正电子发射计算机断层扫描(positron emission tomography,PET)的研究揭示了病理状态下进食行为异常的神经机制,如肥胖[2],贪食症[3],功能性胃肠疾病等[4],提高了对进食异常的认识。同时,健康人进食行为的神经机制也引起人们越来越多的关注。健康被试饮食限制、去除限制和饥饿分别与奖赏系统、边缘系统的激活状态呈正相关,体重状态也与相关脑区的激活相关[5]。研究表明,被试在味觉、图片等食物线索的刺激下会使奖赏系统的功能连接发生变化[6-7]。另外,在研究经鼻饲管营养液灌注引起的胃肠生理活动变化中,与默认网络相关的广泛脑区发生了去激活[8]。以往研究揭示了人类进食行为的神经机制,然而关于健康被试生理性进食的脑功能变化目前所知甚少。本研究排除病理改变和外界刺激等因素对胃肠道的影响,以非侵入性的方法,使被试服用胃肠动力药(本研究选用的药物均不易通过血脑屏障)以扩大胃肠活动差异,利用fMRI采集静息态被试全脑的血氧水平依赖(blood and oxygen level dependence,BOLD)信号,研究生理性进食过程中不同胃肠道状态下大脑功能连接的变化,对大脑在静息态下的活动进行进一步的探索,有助于了解进食和胃肠活动的神经机制,并对相关fMRI的实验设计提供参考。
1 材料与方法
1.1 一般资料
选取2016年至2017年招募的42名健康志愿者(男21名,女21名),年龄19~35岁,中位年龄26岁。研究对象入选标准:(1)无神经系统疾患,常规颅脑MRI检查无明显异常;(2)无精神、心理疾病史,焦虑自评量表分数均≤50分;(3)无器质性或功能性胃肠疾病;(4)体质量指数18~24.5 kg/m2,且最近3个月体重改变<5%;(5)无吸烟、饮酒嗜好;(6)既往无肥胖症、暴饮暴食、节食史;(7)右利手。排除标准:(1)内脏系统疾病;(2) MRI检查禁忌证和幽闭恐惧症;(3)对本实验标准早餐有特殊偏好或过敏。MRI检查前一晚20:00后禁食,睡眠充足,精神良好。本研究经济南军区总医院医学伦理委员会批准,受检者均被告知研究内容,并签署知情同意书。
1.2 实验分组及方法
首先将42名健康被试按性别分为男、女两组,按照人口统计学特征平衡分为三组(促进组、抑制组和对照组均7男7女)。为了在正常生理状态基础上进一步促进/抑制胃动力,增加胃肠活动的差异性,促进组服用多潘立酮40 mg (西安杨森制药),抑制组服用奥替溴铵40 mg (海斯制药),对照组服用安慰剂40 mg (淀粉片),均于进食标准实验早餐时服用。多潘立酮和奥替溴铵均不通过血脑屏障,不会对中枢神经系统产生直接影响。三组均进食标准实验早餐(250 ml去乳糖牛奶、4片全麦面包和1个鸡蛋),于空腹(早7:30,T1)、早餐后(早8:00,T2)、餐后2 h (上午10:00,T3)及午餐前(中午12:00,T4)四个时间点行静息态fMRI扫描。被试每次进行扫描前均测量血糖,填写饥饿评分量表。期间除饮水外,不允许进食任何食物。
1.3 数据采集
采用济南军区总医院GE MR750 3.0 T MR仪,8通道相控阵头线圈。嘱受检者取仰卧位,头部用泡沫垫固定,保持闭眼、放松状态,尽量避免思考问题。数据采集序列:(1)常规T2序列。扫描参数:TR 4676 ms,TE 93 ms,FOV 24 cm×24 cm,层厚6 mm,层间隔1.5 mm;(2)用平面回波序列进行全脑的静息态功能成像。扫描参数:TR 2000 ms,TE 35 ms,FOV 24 cm×24 cm,37层,层厚4 mm,200个时间点,总扫描时间约6 min 40 s。
1.4 数据处理
采用北京师范大学DPARSF软件进行预处理,主要步骤包括:DICOM数据格式转换、时间矫正、头动矫正、空间标准化、平滑、去线性漂移、低通滤波(0.01~0.08 Hz)。将头动、均值信号和脑脊液信号等参数作为协变量去除。Raichle等[9]的研究证明后扣带回-楔前叶(Posterior cingulate/precuneus, PCC/PCu)显示高代谢率,在大脑中起关键作用。笔者使用MarsBaR软件包(http://marsbar.sourceforge.net/)选取PCC/PCu (MNI 坐标[-2,-54,27],r=8 mm)作为种子点,分别计算三组每个时间点功能连接(functional connectivity,FC)值,利用Fisher'sr to-z转换成Z值。
1.5 统计分析
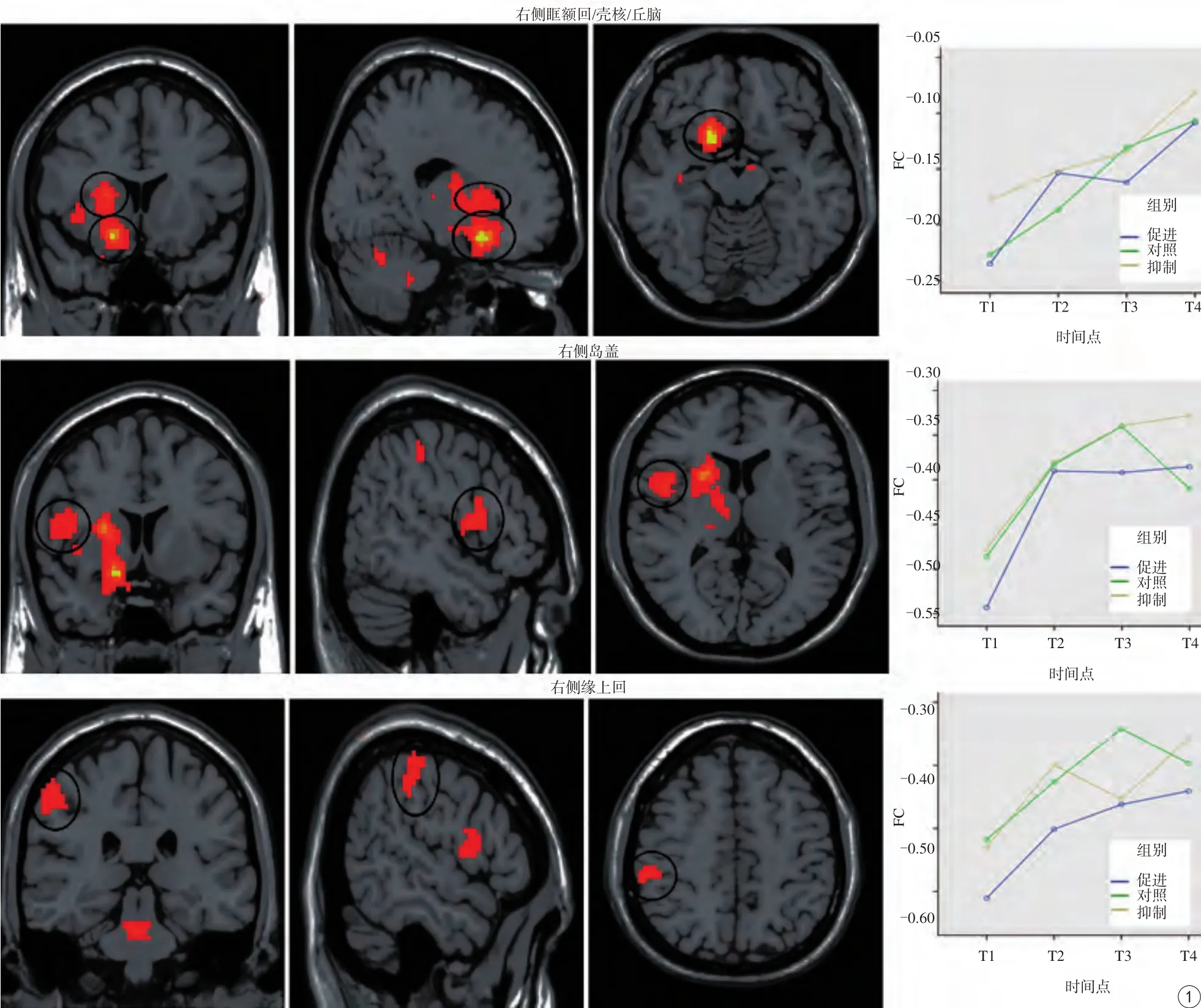
图1 时间主效应脑区:重复测量ANOVA分析显示右侧眶额回/壳核/丘脑、右侧缘上回和右侧岛盖的功能连接差异有统计学意义(P<0.05)。T1状态下,右侧眶额回/壳核/丘脑的功能连接Z值显著低于T2、T3、T4状态(P<0.05);T4状态下,上述脑区的功能连接Z值显著高于T1、T2、T3状态(P<0.05)。T1状态下,右侧缘上回、右侧岛盖的功能连接Z值低于T2、T3、T4状态,差异有统计学意义(P<0.05)Fig. 1 The main effect of time: repeated measure ANOVA revealed significant FC changes across time mainly in the right orbitofrontal cortex/putamen/thalamus, right supramarginal gyrus, and right Rolandic lobe (P<0.05). Compared with the T2, T3 and T4 states, the FC of the right orbitofrontal cortex/putamen/thalamus was significantly decreased in the T1 state (P<0.05); compared with the T1,T2 and T3 states, FC in the right orbitofrontal cortex/putamen/thalamus was significantly enhanced in the T4 state (P<0.05). Compared with the T1 state, the FC of the right supramarginal gyrus and right Rolandic lobe was significantly enhanced in the T2, T3 and T4 states (P<0.05).
采用重复测量方差分析(ANOVA)对Z变换后的全脑功能连接图像进行逐个体素的统计分析(AlphaSIM校正,P<0.05,体素>85)。为研究被试在不同时间点功能连接值的差异以及在三组间的差异,我们采用SPM-ANOVA方法,计算出时间主效应图像与药物主效应图像,经过AlphaSIM校正后,获得具有显著时间主效应与药物主效应的脑区。同时,为揭示三种药物在不同时间点上功能连接的差异性,进一步计算出时间与药物交互效应图像,经过AlphaSIM校正后,获得具有显著交互效应的脑区,并存储为感兴趣区(region of interest,ROI)。利用rest工具提取ROI内的功能连接Z值,在SPSS软件中对提取的功能连接Z值进行事后检验。并将ROI内功能连接强度分别与血糖水平、饥饿评分进行相关分析。

表1 重复测量方差分析显示时间主效应脑区(P<0.05, 体素数>85)Tab. 1 Repeated measure analysis of variance showed brain regions with significant FC changes across time (P<0.05, cluster level >85)
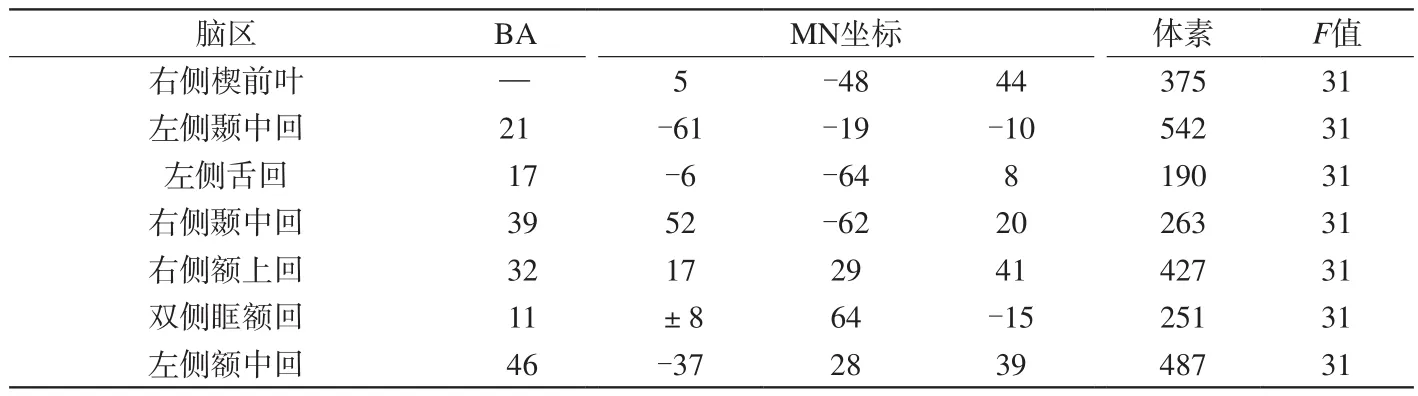
表2 重复测量方差分析显示药物主效应脑区(P<0.05, 体素数>85)Tab.2 Repeated measure analysis of variance showed brain regions with significant FC changes across medicine (P<0.05, cluster level>85)

表3 功能连接强度与血糖水平的相关分析结果Tab. 3 Correlations of functional connectivity strength with blood glucose level

表4 功能连接强度与饥饿评分的相关分析结果Tab. 4 Correlations of functional connectivity strength with hunger rating score

图2 被试在四个状态下(T1、T2、T3和T4状态)的血糖和饥饿评分Fig. 2 The fluctuations of the blood glucose level and hunger rating score during the four states (T1, T2, T3, T4).
2 结果
2.1 时间主效应
重复测量ANOVA分析显示右侧眶额回-壳核-丘脑、右侧缘上回、右侧岛盖的功能连接有显著差异(P<0.05;表1,图1)。T1状态下,右侧眶额回-壳核-丘脑的FC值低于T2、T3、T4状态;T4状态下,上述脑区的FC值高于T1、T2、T3状态,差异均有统计学意义(P<0.05)。T1状态下,右侧缘上回、右侧岛盖的FC值低于T2、T3、T4状态,差异有统计学意义(P<0.05)。
2.2 药物效应
(1)药物主效应:重复测量ANOVA分析显示右侧楔前叶、左侧颞中回、左侧舌回、右侧颞中回、右侧额上回、双侧眶额回、左侧额中回的功能连接有显著差异(P<0.05;表2)。其中,促进组:右侧楔前叶的FC值低于对照组;左侧颞中回、左侧舌回的FC值高于对照组,差异均有统计学意义(P<0.05)。抑制组:左侧舌回、右侧颞中回、右侧额上回、双侧眶额回的FC值低于对照组;左侧颞中回、左侧额中回的FC值高于对照组,差异均有统计学意义(P<0.05)。(2)药物与时间交互效应:差异无统计学意义(P>0.05)。

图3,4 相关分析结果:右侧眶额回/壳核/丘脑的功能连接(FC)值在T1、T3和T4状态下与血糖呈负相关,与饥饿评分呈正相关(P值均<0.05)Fig. 3,4 The results of the correlation analysis: the FC in the right orbitofrontal cortex/putamen/thalamus was correlated negatively with blood glucose level and positively with hunger rating score in the states of T1, T3, and T4 (P<0.05)
2.3 相关分析
右侧眶额回/壳核/丘脑的FC值在T1、T3和T4状态下与血糖水平呈显著相关(P<0.05),血糖越高,负性的功能连接强度越大。与饥饿评分也呈显著相关(P<0.05), 被试饥饿评分越高,负性的功能连接强度越弱(表3,4;图2~4)。右侧缘上回、右侧岛盖的FC值在任一状态下与血糖水平、饥饿评分均无相关性(P>0.05)(表3,4)。
3 讨论
3.1 时间主效应脑区:奖赏系统(右侧眶额回-壳核)、右侧丘脑
本研究结果显示,静息态fMRI下,生理性进食前后,三组被试在不同的时间点(时间主效应)上,相关脑区的功能连接发生了变化。右侧眶额回、右侧壳核、右侧丘脑的FC值变化趋势一致,在四个时间点呈升高趋势,T1状态下,上述脑区的FC值低于T2、T3、T4状态;T4状态下,上述脑区的FC值高于T1、T2、T3状态。进食控制系统是由多种因素调节的,特别是昼夜节律。Vanitallie等[10]发现,进食引起的大脑激活与睡眠-觉醒周期和整个昼夜节律的觉醒水平密切相关。晨起空腹时,胃肠道正处于昼夜节律的“睡眠状态”,胃肠道的活跃性差,故T1状态下右侧眶额回/壳核/丘脑的FC值较低。眶额回和壳核参与进食愉悦感的调节过程,是食物奖赏系统的重要组成部分。研究表明,眶额回与食物奖赏和监测奖赏有关[11]。de Araujo等[12]发现食物相关的气味和味觉刺激会引起右侧眶额回尾部的激活。背侧纹状体参与食物奖赏,多巴胺在背侧纹状体(壳核和尾状核)的释放与进食的愉悦度有关[13]。另外,Small等[14]的一项PET研究发现,进食引起的进食动机的增加与纹状体和眶额回尾部的激活有关。本实验中,T2、T3状态下,由于被试空腹后接受了食物奖赏,奖赏系统(右侧眶额回/壳核)的FC值升高。另有研究发现,眶额回和壳核的激活与饥饿有关,内侧前额叶皮层和壳核在饥饿状态下比饱食状态下表现出更高的激活[15],饥饿被试在渴望得到食物奖赏期间眶额回和壳核的激活明显增加[16]。笔者发现,T4状态下右侧眶额回-壳核-丘脑的FC值与血糖水平、饥饿评分存在显著相关性,表明中枢神经系统FC值的变化可能是大脑对血糖水平和摄食动机的一种响应。被试血糖水平下降后,期望得到食物奖赏,奖赏系统(右侧眶额回-壳核)的FC值从而产生相应变化。右侧眶额回/壳核在解剖上属于奖赏系统,其功能连接的变化也符合奖赏系统的一般变化规律,本实验的结果与以往实验结果相符合。右侧丘脑与奖赏系统(右侧眶额回-壳核)的FC值在时间上的激活程度和变化趋势一致。研究发现,丘脑的激活增强会导致觅食行为的增加,可导致过度进食[17]。本研究结果中,右侧丘脑与右侧眶额回、右侧壳核在四个时间点的激活形式一致,笔者由此推断,右侧丘脑也可能参与食物奖赏系统,但以往研究未提出。
3.2 时间主效应脑区:躯体感觉区(右侧缘上回-岛盖)
笔者还发现,躯体感觉区(右侧缘上回和右侧岛盖)可能与进食行为有关。在时间主效应上,T1状态下,躯体感觉区的FC值低于T2、T3、T4状态,即躯体感觉区在本实验期间进食后FC值一直处于较高水平。Stice等[18]的一项关于接受奖赏和期望接受奖赏的研究发现,肥胖者比瘦者在躯体感觉区(顶叶和岛盖)表现出更高的激活。Stoeckel等[19]发现,暴露于食物线索和处于饥饿状态都会导致肥胖者在顶叶呈现更大的激活。本究结果也提示该区域可能是大脑奖赏系统的一部分。但是,其他研究结果提示还有另外一种可能。Dosenbach等[20]发现,岛盖、前额叶、顶下小叶、基底节和丘脑属于CON网络(Cingulo-opercular network)的一部分,可能与激活、维持和监测任务执行有关。由于躯体感觉区的FC值与血糖水平、饥饿评分没有相关性,因此,躯体感觉区的FC值升高与进食无关;从早晨7:00至中午12:00,随着时间的推移,被试的各种身体机能逐渐进入活跃状态,躯体感觉区发挥激活、维持和监测的作用,故处于活跃状态。
以往研究证实,视觉、语言呈现大脑半球偏侧化优势,在本研究中,时间主效应上的各脑区呈现右侧偏侧化优势,以往关于奖赏系统和躯体感觉区的研究并未提出这一点。
3.3 药物主效应脑区
本研究中,药物主效应上,右侧楔前叶、左侧颞中回、左侧舌回、右侧颞中回、右侧额上回、双侧眶额回、左侧额中回的功能连接差异有统计学意义(P<0.05);促进组、抑制组与对照组比较,各脑区间的结果复杂,且无规律性。本研究选用的药物理论上均不通过血脑屏障,不会对中枢神经系统产生直接影响。我们加入药物因素,主要是为了促进-抑制胃肠道蠕动,增强胃肠蠕动可能对脑功能产生的影响。结果显示,时间主效应上右侧眶额回-壳核-丘脑和躯体感觉区的FC值在三组中均呈现相似的升高趋势,因此,药物并未对时间主效应上相关脑区造成明显影响。而本实验设计不是针对药物与脑功能的关系,所以不能据此实验结果做出推断。
在本实验中,被试的个体差异和主观感受可能会影响饥饿评分量表的准确性。以上为不足之处,尚需进一步完善。
综上所述,静息态fMRI下健康被试生理性进食前后,奖赏系统(右侧眶额回/壳核)、右侧丘脑和躯体感觉区(右侧缘上回、右侧岛盖)的功能连接会发生变化,并且呈现右侧偏侧化优势;而胃动力调节药物对上述脑区生理性进食前后功能连接的变化无影响。本研究首次揭示了生理性进食的静息态fMRI脑功能连接的变化;同时为相应的fMRI实验设计在被试进食状态上提供了参考依据。
参考文献 [References]
[1] Levin BE, Routh VH. Role of the brain in energy balance and obesity. Am J Physiol, 1996, 271(3 Pt 2): R491-500.
[2] Tataranni PA, DelParigi A. Functional neuroimaging: a new generation of human brain studies in obesity research. Obes Rev,2003, 4(4): 229-238.
[3] Zhang Y, Wang J, Zhang G, et al. The neurobiological drive for overeating implicated in Prader-Willi syndrome. Brain Res,2015,1620: 72-80.
[4] Zhu Q, Cai W, Zheng J, et al. Distinct resting-state brain activity in patients with functional constipation. Neurosci lett, 2016, 632:141-146.
[5] Zhao J, Li M, Zhang Y, et al. Intrinsic brain subsystem associated with dietary restraint, disinhibition and hunger: an fMRI study. Brain imaging behav, 2016, 11(1): 264-277.
[6] Bragulat V, Dzemidzic M, Bruno C, et al. Food-related odor probes of brain reward circuits during hunger: a pilot FMRI study. Obesity(Silver Spring), 2010, 18(8): 1566-1571.
[7] Schur EA, Kleinhans NM, Goldberg J, et al. Activation in brain energy regulation and reward centers by food cues varies with choice of visual stimulus. Int J Obes (Lond), 2009, 33(6): 653-661.
[8] Geeraerts B, Oudenhove LV, Dupont P, et al. Different regional brain activity during physiological gastric distension compared to balloon distension: a H215O-PET study. Neurogastroenterol Motil, 2011,23(6): e533-e203.
[9] Raichle ME, Snyder AZ, Powers WJ, et al. A default mode of brain function. Proc Natl Acad Sci U S A. 2001, 98(2): 676-682.
[10] Vanitallie TB. Sleep and energy balance: Interactive homeostatic systems. Metabolism, 2006, 55(10 Suppl 2): S30-35.
[11] Kringelbach ML, de Araujo IE, Rolls ET. Taste-related activity in the human dorsolateral prefrontal cortex. NeuroImage, 2004, 21(2): 781-788.
[12] de Araujo IE, Kringelbach ML, McGlone F, et al. Taste-olfactory convergence, and the representation of the pleasantness of flavour, in the human brain. Eur J Neurosci, 2003, 18(7): 2059-2068.
[13] Small DM, Jones-Gotman M, Dagher A. Feeding-induced dopamine release in dorsal striatum correlates with meal pleasantness ratings in healthy human volunteers. Neuro Image, 2003, 19(4): 1709-1715.
[14] Small DM, Dagher A, Evans AC, et al. Changes in brain activity related to eating chocolate: from pleasure to aversion. Brain, 2001,124(Pt 9): 1720-1733.
[15] Martin LE, Holsen LM, Chambers RJ, et al. Neural mechanisms associated with food motivation in obese and healthy weight adults.Obesity (Silver Spring), 2010, 18(2): 254-260.
[16] Stice E, Yokum S, Bohon C, et al. Reward circuitry responsivity to food predicts future increases in body mass: moderating effects of DRD2 and DRD4. NeuroImage, 2010, 50(4): 1618-1625.
[17] Kelley AE, Baldo BA, Pratt WE. A proposed hypothalamic-thalamicstriatal axis for the integration of energy balance, arousal, and food reward. J Comparat Neurol, 2005, 493(1): 72-85.
[18] Stice E, Spoor S, Bohon C, et al. Relation of reward from food intake and anticipated food intake to obesity: a functional magnetic resonance imaging study. J Abnorm psychol, 2008, 117(4):924-935.
[19] Stoeckel LE, Weller RE, Cook EW 3rd, et al. Widespread rewardsystem activation in obese women in response to pictures of highcalorie foods. NeuroImage, 2008, 41(2): 636-647.
[20] Dosenbach NU, Fair DA, Cohen AL, et al. A dual-networks architecture of top-down control. Trends in cognitive sciences. 2008,12(3): 99-105.
