快速溶剂萃取-凝胶净化-高效液相色谱法测定土壤中6种邻苯二甲酸酯
2018-07-06郭文建李红莉岳太星李洪霞郭文波
郭文建,张 慧,朱 晨,李红莉,岳太星,李洪霞,郭文波
1.山东省环境监测中心站,山东 济南 250101 2.山东大学环境科学与工程学院,山东 济南 250013 3.青岛国家海洋科学研究中心,山东 青岛 266071
邻苯二甲酸酯(PAEs),又称酞酸酯,是一类人工合成可起软化作用的化合物,因其可显著提高塑料的可塑性和强度,被广泛用作增塑剂[1]。此外,它也可作为农药载体、驱虫剂、化妆品、润滑剂、去污剂的生产原料[2]。近年来,随着PAEs的大量生产和广泛使用,此类化合物在各种环境介质(如,空气、土壤、水体)中均被检测到[3]。已有研究表明,该类化合物具有内分泌干扰效应[4],可通过呼吸、饮食、皮肤接触等进入人和动物体内,危害人类健康及生态环境[5]。目前,由PAEs引起的环境污染已经引起了广泛关注。美国环保署(US EPA)已将邻苯二甲酸二甲酯(DMP)、二乙酯(DEP)、正二丁酯(DBP)、邻苯二甲酸二(2-乙基己基)酯(DEHP)、二辛酯(DNOP)、丁基苄基酯(BBP)6种PAEs列入了“优先监测污染物名单”,并制定了相应的土壤环境控制标准及土壤污染治理标准。中国也将DMP、DBP、DOP列入优先控制污染物黑名单[6]。此外,在2005年开始实施的全国土壤污染现状调查专项中,将PAEs列为土壤必测项目之一[7]。
气相色谱法(GC)、气相色谱-质谱法(GC-MS)[8-10]及液相色谱法(HPLC)[11-12]、液相色谱-质谱法(LC-MS)[13-14]是常用的PAEs分析检测手段。由于PAEs的高沸点特性使得应用GC或GC-MS时的难度增加,相比较而言,HPLC适用范围更为广泛,可用于大多数有机化合物的检测分析[15]。此外,要想准确测定环境介质中的PAEs,样品的前处理是必不可少的。索氏提取、微波萃取、超声萃取、快速溶剂萃取(ASE)等是常用的土壤样品前处理方法[16-17]。较其他方法而言,快速溶剂萃取法具有有机溶剂用量少,萃取速率快,回收率高等特点,在固体样品前处理方面表现出很好的应用前景。闫蕊[16]等对比了快速溶剂萃取法、索氏萃取法、超声萃取法下土壤样品中11种PAEs的回收率,以及萃取溶剂使用量、萃取时间等;结果发现,快速溶剂萃取法的回收率最佳、溶剂使用量最少、萃取速率最快,且萃取液的色谱峰干扰少,后2种方法仅对部分PAEs有萃取作用。
当前,文献中报道的PAEs检测方法多为单一PAEs的检测,并未考虑共存污染物的干扰。然而,实际的土壤基质中往往是多种有机污染物共存,在对样品萃取液采用液相色谱法检测时,其他共溶出的有机物往往会干扰PAEs的测定,从而使准确测定PAEs浓度的难度增加。因此,开发可准确测定含共存污染物土壤中PAEs浓度的方法很有必要。多环芳烃(PAHs)是可持续污染物(POPs)的一种,广泛存在于土壤中,且大多数的PAHs 在225 nm波长下均有吸收。因此,共存的PAHs可影响PAEs在其特征吸收波长(200、225、275 nm)下的响应,从而干扰PAEs的准确测定。本文重点是排除共存的PAHs对PAEs测定的干扰,为后续准确测定实际土壤样品中的PAEs提供思路。凝胶净化(GPC)是常用的土壤净化手段,各组分流经凝胶层析净化柱后,可按分子的大小依次被洗脱出来,采集相应时间段的洗脱液,进行后续检测。研究表明,经凝胶渗透色谱净化后,可有效去除土壤中共存污染物对16种PAHs的干扰,且具有好的回收率[18]。此外,在土壤中有机氯农药的测定方面,也得到了应用[19]。目前,还未有关于PAHs共存的情况下高效液相色谱(HPLC)法准确测定PAEs方法的报道。
研究首先通过ASE快速萃取出土壤中共存的16种PAHs与6种PAEs,而后进行凝胶净化,通过对洗脱液的分段收集,去除共存的PAHs对PAEs测定的干扰,从而达到准确测定土壤样品中6种PAEs的目的。
1 实验部分
1.1 仪器与试剂
高效液相色谱仪(日本),配二极管阵列(DAD)和荧光(FLD)检测器;ZORBAX Eclipse Plus C18(150 mm×4.6 mm,5 μm)色谱柱;ASE-350型快速溶剂提取仪(美国),配34 mL萃取池;LC-Tech凝胶渗透色谱仪;Bio-Beads SX-3凝胶层析柱(500 mm×25 mm,粒径37~74 μm);有机样品浓缩仪(瑞典);分析天平(瑞士);硅藻土(美国);石英砂(美国);6种邻苯二甲酸酯,16种PAHs,购自美国AccuStandard公司;二氯甲烷、丙酮、正己烷、环己烷、乙酸乙酯、乙腈均为色谱纯(美国);实验用水为超纯水(美国)。
1.2 标准溶液
6种PAEs及16种PAHs的储备液浓度均为100 mg/L,准确称取一定量的标准物质,以乙腈为溶剂,配成储备液,于 4 ℃下保存。使用时,用乙腈逐级稀释储备液,得到不同浓度的标准混合溶液。
1.3 样品制备
空白加标,准确称取5.00 g石英砂,作为空白土壤样品,加入5 g硅藻土,混合均匀后置于34 mL ASE萃取池中,微量注射器加入一定量的标准混合溶液。
基体(样品)加标,准确称取去除杂质的新鲜土样5.00 g,加入5 g硅藻土,充分混匀、脱水,研磨至散粒状,作为实际土壤样品,置于34 mL ASE萃取池中,微量注射器加入一定量的标准混合溶液。土壤样品干物质测定按照《土壤 干物质和水分的测定 重量法》(HJ 613—2011)执行,样品定量分析时全部以干物质计算。
1.4 样品前处理
将制备好的土壤样品装入34 mL萃取池中,以二氯甲烷-丙酮(体积比为1∶1)为萃取溶剂进行萃取。萃取温度100 ℃,萃取体积为60%,萃取压力为1 500 psi,预热平衡5 min,静态萃取10 min,循环2次,氮气吹扫60 s,收集全部提取液,进入GPC三联机模式(预浓缩-净化-浓缩)。预浓缩参数:浓缩腔温度40 ℃,高真空度0.03 MPa,低真空度0.032 MPa。浓缩参数:浓缩腔温度40 ℃,真空度在0.018 MPa,低真空度0.2 MPa。洗脱溶剂为环己烷-乙酸乙酯(体积比为1∶1),流速5 mL/min,进样量5 mL,收集12~28 min流出液,并浓缩至1 mL(溶剂置换为乙腈),待分析。
1.5 色谱条件
色谱柱:ZORBAX Eclipse Plus C18(150×4.6 mm,5 μm)色谱柱,柱温35 ℃,流速1.0 mL/min,进样量20 μL。流动相:水(A)-乙腈(B)。梯度洗脱程序:0~2 min,流动相B保持为55%;2~6 min,B相由55%线性升至100%,保持9 min;15~16 min,B流动相降为55%,维持2 min。定量波长为225 nm。
2 结果与讨论
2.1 ASE萃取溶剂的选择
二氯甲烷、正己烷、丙酮等是常用的PAEs的萃取溶剂。在US EPA 3500方法中采用正己烷-丙酮混合溶剂、二氯甲烷-丙酮混合溶剂提取固体样品中的PAEs,效果较好。实验对比研究了二氯甲烷-丙酮(体积比为1∶1)、二氯甲烷-正己烷(体积比为1∶1)、丙酮-正己烷(体积比为1∶1)3种萃取溶剂下PAEs的萃取效率,并筛选出最佳的PAEs萃取溶剂。回收率数据表明,经二氯甲烷-丙酮(体积比为1∶1)提取后,6种PAEs的回收率为90%~121.7%,优于其他2种溶剂的萃取效率(图1)。此外,经这3种混合溶剂快速萃取后,PAHs也被萃取出来,且3种混合溶剂作用下16种PAHs的萃取回收率几乎相同,依次为68.7%~122.1%、73.2%~119.0%、61.0%~109.0%。因此,实验选取二氯甲烷-丙酮(体积比为1∶1)作为土壤中PAEs的萃取溶剂。
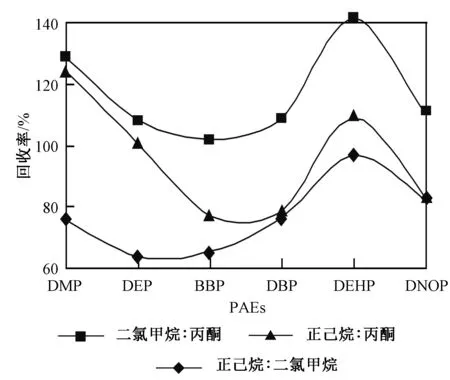
注:3种混合萃取溶剂的体积比均为1∶1。图1 不同萃取溶剂对PAEs回收率的影响Fig.1 Effects of extraction solvent on the recovery of PAEs
2.2 GPC收集时间的确定
一般来说,实际的土壤样品中会含有多种有机污染物,在进行一般的提取处理时,共存污染物往往会同目标物一同萃取到溶剂相中,这可能会对后续目标物的准确定量增加难度。PAHs是可持续污染物的一种,广泛存在于土壤中。研究选定的色谱条件下对16种PAHs进行了液相-紫外检测分析,发现16种PAHs出峰时间在7.5~12.5 min时,会干扰DBP(9.4 min)和BBP(9.7 min)的测定。对比6种PAEs和16种PAHs的流出曲线发现,6种PAEs在28 min已经完全洗脱,而PAHs在26 min后,才开始有萘的洗脱(图2)。因此,准确测定这6种PAEs只需收集12~28 min的流出液,而此时间段的流出液即能够保证土壤中PAHs的有效去除,同时又能够保证被测组分的全部接收。
为验证经GPC净化后,16种PAHs对目标污染物测定的干扰得到了去除,分别对净化前的ASE萃取液和净化后的流出液(12~28 min)进行HPLC检测分析。取2份等量的空白土壤(石英砂),分别与5 g硅藻土混匀,然后加入相同量的PAEs和16种PAHs标准混合溶液,经ASE萃取后,一份样品萃取液经直接浓缩、定容后进行HPLC检测分析(图3)。另一份样品萃取液进行GPC净化处理,收集12~28 min的流出液,此时间段流出液经浓缩、定容后进行检测分析(图4)。对比发现,经GPC净化处理后,16种PAHs的干扰得到了有效去除。这也说明,采用GPC通过收集不同时间段的流出液来去除PAHs对PAEs测定的干扰的思路是可行的。
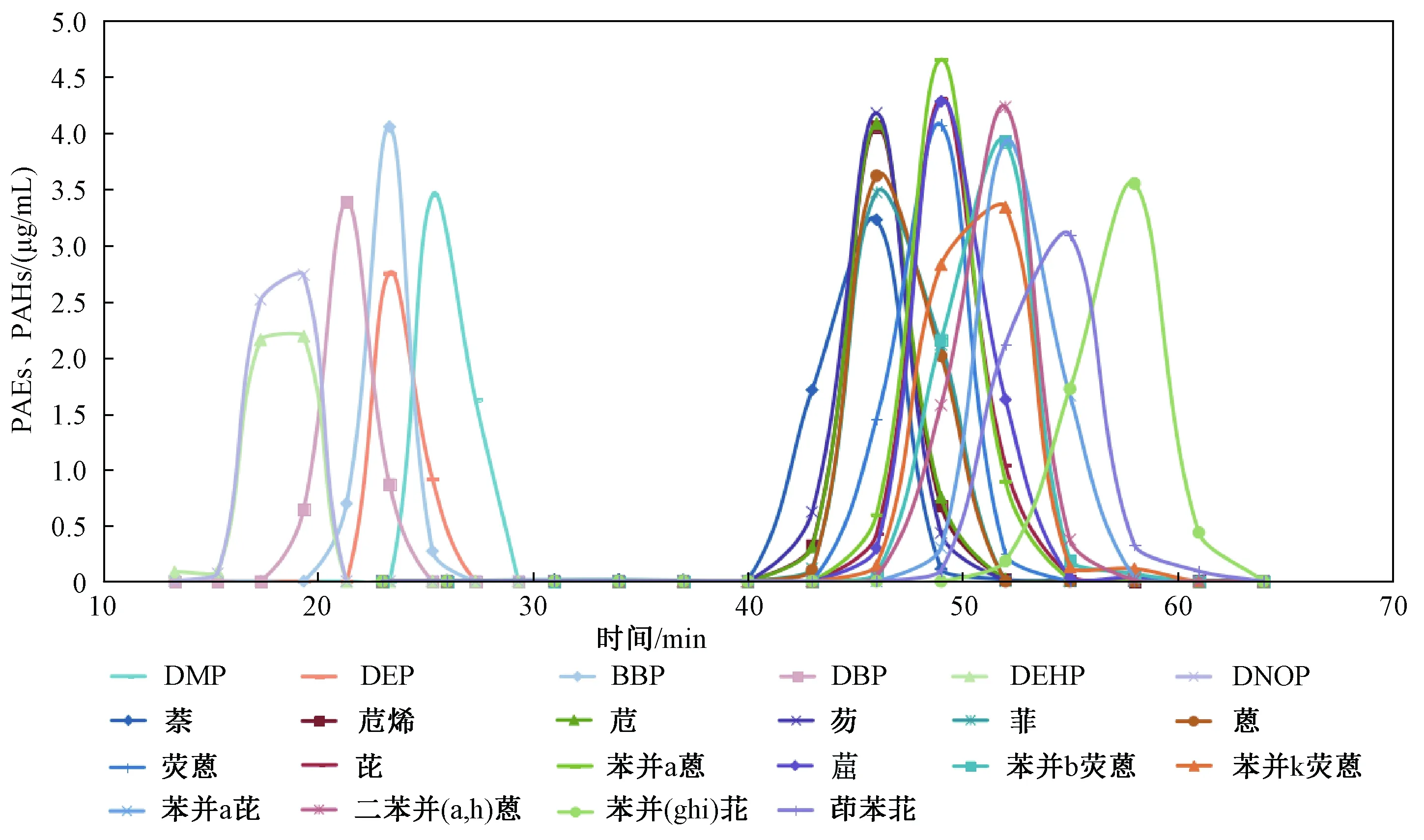
图2 PAEs、PAHs的GPC流出曲线Fig.2 Outflow curves of PAEs and PAHs
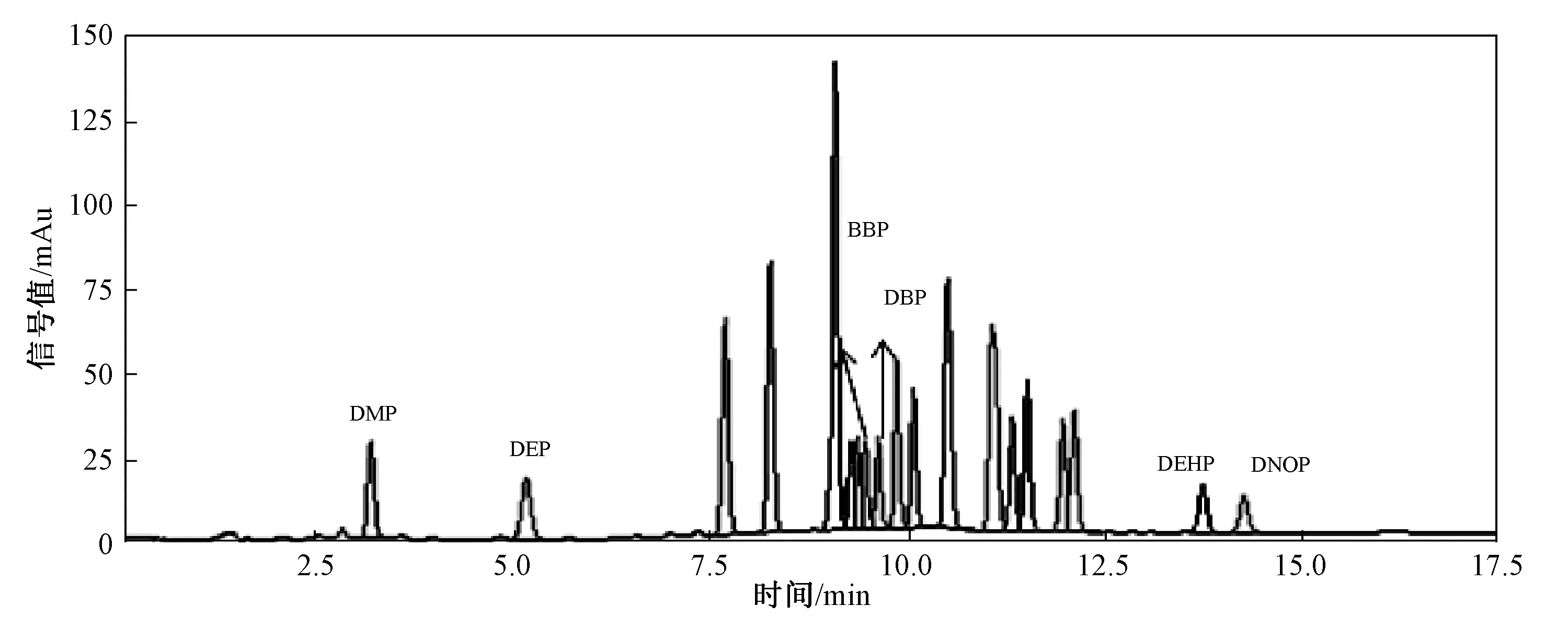
图3 样品净化前色谱图Fig.3 The chromatogram before purification
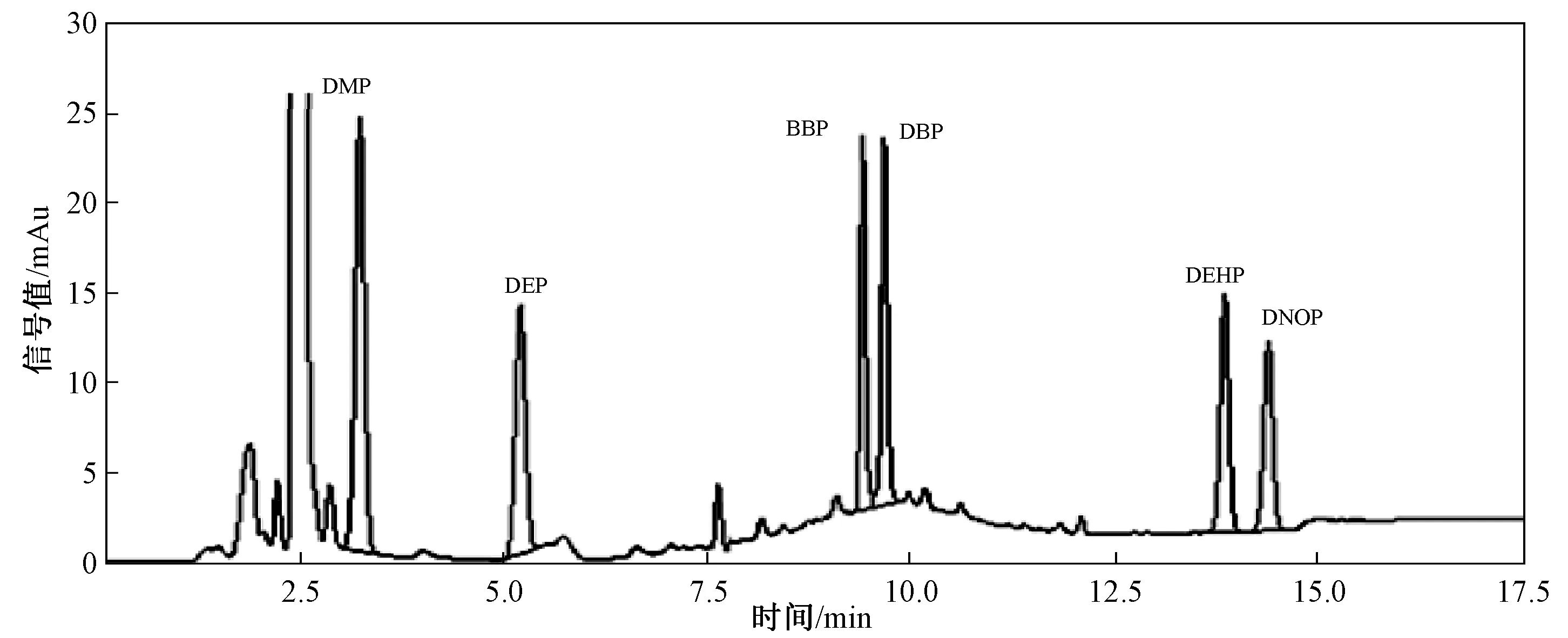
图4 样品净化后色谱图Fig.4 The chromatogram after purification
2.3 方法的验证
2.3.1 校正曲线与检出限
取不同浓度的6种PAEs混合标准溶液(0.25、0.5、1.0、2.5、5.0 μg/mL)分别进样,以峰面积对浓度做线性回归分析。在选定色谱条件下,6种PAEs的线性关系良好,相关系数大于0.999 9。分析7个空白加标样品,计算标准偏差(S)。方法检出限计算公式如下:
MDL=t(n-1,0.99)S
(1)
式中:MDL为方法检出限,t(n-1,0.99)为置信度99%、自由度(n-1)时的t值。求得PAEs的方法检出限,4倍的检出限为其测定下限。如表1所示,6种PAEs的检出限为2.7~11.5 μg/kg,完全满足实际样品的定量分析要求。
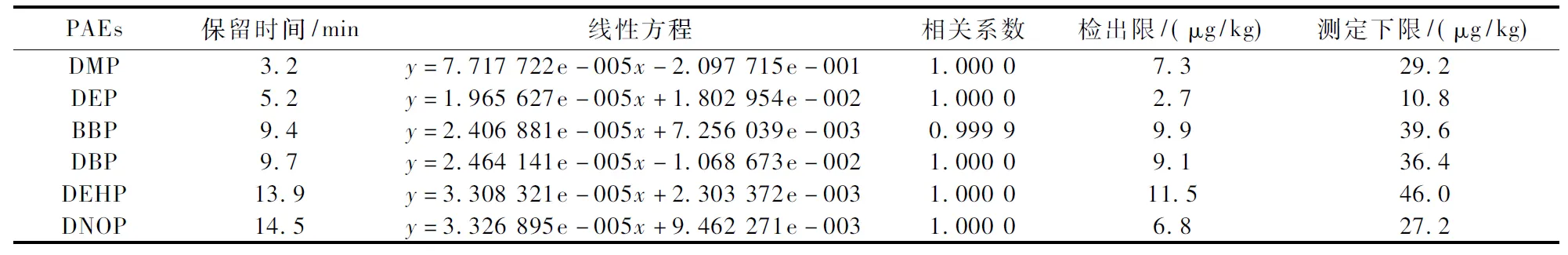
表1 6种PAEs的线性方程与检出限Table 1 Linear equation and detection limits for the determination of six PAEs
2.3.2 方法精密度与准确度
对实验室空白加标样品进行方法精密度与准确度实验,其中,PAEs加标浓度为133 μg/kg;PAHs为66.7 μg/kg,经ASE和GPC后,在最佳色谱条件下,进行6次连续测定。由表2可见,6种PAEs浓度的相对标准偏差为4.23%~10.1%,回收率为76.2%~91.4%,满足检测需求。
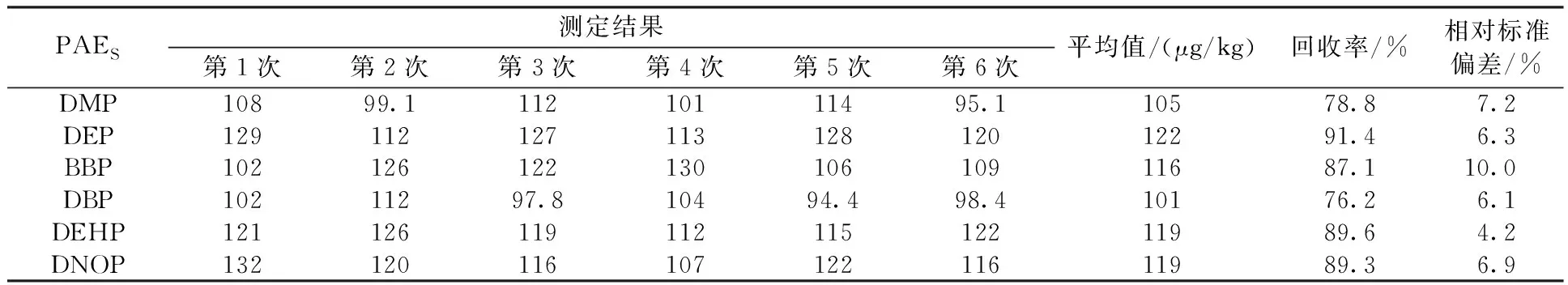
表2 空白加标样品的回收率、精密度Table 2 RSD and recovery rate of blank spiked soil sample
2.4 实际样品分析
对底泥及表层土壤样品进行分析,2种土壤样品均有PAEs检出(表3)。对2种土壤样品进行了加标回收实验,其中,6种PAEs的加标浓度分别为66.7、133、267 μg/kg,16种PAHs的加标浓度为66.7 μg/kg。由表3可见,在底泥和表层土壤2种样品不同加标浓度下,样品的平均加标回收率为66.5%~102%,相对标准偏差为1.5%~9.5%。说明该方法稳定,回收率较高,具有实际应用价值。
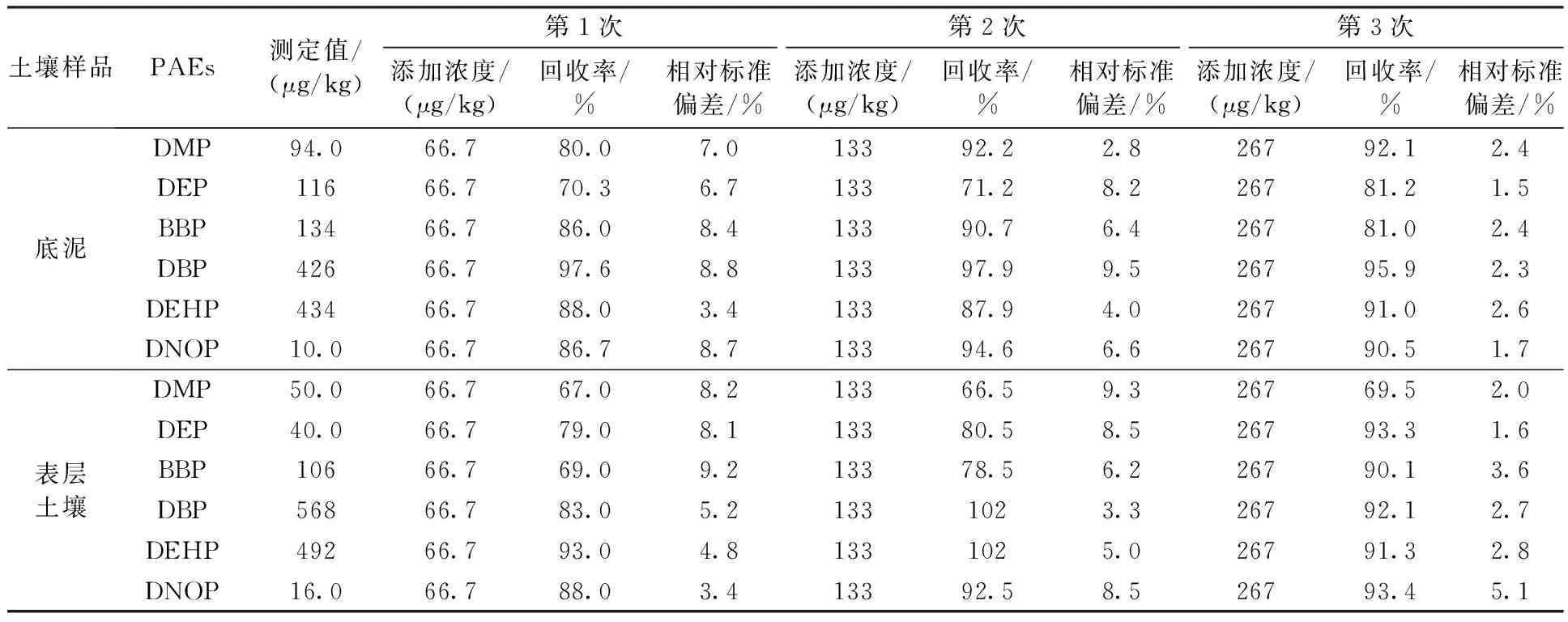
表3 2种土壤样品中6种PAEs的测定值、加标回收率、相对标准偏差(n=6)Table 3 Determination, recovery rate and RSD of two soil samples (n=6)
3 结语
研究采用ASE对土壤中的PAEs进行提取,并过Bio-Beads SX-3凝胶层析柱净化,通过分段收集,消除了土壤中共存的16种PAHs在225 nm紫外波长下对6种PAEs测定的干扰。此方法的回收率为66.5%~102%,检出限为2.7~11.5 μg/kg,相对标准偏差为1.5%~9.5%。方法萃取效率高,精密度及检出限较好,可适用于含PAHs的土壤中PAEs的准确测定,具有较好的实际应用价值。
参考文献(References):
[1] 刘庆,杨红军,史衍玺,等.环境中邻苯二甲酸酯类(PAEs)污染物研究进展[J].中国生态农业学报, 2012, 20(8):968-975.
LIU Qing, YANG Hongjun, SHI Yanxi, et al. Research Progress on Phthalate Esters (PAEs) Organic Pollutants in the Environment [J].Chinese Journal of Eco-Agriculture, 2012, 20(8):968-975.
[2] 王超英,李碧芳,李攻科. 固相微萃取/高效液相色谱联用分析水样中邻苯二甲酸酯[J]. 分析测试学报, 2005, 24(5):35-38.
WANG Chaoying, LI Bifang, LI Gongke. Determination of Phthalate Esters in Water Samples by Solid-Phase Microextraction and High Performance Liquid Chromatography [J]. Journal of Instrumental Analysis, 2005, 24(5):35-38.
[3] 张海光, 孙国帅, 孙磊, 等. 典型覆膜作物土壤中邻苯二甲酸酯污染的初步研究[J]. 中国环境监测, 2013, 29(4):124-124.
ZHANG Haiguang, SUN Guoshuai, SUN Lei,et al. Preliminary Study on Phthalic Acid Esters Pollution of Typical Plastic Mulched Crops Soils[J]. Environmental Monitoring in China, 2013, 29(4):60-63.
[4] STAPLES C A, PETERSON D R, PARKERTON T F, et al. The Environmental Fate of Phthalate Esters:a Literature Review [J]. Chemosphere, 1997, 35(4):667-749.
[5] 刘慧杰, 舒为群. 邻苯二甲酸酯类化合物的毒理学效应及对人群健康的危害[J]. 第三军医大学学报, 2004, 26(19):1 778-1 781.
LIU Huijie, SHU Weiqun. Toxicolgical Effect and Risk of Phthalate Acid Esters on the Health of Population[J]. Acta Academiae Medicinae Miltaris Tertiae, 2004, 26(19):1 778-1 781.
[6] 蒋丽佳,许秋瑾,梁存珍,等. 江苏某县地下水邻苯二甲酸酯类的检测与风险评价[J]. 中国环境监测, 2013, 29(4):5-10.
JIANG Lijia, XU Qiujin, LIANG Cunzhen, et al.Detection and Risk Assessment of Phthalates in Groundwater in a Country of Jiangsu Province[J]. Environmental Monitoring in China, 2013, 29(4):5-10.
[7] 陈永山,骆永明,章海波,等. 设施菜地土壤酞酸酯污染的初步研究[J]. 土壤学报, 2011, 48(3):516-523.
CHEN Yongshan, LUO Yongming, ZHANG Haibo, et al.Preliminary Study on PAEs Pollution of Greenhouse Soils[J]. Acta Pedologica Sinica, 2011, 48(3):516-523.
[8] PENALVER A, POCURULL E, BORRULL F, et al. Determination of Phthalate Esters in Water Samples by Solid-Phase Microextraction and Gas Chromatography with Mass Spectrometric Detection [J]. Journal of Chromatography A, 2000, 872(1):191-201.
[9] 王玲玲,王潇磊,刘丹,等. 土壤介质中酞酸酯类污染物分析方法研究[J]. 中国环境监测, 2009, 25(4):4-7.
WANG Lingling, WANG Xiaolei, LIU Dan, et al. Study on the Accuracy & Precision of the Method of Anlysis Phthalate Esters in Soil[J]. Environmental Monitoring in China,2009,25(4):4-7.
[10] 朱媛媛,田靖,王伟,等.土壤中15种酞酸酯类化合物测定[J].中国环境监测,2009, 25(2):79-83.
ZHU Yuanyuan, TIAN Jing, WANG Wei, et al. Determination of 15 Kinds of Phthalate in Soil [J]. Environmental Monitoring in China, 2009, 25(2):79-83.
[11] 曹攽,马军,刘清辉.索氏提取-液相色谱法测定土壤中邻苯二甲酸酯类物质[J]. 地质学刊, 2011, 35(1):73-77.
CAO Ban, MA Jun, LIU Qinghui. Determination of Phthalic Acid Esters in Soils by Soxhlet Technology-High Precision Liquid Chromatography [J]. Journal of Geology, 2011, 35(1):73-77.
[12] 徐磊,夏宁.在线固相萃取/高效液相色谱法测定环境水样中的4种痕量邻苯二甲酸酯[J].分析测试学报, 2011, 30(5):558-561.
XU Lei, XIA Ning. Determination of Four Trace Phthalates in Water by Online SPE Coupled with High Performance Liquid Chromatography[J]. Journal of Instrumental Analysis, 2011, 30(5):558-561.
[13] 刘超,李来生,王上文,等. 液相色谱-电喷雾质谱联用法测定饮料中的邻苯二甲酸酯[J].色谱, 2007, 25(5):766-767.
LIU Chao, LI Laisheng, WANG Shangwen, et al. Determination of Phthalates in Drink by HPLC-ESI-MS. Chinese Journal of Chromatography, 2007, 25(5):766-767.
[15] 沈小明,时磊,吕爱娟,等. 高效液相色谱-二极管阵列检测器测定邻苯二甲酸酯色谱条件优化[J]. 中国环境监测,2015,31(6):97-102.
SHEN Xiaoming, SHI Lei, LYU Aijuan, et al. Optimization of Chromatographic Conditions for Determination of Phthalic Acid Esters by High Performance Liquid Chromatography with Diode Array Detector[J]. Environmental Monitoring in China, 2015, 31(6):97-102.
[16] 闫蕊,邵明媛,孙长华,等. 加速溶剂萃取-高效液相色谱串联质谱法测定土壤中邻苯二甲酸酯[J].分析化学,2014,42(6):897-903.
YAN Rui, SHAO Mingyuan, SUN Changhua, et al. Determination of 11 Phthalic Acid Esters in Soil by Accelerated Solvent Extraction-Liquid Chromatography Tandem Mass Spectrometry[J]. Chinese Journal of Analytical Chemistry, 2014, 42(6):897-903.
[17] 邵海洋,徐刚,吴明红,等.加速溶剂萃取-气相色谱串联质谱法检测沉积物中痕量增塑剂[J].分析化学, 2013, 41(9):1 315-1 321.
SHAO Haiyang, XU Gang, WU Minghong, et al. Determination of Phthalate Esters in Sediment Using Accelerated Solvent Extraction and Gas Chromatography-Mass Spectrometry[J]. Chinese Journal of Analytical Chemistry, 2013, 41(9):1 315-1 321.
[18] 张茜,刘潇威,罗铭,等.快速溶剂(ASE)提取,凝胶渗透色谱(GPC)联合固相萃取(SPE) 净化,高效液相色谱法测定土壤中的多环芳烃[J].环境化学, 2011, 30(4):771-777.
ZHANG Qian, LIU Xiaowei, LUO Ming, et al. Determination of Polycyclic Aromatic Hydrocarbons in Soil by ASE-GPC-SPE Purification and HPLC Detection[J]. Envrionmental Chemistry, 2011, 30(4):771-777.
[19] 陈啟荣, 郎爽, 魏岩, 等. 加速溶剂萃取-凝胶色谱净化-气质联用测定土壤中15种有机氯农药残留的方法研究[J]. 分析测试学报, 2010, 29(5):473-477.
CHEN Qirong, LANG Shuang, WEI Yan, et al. Determination of 15 Organochlorine Pesticides in Soil by Gas Chromatography-Mass Spectrometry with Accelerated Solvent Extraction and Gel Permeation Chromatograph[J]. Journal of Instrumental Analysis, 2010, 29(5):473-477.
