平面细胞极化通路基因突变与神经管缺陷的关联研究
2018-07-06肖艳慧田甜李智文张乐李楠靳蕾王琳琳任爱国
肖艳慧 田甜 李智文 张乐 李楠 靳蕾 王琳琳 任爱国
神经管缺陷(neural tube defects, NTDs)是一种严重的先天性疾病,它是由于在胚胎发育过程中,神经管闭合不全所引起的一组缺陷,包括无脑畸形、脊柱裂、脑膨出等。NTDs是新生儿和胎儿常见的出生缺陷之一,全球平均发生率为1/1000[1]。中国是全世界NTDs高发国家之一,北方地区高于南方地区,农村地区高于城市地区[2]。尽管中国孕前及孕早期增补叶酸取得一定效果[3],但在2014年中国北方地区NTDs患病率仍高达31.5/万[4],说明增补叶酸未能完全预防NTDs的发生,因此阐明NTDs病因仍具有重要意义。
NTDs的遗传因素中,平面细胞极化(planar cell polarity pathway, PCP)通路近十年受到关注最多,它对于组织形态发生和胚胎发育的调节至关重要,通过影响神经板形成过程中的汇聚延伸,参与神经管闭合[5]。人群研究发现VANGL1/2[6-8]、CELSR1-3[9-10]、SCRIB[10-11]、DVL2/3[12]、FZD3/6[13]等PCP基因缺陷可导致NTDs表型发生,但主要聚焦于罕见突变,鲜有常见突变位点与NTDs的关联研究。
本研究首先对456例NTDs病例进行VANGL1、VANGL2、DVL2、CELSR及SCRIB等基因外显子区测序,根据测序结果选择最小等位基因频率(MAF)>5%、位于编码区的SNP位点,然后对459例对照的单核苷酸多态性(single nucleotide polymorphism, SNP)位点进行分型,探索PCP通路常见突变位点与NTDs发生的关联,从而进一步探究PCP通路基因在NTDs的发病机制。
对象与方法
一、对象
本次研究对象来自北京大学生育健康研究所于2002年起在山西6个区县所募集的神经管缺陷病例及对照,涉及的区县包括平定、昔阳、太谷、泽州、寿阳、长治。研究对象纳入条件包括(1)病例为产前诊断终止妊娠或出生时发现的NTDs患儿,对照为无结构缺陷的正常胎儿或新生儿;(2)母亲为山西省常住居民(在本地居住两年以上),且本次妊娠期间在本地居住;(3)同意参加研究并签署书面知情同意书。排除条件为病例或对照母亲的调查问卷缺失。本研究获得北京大学生物医学伦理委员会审批,在进行问卷调查和采集标本前,均征得每位研究对象父亲或母亲的书面知情同意书。
二、方法
1.调查问卷收集及生物样本采集:通过面对面问卷调查,获得NTDs病例和对照父母的基本社会人口信息及环境暴露信息。问卷调查由经过统一培训的调查员完成。调查表的流行病学资料采用双录入和逻辑核查,对数据录入进行质量控制。本次研究中基本信息包括母亲本次妊娠时的年龄、职业和文化程度等。采集NTDs病例、对照的脐带血、皮肤或脐带组织等生物学样本,其中脐带血以纸血片方式保存于-20度冰箱,皮肤或脐带组织保存于-80度冰箱。
2.目标基因测序:首先使用德国凯杰QIAamp DNA Mini Kit(250)51306试剂盒提取病例及对照的DNA。其中生物样本类型有纸血片、皮肤、脐带,根据试剂盒说明书进行DNA提取。运用Fast-Target多重目的区域富集测序方法,对NTDs病例的VANGL1、VANGL2、DVL2、CELSR1及SCRIB等基因外显子区进行测序[14]。FastTarget富集测序技术针对选取的PCP基因外显子区域设计多重PCR扩增体系,富集目的片段,对基因组区域进行捕获富集。一个扩增反应体系可以完成16~20个PCR反应,直接获得4 Kb左右的基因组区域,后续利用Illumina Miseq测序仪(美国Illumina公司MiSeq,NextSeq 500)的2×250 bp测序模式对目的片段实现双向测序,对所获得测序数据进行生物信息学的读取、质量控制及分析。
3.目标突变位点的选取:根据FastTarget富集测序结果,选取位于目标基因外显子区且MAF>5%的常见SNP位点。使用Haploview软件从常见位点中挑选标签SNP(tag SNP)从而保证所选基因信息尽可能的最大化。将所选取的tag SNP位点在(https://agenacx.com/)网站上进行引物设计,最终有6个常见突变位点可进行Sequenom MassARRAY基因分型。
4.目标突变位点的基因分型:常见突变位点rs4839469(VANGL1),rs17380141(VANGL2),rs2074216(DVL2),rs222836(DVL2),rs8141744(CELSR1),rs6558394(SCRIB)在对照中进行Sequenom MassARRAY基因分型。实验步骤包括PCR反应、扩增、纯化、引物延伸、点样、质谱分析、分型。
5.统计学处理:应用SPSS 19.0软件进行统计分析。对于病例及对照母亲的基本人口学特征分析,计量资料以均数±标准差表示,组间比较采用独立样本t检验;计数资料采用χ2检验。对于基因型分析,首先检验对照组基因型频率是否符合Hardy-Weinberg 平衡;使用χ2检验比较病例-对照组间基因型分布;应用Logistic回归分析,调整母亲年龄、文化程度及职业后,计算比值比(OR)及其95%置信区间,以表示基因型发生频率在病例-对照组间的相对危险度。P<0.05 为差异有统计学意义。
结 果
本次研究共包含456个NTDs病例和459个对照,其中NTDs病例包括无脑畸形202例,脊柱裂254例。病例和对照均为汉族。与对照组相比,病例组中母亲高中及以上文化程度的比例较小。其他变量如母亲年龄及职业两组差异均无统计学意义。NTDs病例及对照母亲的基本人口学特征见表1。各位点的基本特征见表2。
在对照人群中,所有位点的基因型频率均符合Hardy-Weinberg 平衡(P>0.05)。应用Sequenom MassARRAY方法在对照组中基因分型位点峰图见图1。
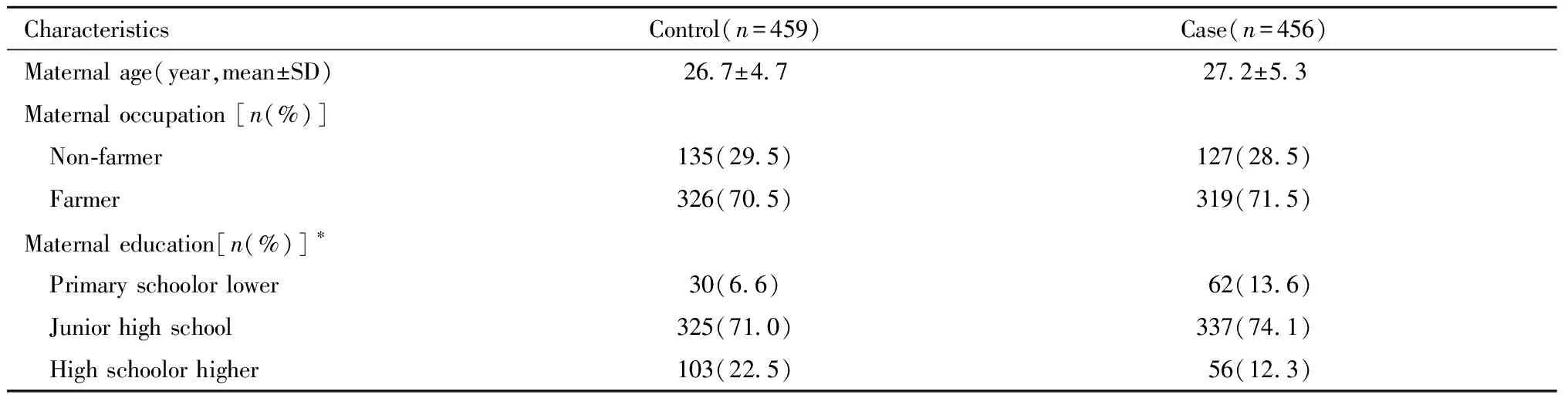
表1 NTDs病例及对照的基本人口学特征
Note:Comparison of the results with the two groups,*P<0.05

表2 各SNP位点相关信息
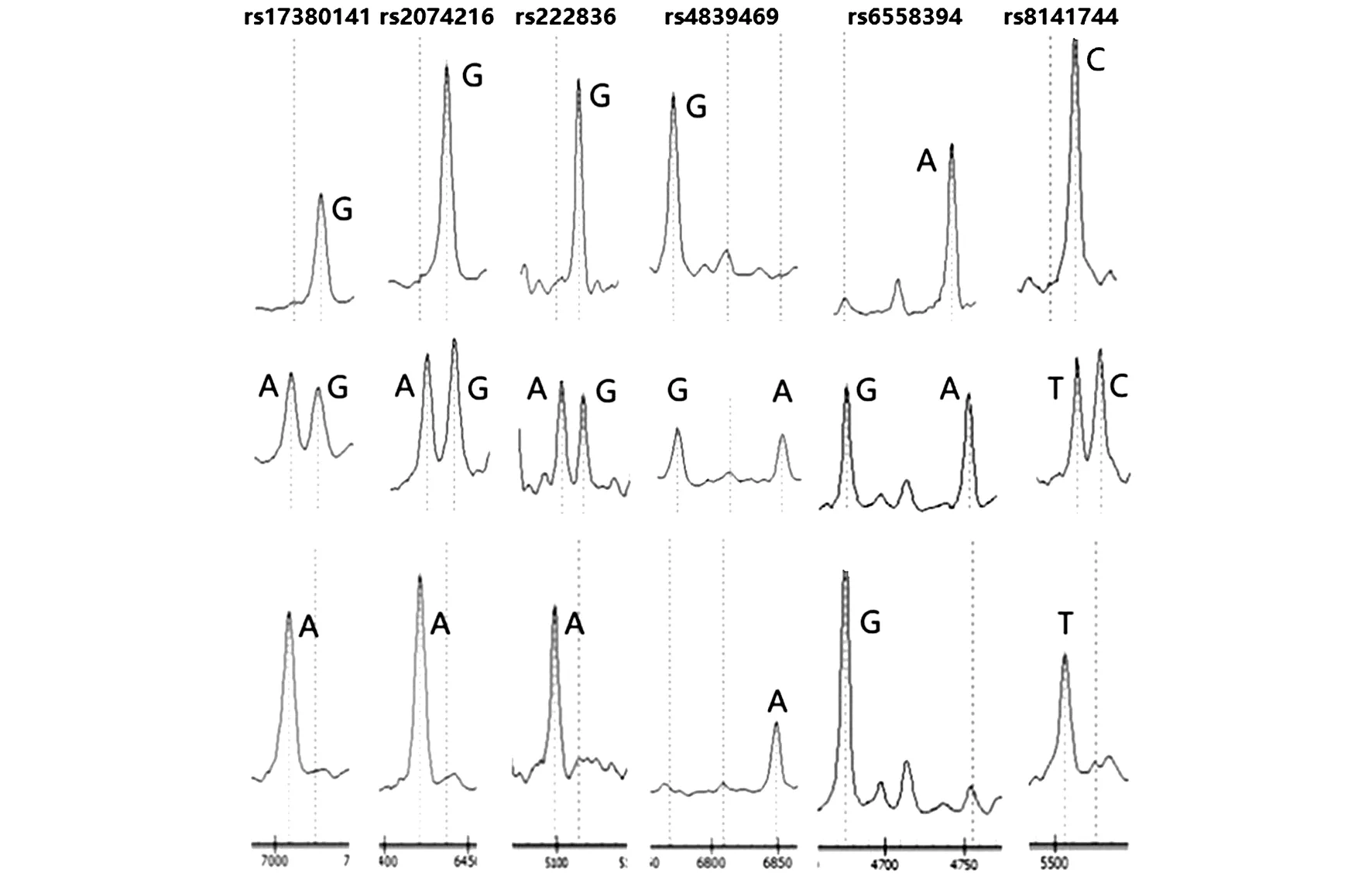
图1 各SNP位点Sequenom MassARRAY峰图Figure 1 Sequenom MassARRAY peak Plots for SNPs
卡方检验结果显示,在病例组中SCRIB基因上的rs6558394位点AG &GG基因型频率高于对照组(显性模式),差异有统计学意义,且病例组AA、AG、GG基因型频率与对照组相比差异有统计学意义(共显性模式)。其他位点病例组基因型频率与对照组相比差异均无统计学意义。见表3。

表3 各SNP位点的病例对照的卡方检验结果Table 3 Chi-square test results for each SNP locus in case-control study
Note: Compared with the control group,*P<0.05
在调整了母亲年龄、文化程度、职业后,Logistic回归分析结果显示,位于SCRIB基因上的rs6558394位点AG&GG基因型与AA基因型相比(显性模式),增加NTDs发生的风险[OR=1.63, 95%CI=(1.07,2.47)];且相比AA基因型,AG基因型增加NTDs发生风险[OR=1.73, 95%CI=(1.12,2.68)],未发现GG基因型与NTDs发生有关。见表4。
讨 论
NTDs病因复杂,由基因和环境共同作用导致,PCP信号通路是神经管闭合过程的重要环节。PCP通路是高度保守的非经典Wnt信号通路,其核心基因包括Frizzled(Fzd)、Van Gogh(Vang)、Flamingo(Fmi)、Dishevelled(Dsh/Dvl)、Prickle(Pk)、Diego(Dgo)。在本研究中,选取较多文献报道的与NTDs发生有关的PCP通路基因,包括VANGL1/2、CELSR1、DVL2及SCRIB。
Note:ORvalues were adjusted for maternal age, education and occupation levels.
SCRIB基因位于8号染色体,它编码的蛋白是LAP蛋白家族(leucine rich repeats and PSD-95/Discs Large/ ZO-1)的成员,具有16个富含亮氨酸的重复序列和4个PDZ结构域[15]。当SCRIB突变时,影响其PDZ结构域与其他蛋白质(包括具有PDZ结合结构域的VANGL2蛋白)产生的物理交互作用[16]。在环尾小鼠(circle tail)模型中使用定位克隆方法发现由于一个单碱基插入,造成一个框架移位并导致SCRIB蛋白的提前终止,证明Scrib表达与Crc / Crc突变小鼠中观察到的表型缺陷密切相关[17]。在一项美国人群研究中对192名脊柱裂婴儿和190名健康对照者的SCRIB基因进行测序,在患者中确定了5个有害罕见错义突变,其中三个突变(p.P1043L,p.P1332L,p.L1520R)显著影响SCRIB蛋白的亚细胞定位[11]。在另外一项36例欧洲白人颅脊柱裂患者的人群研究中,使用重测序的方法发现SCRIB基因上两个潜在致病突变位点(p.R1535Q,p.P454S),同样导致亚细胞蛋白质定位显著改变,并减少或消除了PCP蛋白运输至质膜[10]。以上研究表明,SCRIB中的罕见错义突变可能与人类NTDs的发生有关。rs6558394是SCRIB基因外显子区的常见错义突变,未见目前该位点与NTDs的关联研究。在上述36例欧洲白人颅脊柱裂患者的研究中发现,颅脊柱裂患儿的rs6558394位点G基因频率为26/72,但由于没有观察对照组的突变基因频率,故不能阐释 rs6558394位点与NTDs发生的关联[10]。在本研究中,位于SCRIB基因上的rs6558394位点AG基因型或合并GG基因型发生NTDs的风险高于AA基因型,提示G等位基因可能是NTDs发生的风险等位基因。在共显性模式下,相比于AA基因型,AG基因型增加NTDs发生的风险,却未发现GG基因型与NTDs存在关联。考虑到本研究所应用的病例对照研究方法不能排除人群分层混杂的影响,可能导致了GG基因型与NTDs的不真实关联,需要进一步通过病例家系/对照(家系)混合研究方法,控制人群分层混杂因素,对其进行验证性研究。
VANGL1和VANGL2是同源基因,每一个基因都有四个预测跨膜结构域和一个胞质结构域,其中包括重要的蛋白质-蛋白质相互作用结构域,即C末端卷曲螺旋结构域和PDZ结合基序[18]。Kibar等[19]首次在小鼠模型中发现PCP通路上的Vangl2基因变异与NTDs发生有关。以往人群研究多聚焦于在NTDs患者的VANGL1和VANGL2基因上发现一些罕见突变[7-8, 20]。有关VANGL1和VANGL2基因常见突变与NTDs的关联研究较少。rs4839469位点是位于VANGL1基因外显子区的常见错义突变,本研究结果显示,卡方检验中发现AA基因型频率略高于对照组,但在调整了母亲年龄、文化程度、职业等混杂因素后发现该位点与NTDs发生无关,这一结果与Kibar在284例意大利人病例及389例美国人病例中的结果一致[7]。此外,在本研究还发现位于VANGL2基因上的常见突变rs17380141位点与NTDs发生无关,这也与先前研究一致[8]。
rs2074216、rs222836是DVL2基因上的同义突变位点,rs8141744是CELSR1基因上的同义突变位点。尽管在人群及动物研究中均发现DVL2和CELSR1基因罕见突变与NTDs的关联,但目前尚无rs2074216、rs222836、rs8141744的相关研究。在本研究中并未发现这三个常见突变位点与NTDs发生有关。
本研究的优势在于,相比先前研究,本研究NTDs病例样本量大,有利于探讨PCP基因常见突变位点与NTDs关联;此外,本研究是一项基于中国北方汉族人群的研究,目前尚无此人群关于SCRIB、DVL2等PCP基因与NTDs的病例对照研究的相关报道。
本研究利用中国北方汉族NTDs病例及对照的数据,检测PCP基因外显子区的常见突变位点与NTDs的关联,发现位于SCRIB基因的rs6558394位点AG基因型或合并GG基因型增加NTDs发生的风险。本研究初步揭示了在人群研究中PCP通路相关基因SCRIB上rs6558394位点与NTDs的关系,但仍需进一步的机制研究。
1 Mitchell LE.Epidemiology of neural tube defects.Am J Med Genet C Semin Med Genet,2005,135c:88-94.
2 裴丽君,李竹,李松,等.中国神经管畸形高低发地区季节及性别分布特征.中华流行病学杂志,2003,6:465-470.
3 Berry RJ,Li Z,Erickson JD,et al.Prevention of neural-tube defects with folic acid in China.China-U.S.Collaborative Project for Neural Tube Defect Prevention.N Engl J Med,1999,341:1485-1490.
4 Liu J,Zhang L,Li Z,et al.Prevalence and trend of neural tube defects in five counties in Shanxi province of Northern China,2000 to 2014.Birth Defects Res A Clin Mol Teratol,2016,106:267-274.
5 Ybot-Gonzalez P,Savery D,Gerrelli D,et al.Convergent extension,planar-cell-polarity signalling and initiation of mouse neural tube closure.Development,2007,134:789-799.
6 Bartsch O,Kirmes I,Thiede A,et al.Novel VANGL1 Gene Mutations in 144 Slovakian,Romanian and German Patients with Neural Tube Defects.Mol Syndromol,2012,3:76-81.
7 Kibar Z,Bosoi CM,Kooistra M,et al.Novel mutations in VANGL1 in neural tube defects.Hum Mutat,2009,30:E706-715.
8 Kibar Z,Salem S,Bosoi CM,et al.Contribution of VANGL2 mutations to isolated neural tube defects.Clin Genet,2011,80:76-82.
9 Qiao X,Liu Y,Li P,et al.Genetic analysis of rare coding mutations in CELSR1-3 in Chinese Congenital Heart and Neural Tube Defects.Clin Sci (Lond),2016,pii:CS20160686.[Epub ahead of print].
10 Robinson A,Escuin S,Doudney K,et al.Mutations in the planar cell polarity genes CELSR1 and SCRIB are associated with the severe neural tube defect craniorachischisis.Hum Mutat,2012,33:440-447.
11 Lei Y,Zhu H,Duhon C,et al.Mutations in planar cell polarity gene SCRIB are associated with spina bifida.PLoS One,2013,8:e69262.
12 De Marco P,Merello E,Consales A,et al.Genetic analysis of disheveled 2 and disheveled 3 in human neural tube defects.J Mol Neurosci,2013,49:582-588.
13 De Marco P,Merello E,Rossi A,et al.FZD6 is a novel gene for human neural tube defects.Hum Mutat,2012,33:384-390.
14 Zhang Z,Li C,Wu F,et al.Genomic variations of the mevalonate pathway in porokeratosis.Elife,2015,4:e06322.
15 Bryant PJ,Huwe A.LAP proteins:what's up with epithelia? Nat Cell Biol,2000,2:E141-143.
16 Kallay LM,McNickle A,Brennwald PJ,et al.Scribble associates with two polarity proteins,Lgl2 and Vangl2,via distinct molecular domains.J Cell Biochem,2006,99:647-664.
17 Murdoch JN,Henderson DJ,Doudney K,et al.Disruption of scribble (Scrb1) causes severe neural tube defects in the circletail mouse.Hum Mol Genet,2003,12:87-98.
18 Murdoch JN,Doudney K,Paternotte C,et al.Severe neural tube defects in the loop-tail mouse result from mutation of Lpp1,a novel gene involved in floor plate specification.Hum Mol Genet,2001,10:2593-2601.
19 Kibar Z,Vogan KJ,Groulx N,et al.Ltap,a mammalian homolog of Drosophila Strabismus/Van Gogh,is altered in the mouse neural tube mutant Loop-tail.Nat Genet,2001,28:251-255.
20 Kibar Z,Torban E,McDearmid JR,et al.Mutations in VANGL1 associated with neural-tube defects.N Engl J Med,2007,356:1432-1437.
