中性粒细胞/淋巴细胞比值、血小板/淋巴细胞比值及平均血小板体积与系统性红斑狼疮活动度的相关性研究
2018-07-05覃凤娴陈纪飞戴盛明
覃凤娴,韦 维,邹 燕,陈纪飞,戴盛明
(广西医科大学第四附属医院医学检验科,广西柳州 545005)
系统性红斑狼疮(SLE)是由自身免疫介导的一种慢性异质性自身免疫病,其特点是疾病过程中产生大量自身抗体同时激活机体补体系统,导致多器官多脏器的损伤[1]。SLE的治疗需根据病情活动度的变
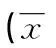
表1 SLE组与对照组各观察指标比较±s)
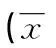
表2 SLE患者活动组与非活动组各观察指标比较±s)
化调整治疗方案。因此,SLE的活动度监测对疾病疗效至关重要。目前,临床主要根据SLE疾病活动指数(SLEDAI)评分判断患者病情活动度[2]。该评分标准不仅包括客观的实验室检测指标,还包括医生主观评价指标,具有一定的主观性。因此,有必要寻找更多的可反映SLE患者病情活动度的检测指标。机体的免疫系统异常是引起SLE发病的主要因素之一。无限制活化的免疫系统导致抗原抗体免疫复合物沉积,补体系统异常激活,炎性细胞因子大量释放,从而造成疾病的发生及恶化[3]。此外,慢性炎症在自身免疫疾病的发生、发展中也发挥重要作用[4]。由环境或遗传因素刺激的慢性炎症是多数自身免疫性疾病的一个共同特征[5]。C反应蛋白(CRP)、红细胞沉降率(ESR)及干扰素等炎性标志物已被证实与SLE的进展密切相关[6-8]。外周血中性粒细胞/淋巴细胞比值(NLR)、血小板/淋巴细胞比值(PLR)及平均血小板体积(MPV)是参与炎性反应及反映炎症系统激活的一类敏感指标[9-11]。作为炎症的新型生物学指标,可能与自身免疫性疾病的进展相关。然而,三者在SLE中的研究甚少。本研究拟通过检测100例SLE患者NLR、PLR及MPV,探讨三者与SLE疾病活动度的相关性。
1 资料与方法
1.1一般资料 收集本院2014年1月至2017年11月SLE住院患者100例(SLE组),男46例,女54例,年龄21~63岁,诊断参照美国风湿病学会(ACR)1997年修订的SLE分类诊断标准[12]。根据疾病活动度将SLE组患者再分为两个亚组:SLEDAI评分大于10分者纳入活动组(n=58),≤10分者纳入非活动组(n=42)。排除标准:(1)其他自身免疫性疾病患者,如类风湿性关节炎、干燥综合征;(2)感染性疾病患者;(3)动脉粥样硬化性疾病患者;(4)血液系统疾病患者。同时选取本院47例体检健康者为对照组,男22例,女25例,年龄19~62岁。本研究经本院伦理委员会审核批准。
1.2方法 采集所有受试者清晨空腹静脉血2 mL于乙二胺四乙酸二钾(EDTA-K2)抗凝管中,混匀,4 h内使用日本Sysmex公司XN-3000型血细胞分析仪及其配套试剂检测血细胞参数,分别计算NLR、PLR及MPV。同时所有受试者采集无抗凝血3 mL,离心分离血清,采用罗氏702型生化分析仪及配套试剂检测血清补体C3(C3)和CRP。另抽取外周静脉血2~3 mL,经枸橼酸钠抗凝后及时采用改良魏氏法检测ESR。

2 结 果
2.1SLE组与对照组各观察指标比较 SLE组与对照组NLR、PLR、MPV、ESR及C3、CRP水平比较,差异均有统计学意义(P<0.01或P<0.05),见表1。
2.2各观察指标与疾病活动度的关系 SLE患者活动组与非活动组NLR、PLR、MPV、ESR及C3、CRP水平比较,差异均有统计学意义(P<0.01或P<0.05),见表2。
2.3活动组SLE患者治疗前后NLR、PLR、MPV及SLEDAI评分比较 进一步对入院时病情处于活动期的58例SLE患者(SLEDAI评分≥10)进行随访,经2个月的治疗后,患者NLR、PLR及SLEDAI评分较治疗前降低,MPV较治疗前升高,差异均有统计学意义(P<0.01或P<0.05),见表3。
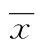
表3 活动组SLE患者治疗前NLR、PLR、MPV及SLEDAI评分比较(n=58,±s)
2.4各观察指标的相关性分析 Pearson相关分析显示,SLEDAI评分与NLR、PLR呈正相关(r=0.779、0.542,P<0.05),与MPV呈负相关(r=-0.236,P<0.05)。同时,将NLR、PLR及MPV分别与CRP、C3及ESR进行相关性分析,结果显示,NLR、PLR均与CRP水平呈正相关(r=0.622、0.547,P<0.05),与ESR亦呈正相关(r=0.684、0.579,P<0.05),与C3呈负相关(r=-0.702、-0.618,P<0.05);MPV与CRP、ESR均呈负相关(r=-0.321、-0.347,P<0.05),与C3呈正相关(r=0.318,P<0.05)。
3 讨 论
SLE可产生大量的免疫复合物沉积到组织器官,补体系统的激活可以清除免疫复合物,但此过程会引起补体的大量消耗,因此传统观念认为补体水平降低,尤其是C3水平下降是SLE活动的重要标志。机体炎症也是诱发自身免疫性疾病的原因之一。机体在炎性反应时可释放一系列抑制性的免疫介质,导致机体免疫功能紊乱及肿瘤免疫逃避,同时也引起造血系统功能的改变,从而导致患者外周血相关指标的变化[13-14]。NLR、PLR及MPV被认为是新的炎性指标。本研究发现,与对照组比较,SLE组患者NLR和PLR明显升高,MPV明显下降;经过治疗后,活动期SLE患者NLR和PLR明显下降,MPV明显上升,且这3项指标均与SLE患者的SLEDAI评分相关。表明NLR、PLR升高及MPV下降是SLE活动的内在特征,这3项炎性指标可用来评估SLE患者的疾病活动。
在SLE的疾病进展中细胞因子发挥着重要的作用,而白细胞和血小板参与这些细胞因子的生成。最近的研究表明,白细胞计数及其亚型具有预测炎症过程的价值,其中NLR被认为是近年来新发现的炎性指标[15]。NLR是两种不同却互补的免疫途径的比值。中性粒细胞主要参与非特异性炎性反应,可以分泌多种炎性因子;淋巴细胞则主要代表了免疫系统调控途径[16],二者结合可以更好地反映机体的炎症状态[17]。SLE患者的PLR反映疾病的活动度[18-19]。MPV作为血小板的重要参数之一,是研究最为广泛的血小板活化标记物,MPV水平随者病情的变化出现明显波动,并与机体炎症程度、疾病预后等具有一定的相关性。在一些慢性炎性疾病中,如类风湿性关节炎、强直性脊柱炎、慢性阻塞性肺疾病急性发作期,MPV被认为是一种重要的炎性标志物[20-22]。本研究结果显示,与对照组比较,SLE组患者NLR和PLR均明显增高,MPV明显下降,这与其他研究者的结论一致[23-24]。因此,可以将NLR、PLR及MPV作为SLE的炎性指标,表明NLR、PLR及MPV对SLE疾病监控具有潜在的价值。根据SLEDAI评分进一步将SLE患者分为活动组和非活动组,结果显示活动组NLR和PLR明显高于非活动组,而MPV明显低于非活动组。Pearson相关分析结果显示,SLEDAI评分与NLR、PLR呈正相关,与MPV呈负相关。提示NLR、PLR及MPV对SLE疾病的活动度具有一定的预测价值。
另外,本研究对目前较公认的SLE活动指标C3、CRP和ESR也进行检测。SLE患者的CRP水平和ESR较对照组均明显升高,C3水平明显下降,与其他研究报道一致[25-26]。进一步分析NLR、PLR、MPV与CRP、ESR及C3的相关性,结果发现NLR和PLR分别与CRP、ESR呈正相关,与C3呈负相关;而MPV与CRP、ESR呈负相关,与C3呈正相关。以上研究结果进一步表明,外周血NLR、PLR和MPV可能是评价SLE疾病活动度的3个潜在指标。
综上所述,NLR、PLR和MPV的改变是SLE的内在特征,可以作为新的炎性标志物评估SLE的疾病活动。同时,NLR、PLR和MPV是一类非特异性炎性指标,由于采集患者外周血进行血细胞参数分析即可获得这3个指标,并不增加患者的负担和痛苦。因此,NLR、PLR和MPV可作为方便、快速、经济的检测指标,应用于SLE患者的活动度及病情评估。
[1]RAHMAN A,ISENBERG D A.Systemic lupus erythematosus[J].N Engl J Med,2008,358(9):929-939.
[2]GLADMAN D D,IBAEZ D,UROWITZ M B.Systemic lupus erythematosus disease activity index 2000[J].J Rheumatol,2002,29(2):288-291.
[3]TIAN X P,ZHANG X.Gastrointestinal involvement in systemic lupus erythematosus:insight into pathogenesis,diagnosis and treatment[J].World J Gastroenterol,2010,16(24):2971-2977.
[5]GOODNOW C C.Multistep pathogenesis of autoimmune disease[J].Cell,2007,130(1):25-35.
[6]REZAIEYAZDI Z,SAHEBARI M,HATEF M R,et al.Is there any correlation between high sensitive CRP and disease activity in systemic lupus erythematosus?[J].Lupus,2011,20(14):1494-1500.
[7]KEENAN R T,SWEARINGEN C J,YAZICI Y.Erythrocyte sedimentation rate and C-reactive protein levels are poorly correlated with clinical measures of disease activity in rheumatoid arthritis,systemic lupus erythematosus and osteoarthritis patients[J].Clin Exp Rheumatol,2008,26(5):814-819.
[8]STOJAN G,FANG H,MAGDER L,et al.Erythrocyte sedimentation rate is a predictor of renal and overall SLE disease activity[J].Lupus,2013,22(8):827-834.
[9]TEMPLETON A J,ACE O,MCNAMARA M G,et al.Prognostic role of platelet to lymphocyte ratio in solid tumors:a systematic review and meta-analysis[J].Cancer Epidemiol Biomarkers Prev,2014,23(7):1204-1212.
[10]PAN L L,DU J,LI T T,et al.Platelet-to-lymphocyte ratio and neutrophil-to-lymphocyte ratio associated with disease activity in patients with Takayasu′s arteritis:a case-control study[J].BMJ Open,2017,7(4):e014451-e014451.
[11]MAYDA H,AHSEN A,BAGCIOGLU E,et al.The effect of increased neutrophil-to-lymphocyte ratio (NLR) and decreased mean platelet volume (MPV) values in acute mania to inflammation[J].Noropsikiyatri ARSIVI,2016,53(4):317-320.
[12]HOCHBERG M C.Updating the American college of rheumatology revised criteria for the classification of systemic lupus erythematosus[J].Arthritis Rheum,1997,40(9):1725.
[13]QI Q,GENG Y,SUN M,et al.Clinical implications of systemic inflammatory response markers as Independent prognostic factors for advanced pancreatic cancer[J].Pancreatology,2015,15(2):145-150.
[14]JIANG N,DENG J Y,LIU Y,et al.The role of preoperative neutrophil-lymphocyte and platelet-lymphocyte ratio in patients after radical resection for gastric cancer[J].Biomarkers,2014,19(6):444-451.
[15]MCMILLAN D C.Systemic inflammation,nutritional status and survival in patients with cancer[J].Curr Opin Clin Nutr Metab Care,2009,12(3):223-226.
[16]李影,闫鹏.胰岛素抵抗的分子学机制[J].医学综述,2014,20(17):3122-3124.
[17]ZAHOREC R.Ratio of neutrophil to lymphocyte counts--rapid and simple parameter of systemic inflammation and stress in critically ill[J].Bratisl Lek Listy,2001,102(1):5-14.
[18]FU H,QIN B,HU Z,et al.Neutrophil- and platelet-to-lymphocyte ratios are correlated with disease activity in rheumatoid arthritis[J].Clin Lab,2015,61(3/4):269-273.
[19]USLU A U,KÜÇÜK A,SAHIN A,et al.Two new inflammatory markers associated with Disease Activity Score-28 in patients with rheumatoid arthritis:neutrophil-lymphocyte ratio and platelet-lymphocyte ratio[J].Int J Rheum Dis,2015,18(7):731-735.
[22]ULASLI S S,OZYUREK B A,YILMAZ E B,et al.Mean platelet volume as an inflammatory marker in acute exacerbation of chronic obstructive pulmonary disease[J].Pol Arch Med Wewn,2012,122(6):284-290.
[23]QIN B D,MA N,TANG Q Q,et al.Neutrophil to lymphocyte ratio (NLR) and platelet to lymphocyte ratio (PLR) were useful markers in assessment of inflammatory response and disease activity in SLE patients[J].Modern Rheumatol,2016,26(3):372-376.
[24]DELGADO-GARCIA G,ANGEL GALARZA-DELGADO D A,DAVID BORJAS-ALMAGUER O A,et al.Mean platelet volume is decreased in adults with active lupus disease[J].Rev Bras Reumatol,2016,56(6):504-508.
[25]俞晓洁,潘立勇,陈永健.系统性红斑狼疮患者血清补体C3和C4水平及相关因素探讨[J].中国卫生检验杂志,2010,20(10):2511-2513.
[26]ILLEI G G,TACKEY E,LAPTEVA L,et al.Biomarkers in systemic lupus erythematosus.I.General overview of biomarkers and their applicability[J].Arthritis Rheum,2004,50(6):1709-1720.
