尿脱落细胞琼脂石蜡双包埋连续切片法
2018-07-05郭智俊彭桂香
郭智俊,彭桂香
(广东省人民医院南海医院/佛山市南海第二人民医院病理科,广东佛山 528251)
泌尿系肿瘤是我国常见的恶性肿瘤之一,尿脱落细胞检查对泌尿系肿瘤的早期诊断、术后随访的意义已得到公认。常规的尿脱落细胞检查采用涂片法,该方法无创、快速、操作简易,在临床工作中得到了广泛应用。但常规涂片法细胞少而分散,细胞核易退变成毛玻璃状;当标本含有大量血液时,涂片见成片的红细胞,常常出现细胞堆积、重叠、厚薄不均匀,细胞结构及背景不清晰,细胞从玻片脱落等现象,往往导致癌细胞检出率低。近年来,切片技术在胸腔积液、腹水和痰脱落细胞学中的应用,提高了制片质量,但未见尿脱落细胞切片的研究报道。笔者在实际工作中经过研究探索,设计了尿脱落细胞琼脂石蜡双包埋连续切片法,克服了常规尿脱落细胞涂片法的缺点,现报道如下。
1 材料与方法
1.1仪器与试剂
1.1.1仪器 采用普通水平式离心机,石蜡切片采用病理科的常规组织切片程序。
1.1.2试剂配制 (1)5%琼脂:称取琼脂粉5 g置三角烧杯中,加蒸馏水100 mL加热煮沸使琼脂充分溶解,置65 ℃恒温箱中,保持熔化状态备用。(2)0.3%伊红乙醇溶液:0.3 g伊红加入95%乙醇溶液至100 mL。(3)10%醋酸乙醇溶液:10 mL冰醋酸加入95%乙醇溶液至100 mL。
1.2方法
1.2.1标本留取 为患者备好一个容量为500 mL 以上的洁净尿瓶,加入10%醋酸乙醇溶液100 mL,并在其100 mL处作一标记,备用。将晨起第2次尿液排入上述备用的尿瓶内,或者嘱患者在排空膀胱后,饮水500 mL左右,于1~2 h后收集第1次膀胱排空的尿液200~300 mL于上述备用的尿瓶中送病理科检查。
1.2.2标本处理 将收到的尿液标本静止沉淀30 min,慢慢倒掉尿液至100 mL标记处,并将此尿液分装在两个50 mL的离心管中,或者将尿液分装在8个15 mL的离心管中,经1 800 r/min离心沉淀5 min,弃上清液;然后将沉淀物集中到一支试管内,经1 800 r/min离心沉淀5 min,弃上清液,取少量沉淀物做直接涂片2张,常规苏木精-伊红(HE)染色;再在剩余的沉淀物中加入0.3%伊红乙醇溶液1~2 mL,以2 000 r/min离心8 min,吸去上清液,将保留管底沉淀物的试管置65 ℃恒温箱中备用。
1.2.3沉淀物琼脂石蜡双包埋处理 将5%琼脂从65 ℃恒温箱中取出。同时从恒温箱中取出保留管底沉淀物的试管,加入熔化的琼脂1~3滴,放置冰箱待冷凝固成细胞团块后取出细胞团块,用刀片将其周围的琼脂切去。将细胞团块放入已编号的包埋盒中,置脱水机常规脱水、透明、浸蜡,取出细胞团块进行石蜡包埋。或者将细胞团块放入已编号的包埋盒中进行人工脱水,步骤:(1)乙醇甲醛混合液(95%乙醇9份,浓甲醛1份)中30 min;(2)95%乙醇Ⅰ20 min;(3)95%乙醇Ⅱ30 min;(4)100%乙醇Ⅰ20 min;(5)100%乙醇Ⅱ30 min;(6)叔丁醇Ⅰ20 min;(7)叔丁醇Ⅱ30 min;(8)石蜡(熔点52 ℃)Ⅰ30 min;(9)石蜡(熔点58~60 ℃)Ⅱ30 min。以上各步骤均放置在62 ℃的恒温箱中进行。取出细胞团块进行石蜡包埋。
1.2.4连续切片和染色 蜡块修整齐,越小越好,连续切片,沉淀物少的标本一次切完,不换刀,不移动刀片。切片应薄而均匀,切片厚度为3~4 μm,贴片时水温要恰当,使蜡片伸展无皱折,将切片分别贴在普通载玻片和涂胶载玻片上,每张载玻片根据切片的大小按顺序排列3~6排,其中第1~3片贴在普通载玻片上,第4~6片贴在涂胶载玻片上,按顺序以此类推。普通载玻片按常规方法脱蜡、HE染色、封片;涂胶载玻片留做备用。
2 结 果
包埋好的蜡块经过切片、HE染色后,镜下细胞量明显比常规涂片法丰富,细胞集中,厚薄均匀,结构清晰,核质对比好,色彩鲜艳明亮,部分可见组织结构,易于观察诊断,见表1、图1、2。
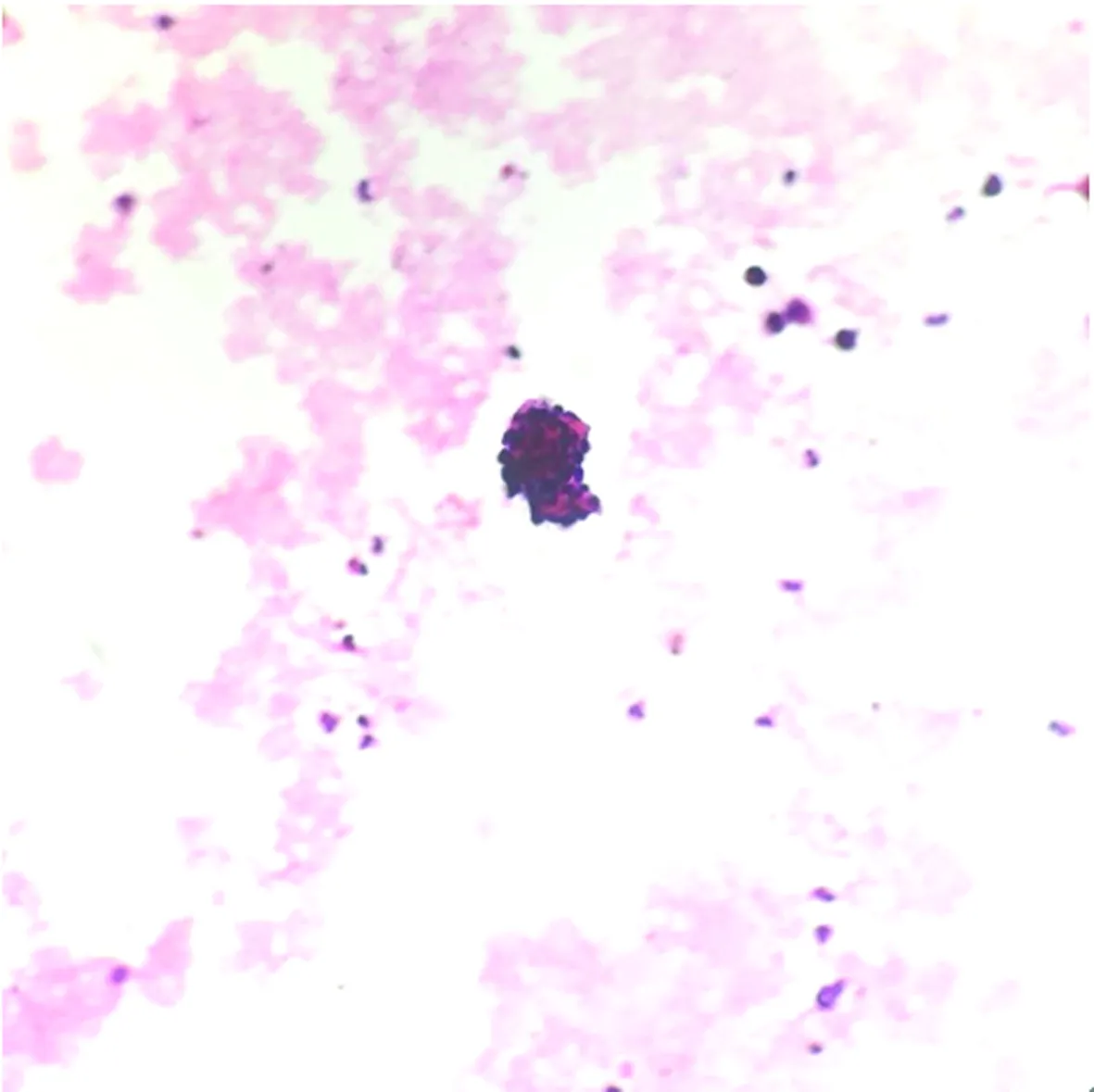
图1 尿脱落细胞涂片法镜检(HE×200)

质量指标/方法涂片法切片法细胞数量较少较多镜下观察范围观察范围大,费时观察范围小,省时细胞变形及退变 常见偶见

续表1 两种方法制片质量比较
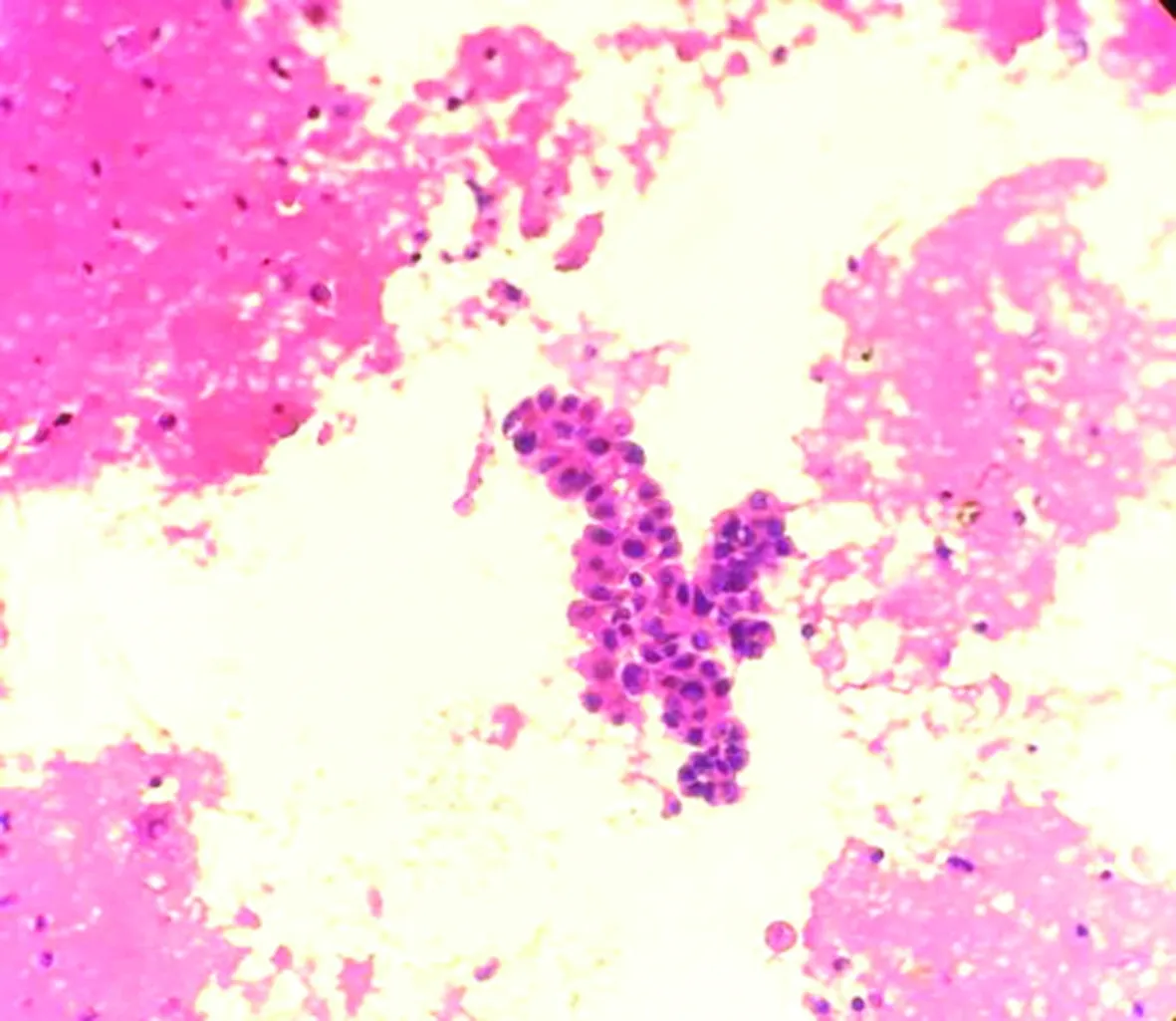
图2 尿脱落细胞切片法镜检(HE×200)
3 讨 论
尿路上皮分布广泛,从肾盂、肾盏、输尿管、膀胱直到尿道起始部。尿路上皮细胞癌是继前列腺/乳腺癌、肺癌和结直肠癌后第4种最常见的肿瘤类型[1]。尿路上皮细胞癌中膀胱癌最常见,占所有尿路上皮细胞癌的90%~95%[2]。膀胱癌的发病率和病死率在泌尿系统疾病中均居首位[3]。虽然其恶性程度低,但复发率较高[4],一旦发生侵袭或转移预后极差[5]。因此,早期发现并给予积极治疗是提高临床治愈率的关键[6-8]。目前膀胱癌的诊断主要以膀胱镜、尿脱落细胞学和荧光原位杂交技术(FISH)为主,然而三者都存在一定缺陷[9-10],膀胱镜检查是目前术前诊断和术后随访的“金标准”,膀胱镜虽然在检查过程中能够很好地直观病灶及取样活检,但是膀胱镜是有创检查,患者往往很抵触这种昂贵、痛苦的侵入性检查,在临床应用中受到了很大的制约;同时,膀胱镜由于观察范围有限并依赖操作者的经验,可能会遗漏位于膀胱前壁和肾小盏等难以窥视部位的肿瘤,另外一些平坦型病变或原位癌也是膀胱镜检查的盲区[11]。FISH诊断膀胱癌的特异性与常规尿脱落细胞相当,且敏感性大大提高,优于尿脱落细胞检查,有研究表明该检测有着较高的灵敏度(70%~96%)及特异度(65%~96%)[12-14]。但是,FISH检测费用昂贵,在一定程度上增加了患者的经济负担,同时其所需设备及技术要求高、操作流程复杂,大范围普及有一定的难度。超声、X射线、CT和磁共振成像(MRI)影像学检查,虽然整个尿路的情况能够显示出来,但对于血尿患者中常见的占位性病变如血凝块、炎性包块和肿瘤不易鉴别,常常不能明确病灶的性质。
尿液脱落细胞学检查是临床泌尿系肿瘤的有效筛查手段[15-16]。尿脱落细胞学检测膀胱癌的灵敏度为13%~75%,特异度为85%~100%,其特异度不但是目前无创诊断指标中最高的,而且也得到了美国国立综合癌症网络(NCCN)指南作为无创诊断指标的惟一推荐。其在原位癌的诊断中具有较高价值[17]。尿脱落细胞学检查不受肿瘤部位的限制,即使在发病早期由于肿瘤细胞代谢旺盛仍可有较多的癌细胞从病灶表面脱落,可以通过细胞学的方法早期发现及诊断。尿脱落细胞学检查方法简便,可反复多次检查,且可以发现膀胱镜检查不易观察到的特殊部位肿瘤,对患者无损伤,安全、经济、特异性较高,容易被患者接受,因此在基层医院广泛应用。但尿脱落细胞涂片检查的缺点是灵敏度低[18]。尿脱落细胞涂片检查灵敏度低的原因是:(1)传统的留尿方法是每天留取早晨第2次尿的中段尿10 mL,由于只留取10 mL中段尿,常常导致离心后无沉淀物,涂片镜下细胞成分少或看不到细胞成分,从而影响尿脱落细胞检出率;此外,在送病理科之前未对尿液标本进行处理,细胞成分易被变性。(2)常规尿液涂片法涂片范围大,镜下细胞分散、观察费时,易漏诊。(3)涂片细胞固定较困难,如果用湿固定法,直接将玻片放入95%乙醇内固定,会造成大多数细胞脱落,造成漏诊,导致出现假阴性;如果干燥后再固定,细胞会发生退变,细胞核模糊不清,造成误诊,导致出现假阳性。(4)当尿液中有较多细胞时,特别是血尿患者有大量红细胞时,常规涂片镜下细胞出现堆积重叠现象,造成诊断困难。为了克服涂片法的不足,笔者设计了尿脱落细胞琼脂石蜡双包埋连续切片法,该方法收集晨起的第2次全部尿液,收集尿液更多,阳性率更高。同时,由于在留取尿液标本中加入了10%醋酸乙醇溶液,细胞在液体中立即固定,避免常规涂片后空气干燥造成的细胞退变,保持了原有的细胞形态结构;其中的醋酸也能溶解过多的红细胞,既避免红细胞遮挡、细胞重叠,又节省了阅片时间,减少了漏诊,提高了工作效率。标本离心处理过程中加入0.3%伊红乙醇溶液,使沉淀物着色,便于在包埋、切片和漂片时辨认。琼脂是一种从海藻类石花菜中提取的多分支的复杂多糖,具有三维空间网状多孔性结构,琼脂溶解度为90 ℃,凝固度为40 ℃。同时,琼脂易溶于水,在室温下几分钟就能凝固。琼脂具有凝固性、稳定性、支持性和耐切割性,在浸蜡的温度下仍为固态。由于固态琼脂含有网状孔隙,所以在脱水、透明、浸蜡的过程中乙醇、二甲苯或叔丁醇和石蜡都可通过琼脂渗透到组织细胞中,不影响组织细胞的脱水、透明和浸蜡。琼脂的浓度不能太高,低浓度的琼脂更有利于脱水剂、透明剂和石蜡的渗透;但浓度也不可太低,以保持其形状完整,不易碎裂为宜。本文使用5%琼脂达到了良好的效果。尿脱落细胞用琼脂包埋后,在脱水、透明、浸蜡的过程中既可以避免细胞及碎小组织丢失及其他细胞、碎小组织的混入,又可克服尿脱落细胞沉淀物太小所造成的包埋困难。用该方法几乎能收集尿液中的所有细胞,制成的蜡块进行连续切片,各细胞及碎小组织可以完整切出,防止由于切片不完全所造成的漏诊。同时,笔者采取的贴片方法有利于切片连续不乱,整齐排列,每张载玻片可多贴切片,既节省载玻片又有利于显微镜下观察。制出的切片镜下细胞量明显比常规离心涂片法丰富,切片观察范围比涂片小,观察省时,细胞无重叠,厚薄一致,细胞结构及背景清晰,部分可见组织结构;HE染色核质对比好,色彩鲜艳明亮,可提高尿脱落阳性细胞的检出率。同时,蜡块便于长期保存及进行免疫细胞化学等检测。
综上所述,尿脱落细胞琼脂石蜡双包埋连续切片法克服了常规涂片法的不足,设备简单,操作简便,费用低廉,在尿路上皮癌的诊断和术后监测上具有重要的临床意义,值得普及推广应用,尤其是可以作为基层医院的常规筛查方法。同时,笔者目前正在研究应用尿脱落细胞涂片法和尿脱落细胞琼脂石蜡双包埋连续切片法进行对比观察并进行免疫细胞化学等检测,进一步寻找早期诊断膀胱癌的特异度和灵敏度更高的诊断指标,从而降低假阳性率和假阴性率。
[1]MONTEIRO-REIS S,LECA L,ALMEIDA M,et al.Accurate detection of upper tract urothelial carcinoma in tissue and urine by means of quantitative GDF15,TMEFF2 and VIM promoter methylation[J].Eur J Cancer,2014,50(1):226-233.
[2]ALTIERI V M,CASTELLUCCI R,PALUMBO P,et al.Recurrence and progression in non-muscle-invasive bladder cancer using EORTC risk tables[J].Urol Int,2012,89(1):61-66.
[3]韩苏军,张思维,陈万青,等.中国膀胱癌发病现状及流行趋势分析[J].癌症进展,2013,11(1):89-95.
[4]KIM S Y,MYUNG S J.Optical molecular imaging for diagnosingintestinal diseases[J].Clinic Endosc,2013,46(6):620-626.
[5]那彦群.中国泌尿外科疾病诊断治疗指南[M].北京:人民卫生出版社,2013:21-28.
[6]宋正尧,梁朝朝,江长琴,等.FISH技术在中国人膀胱尿路上皮癌诊断及复发监测中应用的研究[J].临床泌尿外科杂志,2011,26(11):823-826.
[7]沈瑞存,邵可可.新辅助化疗在经尿道膀胱肿瘤电切术中的应用[J].实用药物与临床,2014,17(7):875-878.
[8]何非平.吡柔比星不同灌注方法对膀胱癌术后复发的影响[J].实用药物与临床,2014,17(1):50-52.
[9]RAITANEN M P,KAASINEN E,LUKKARINEN O,et al.Analysis of false-positive BTA STAT test results in patients followed up for bladder cancer[J].Urology,2001,57(4):680-684.
[10]INOUE T,NASU Y,TSUSHIMA T,et al.Chromosomal numerical aberrations of exfoliated cells in the urine detected by fluorescence in situ hybridization:clinical implication for the detection of bladder cancer[J].Urol Res,2000,28(1):57-61.
[11]TSCHIRDEWAHN S,VOM DORP F.Diagnostics of nonmuscle-invasive urothelial cell carcinoma of the bladder[J].Urologe A,2015,54(4):480-483.
[12]MALKHASIAN K A,PETROV S V,
UL′IANIN M I,et al.Use of fluorescent in situ hybridization in the cytogenetic diagnosis of urinary bladder urothelial carcinoma[J].Vopr Onkol,2011,57(4):462-469.
[13]XU C,ZENG Q,HOU J,et al.Utility of a modality combining FISH and cytology in upper tract urothelial carcinoma detection in voided urine samples of Chinese patients[J].Urology,2011,77(3):636-641.
[14]JIA X,YU Q,ZHANG Z H,et al.Targeting bladder tumor cells in voided urine of Chinese patients with FITC-CSNRDARRC peptide ligand[J].Onco Targets Ther,2012(5):85-90.
[15]MILICIC V,PRVULOVIC I,PANDA N,et al.Diagnostic value of cytology of voided urine[J].Coil Antropol,2014,38(2):617-620.
[16]RAGHAVAN D,SHIPLEY W U,GARNICK M B,et al.Biology and management of bladder cancer[J].N Engl J Med,1990,322(16):1129-1138.
[17]PROCTOR I,STOEBER K,WILLIAMS G H.Biomarkers in bladder cancer[J].Histopathology,2010,57(1):1-13.
[18]URQUIDI V,ROSSER C J,GOODISON S.Multiplex urinary tests for bladder cancer diagnosis[J].Eur Med J Urol,2013(1):70-73.
