耐多药肺结核外科治疗术后短期化疗效果分析
2018-07-05何美惠
杨 丹,夏 勇,赵 攀,何美惠
(1.重庆市公共卫生医疗救治中心重症医学科 400036;2.重庆市公共卫生医疗救治中心急诊科 400000; 3.重庆市两江新区第一人民医院胸外科 401122)
结核病的治疗在全球范围内一直是医学的挑战和重任,全球约22亿潜伏结核感染者,860万人被确诊为耐药结核,每年新增耐药结核66万人,其中死亡人数高达15万[1-2]。耐多药肺结核(multidrug-resistant pulmonary tuberculosis,MDR-PTB)是指结核病患者排出的结核分枝杆菌至少对利福平和异烟肼两种或两种以上的抗结核药物耐药。结核病特别是MDR-PTB、广泛耐药结核病(extensively drug-resistant tuberculosis,XDR-TB)已成为世界公共卫生难题,MDR-PTB目前已成为全球结核病疫情快速回升的最重要原因,治愈难度大,给结核病的防控造成新的挑战。截至2014年,仅50%的耐药肺结核患者获得了成功的治疗[3]。按照标准化治疗耐药结核,至少需要5种抗结核药物,治疗疗程为18~24个月。由于耐药结核的诊断程序复杂、疗程较长、治疗费用昂贵,患者恢复慢,不良反应多,缺乏有效治疗手段,治愈率低,复发率及病死率高等原因,较多患者未得到及时有效的治疗,导致耐药率逐步上升,形成恶性循环。因此,为MDR-TB患者选择合适有效的治疗方案,缩短治疗疗程,提高依从性,减少耐药肺结核的发生,减少传染源,对改善耐药结核的现状至关重要。2008年WHO在《耐药结核病规划管理指南》紧急修订版[4]中提出,对MDR-PTB患者需采用包括外科手术在内的综合治疗方法。本研究旨在分析对有手术指针的MDR-PTB患者,术后予以敏感药物化疗能否有效缩短化疗疗程,从而降低治疗费用,提高患者依从性,为广泛开展外科治疗MDR-PTB的可行性提供理论依据。
1 资料与方法
1.1一般资料 选取2015年5月至2016年12月在重庆市公共卫生医疗救治中心胸外科及高新区第一人民医院胸外科行手术治疗的MDR-PTB患者183例,依据随机分配原则,将患者随机分为观察组与对照组。观察组中入组患者91例,男51例,女40例,术后依据随机分配原则,将其再分为3个亚组:6个月疗程组(组1,28例)、12个月疗程组(组2,31例)、18个月疗程组(组3,32例)。对照组入组患者92例,男48例,女44例。纳入观察组患者除痰培养阳性,菌型鉴定为结核分枝杆菌,药敏试验证实对利福平、异烟肼同时耐药外,还需满足以下4个条件[5-6]:(1)在正规治疗过程中痰菌持续阳性或反复阳性且病灶局限;(2)存在毁损肺、结核空洞、结核球等可引起结核病复发病灶的痰菌阴性;(3)肺结核引起支气管胸膜瘘、脓胸、咯血等并发症;(4)病灶相对局限,但多数MDR-PTB的病变范围累及多肺叶、双侧,则需多肺叶为结节样或纤维条索样病灶。两组患者性别、年龄、病情等一般资料比较,差异无统计学意义(P>0.05),具有可比性,见表1。所有患者入组前均签署知情同意书,本研究经医院伦理委员会审核批准。
1.2方法
1.2.1治疗及随访 根据药敏结果,观察组按照WHO《耐药结核病化学治疗指南(2010)》[7]术前进行药物化疗2个月后手术切除病肺,手术方式与普通胸部手术的肺叶或肺段切除术相同,采用单侧肺切除、肺叶切除、肺段切除、楔形切除等,术后继续进行4~16个月化疗,3个亚组分别继续敏感药物化疗6、12、18个月),总化疗疗程6~18个月。对照组依据患者的结核药敏结果,选择敏感药物进行化疗。两组服药期间均每月随访1次,停药后每3个月随访1次,随访12~24个月。
1.2.2疗效评价标准 观察组与对照组每月进行血常规、尿常规、肝肾功能、痰涂片检测抗酸杆菌等检查,每2个月行痰结核培养(痰培养阳性者予以药敏试验),每3个月予以胸部CT检查。疗效评价标准[8]:(1)治愈。标准参照《耐药结核病化学治疗指南(2010)》。(2)病情恶化。①痰涂片/痰培养阳性,②胸部CT提示病灶呈浸润性改变,③空洞数量增多,④空洞面积增大,⑤出现并发症、伴或不伴咯血、咳痰等症状加重及体质量减轻;除具备①外,同时具备任何1项者符合条件。(3)病情无变化。实验室检测、胸部CT检查及患者一般情况与开始治疗(观察组与术前对比)比较无变化或病情好转不明显。(4)死亡。
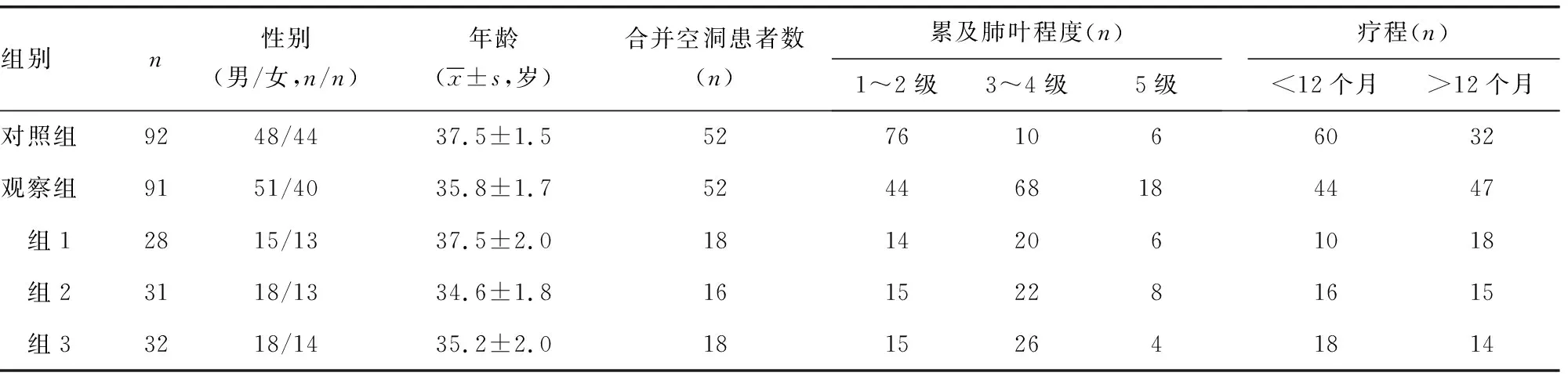
表1 各组患者基本情况比较
1.3统计学处理 采用SPSS17.0统计软件进行统计分析,计数资料以例数或百分率表示,组间比较采用χ2检验或Fisher确切概率法,等级资料采用成组设计两样本比较的秩和检验,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1疗效比较 术后随访两组的治疗转归比较,观察组治愈率高于对照组,病情恶化率、病情无变化率、死亡率均低于对照组,差异有统计学意义(P<0.05或P<0.01),见表2。观察组3个亚组的治愈率、病情恶化率、病情无变化率、死亡率比较,差异无统计学意义(P>0.05),见表3。
2.2不同停药时间痰菌转阴率比较 观察组内患者在术后进行化疗后第6、9、12、15、18及24个月痰菌阴转率高于对照组(P<0.01)。其中组1内的患者经过6个月疗程停药后,随着随访时间延长,其痰菌阴转率有所下降;组1在随访终止时有4例患者复发,复发率达14.3%。比较组2与组3各随访时间点的痰菌阴转率,差异无统计学意义(P>0.05);在术后化疗的随访观察中,组2及组3中均有1例患者复发,复发率分别为3.2%、3.1%,差异无统计学意义(P>0.05),见表4。
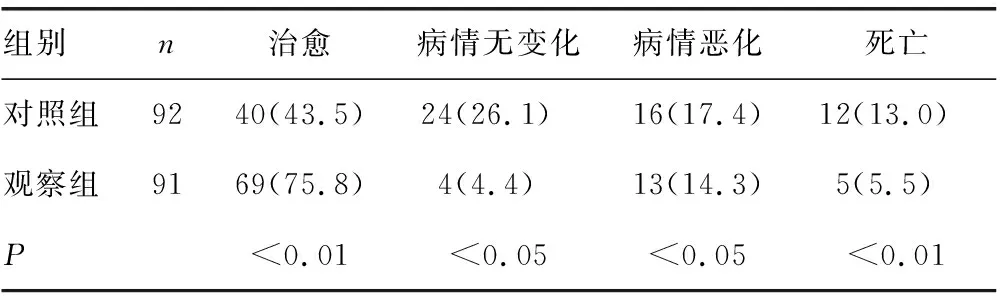
表2 观察组与对照组患者疗效比较[n(%)]
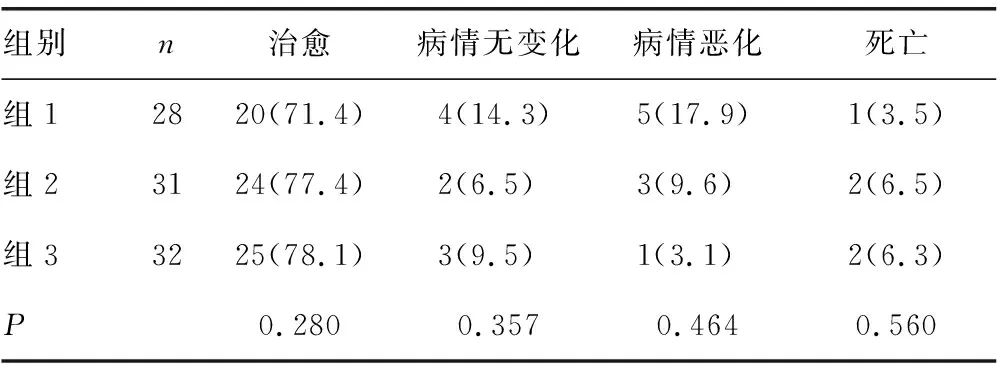
表3 观察组各亚组患者疗效比较[n(%)]
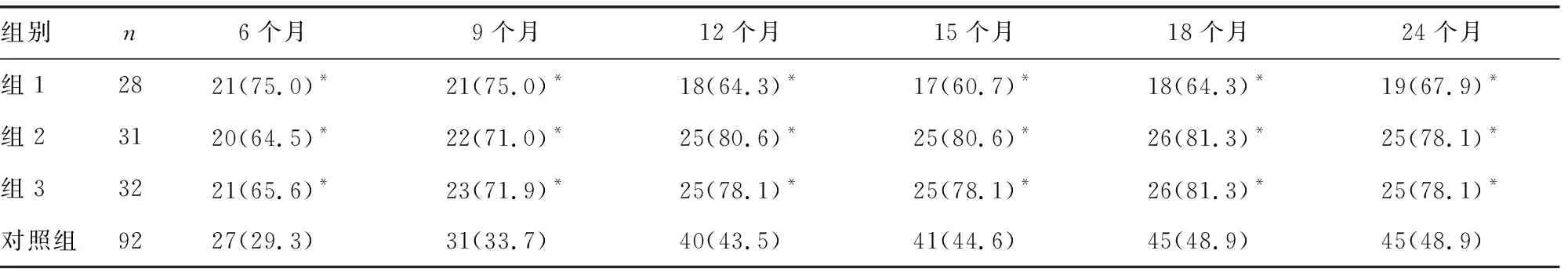
表4 观察组各亚组与对照组不同停药时间痰菌阴转率比较[n(%)]
注:**P<0.01,与对照组比较
3 讨 论
MDR-PTB目前已成为引起广泛关注的严重的公共卫生问题,其形成原因主要包括药物联用不合理、药物剂量不足、服药方法不当、治疗方案选择不合理、化疗疗程不足或间断用药、对失败和复发的病例处理不当及原发MDR或者XDR[9-13]。有研究表明,外科手术治疗为MDR/XDR-TB患者提供了新的辅助治疗,提高了患者治疗疗效[14]。本研究中,观察组患者采用外科手术联合化疗药物治疗,治愈率为75.8%,与韩国研究相似(72%),低于日本(89%)、美国(90%)的相关研究,高于北京(38.1%)、拉脱维亚(47%)及秘鲁(63%)[15-20]。本研究结果表明,手术治疗后联合敏感化疗药物治疗,可提高患者的痰菌阴转率,阻止病情进展,增加患者的生存率。MDR-TB患者手术联合术后12个月的化疗与进行长达18个月以上的单纯化疗相比,可明显缩短MDR-TB患者的治疗周期并提高痰菌阴转率,减轻患者的身体及经济负担。因此,针对MDR-TB的治疗因在遵循严格敏感化疗药物选择下,尽早采取手术治疗,术后继续采用敏感药物化疗。对于MDR-PTB患者选取合适的手术时间至关重要,有研究总结经有效化疗药物治疗3个月后,痰菌数可降至最低,且病灶也尽可能局限,此时为最佳手术时机[4]。外科手术切除病肺是耐药肺结核综合治疗的重要手段之一,是化疗治疗的辅助治疗,尤其对于空洞、毁损肺导致化疗药物难以到达的患者,单纯化疗效果差[14]。因此,在有效的抗结核治疗后,把握好手术时机,尽早外科手术干预,对减少细菌载量,消除耐药菌的寄生场所(毁损腔)有重要作用[3]。外科手术能切除耐药结核中对药物无反应的毁损肺,从而降低复发率和死亡率,使治愈率达到88.5%~95.6%[21-24]。可见外科手术对MDR-TB的治疗效果明确,可以明显增加治愈率、降低死亡率。本研究对照组部分患者发生病情恶化及死亡,可能与依从性差、年龄偏大、营养差、累积肺叶较多等因素有关。外科手术可降低耐药菌载量,对于缩短耐药治疗疗程具有重要作用。本研究表明,手术后联合化疗,可提升患者的痰菌转阴率,有助于减少患者的治疗周期,减轻患者经济上和心理上的负担,提高依从性,避免耐药菌的产生,对控制耐药结核患者病情和阻断耐药菌在人群中的传播有重要意义[25]。
对于MDR-PTB患者,仅依靠手术切除病肺并不可靠,需采用手术联合化疗的综合治疗手段才能达到理想的效果。MDR-PTB患者的最佳治疗方式是在外科手术行病肺切除的基础上联合敏感的抗结核药物治疗,并严密随访,加强对患者的督导管理,使患者保持良好的依从性。目前,使患者获益最大的化疗疗程在国内外均缺乏相关的前瞻性研究,术后普遍采用的化疗疗程为18~24个月,且报道病例普遍偏少。本研究显示,观察组3个亚组患者,术后化疗疗程6个月的患者治愈率及病情恶化率与化疗疗程12、18个月的患者比较无明显差异,但随着随访时间的延长复发率较高,不是最佳疗程。化疗疗程为12个月与18个月的患者治愈率、病情恶化率、痰菌阴转率及复发率比较,差异均无统计学意义(P>0.05),表明化疗疗程12个月与18个月相比,疗效无明显差异,却缩短了6个月的化疗疗程,故MDR-PTB患者外科手术后化疗疗程宜选12个月。此外,本研究观察组患者尽早进行手术联合有效化疗后,其死亡率(5.5%)低于对照组(13.0%)。
综上所述,外科手术是治疗MDR-PTB的一种切实有效的手段,化疗联合手术的综合治疗较单纯药物化疗效果更显著,在有效缩短MDR-PTB化疗疗程的同时提高了治愈率,术后为患者选择最佳化疗疗程将使患者获益最大,具有重要的临床意义。本研究尚有较多的不足,研究样本量较小,MDR-PTB患者病情复杂且选择的手术方式不同,因此需要更大样本量的多中心研究,进一步探索MDR-PTB的最佳手术时机及化疗疗程。
[1]World Health Organization.Global tuberculosis report 2015[R/OL].Geneva:World Health Organization,2015.(2015-10-28)[2018-02-21].http://apps.who.int/iris/bitstream/handle/10665/191102/9789241565059_eng.pdf.
[2]World Health Organization.Global tuberculosis control 2011[R/OL].Geneva:World Health Organization,2012.(2011-11-07) [2012-11-.http://www.who.int/tb/publications/global report/2011/gtbr11 full.pdf.
[3]HARRIS R C,KHAN M S,MARTIN L J,et al.The effect of surgery on the outcome of treatment for multidrug-resistant tuberculosis:a systematic review and meta-analysis[J].BMC Infect Dis,2016,16:262.
[4]赵攀,黄成瑜,肖和平,等.耐多药肺结核外科治疗的研究进展[J].中华医学杂志,2012,92(48):3448-3450.
[5]TÖRÜN T,TAHAOGLU K,OZMEN I,et al.The role of surgery and fluoroquinolones in the treatment of multidrug-resistant tuberculosis[J].Int J Tuberc Lung Dis,2007,11(9):979-985.
[6]ORMEROD L P.Role of surgery in pulmonary multidrug-resistant tuberculosis[J].Thorax,2007,62(5):377.
[7]肖和平.耐药结核病化学治疗的指南(2009)[J].中国防痨杂志,2010,33(4):485-497.
[8]叶嗣宽,赵攀,杨传利,等.耐多药肺结核早期外科治疗的临床效果分析[J].第三军医大学学报,2013,35(7):685-687.
[9]FALZON D,JARAMILLO E,SCHÜNEMANN H J,et al.WHO guidelines for the programmatic management of drug-resistant tuberculosis:2011 update[J].Eur Respir J,2011,38(3):516-528.
[10]CHIANG C Y,YEW W W.Multidrug-resistant and extensively drug-resistant tuberculosis[J].Int J Tuberc Lung Dis,2009,13(3):304-311.
[11]GANDHI N R,SHAH N S,ANDREWS J R,et al.HIV coinfection in multidrug- and extensively drug-resistant tuberculosis results in high early mortality[J].Am J Respir Crit Care Med,2010,181(1):80-86.
[12]WEYANT M J,MITCHELL J D.Multidrug-resistant pulmonary tuberculosis:surgical challenges[J].Thorac Surg Clin,2012,22(3):271-276.
[13]GANDHI N R,NUNN P,DHEDA K,et al.Multidrug-resistant and extensively drug-resistant tuberculosis:a threat to global control of tuberculosis[J].Lancet,2010,375(9728):1830-1843.
[14]XU H B,JIANG R H,LI L.Pulmonary resection for patients with multidrug-resistant tuberculosis:systematic review and meta-analysis[J].J Antimicrob Chemother,2011,66(8):1687-1695.
[15]DRAVNIECE G,CAIN K P,HOLTZ T H,et al.Adjunctive resectional lung surgery for extensively drug-resistant tuberculosis[J].Eur Respir J,2009,34(1):180-183.
[16]SOMOCURCIO J G,SOTOMAYOR A,SHIN S,et al.Surgery for patients with drug-resistant tuberculosis:report of 121 cases receiving community-based treatment in Lima,Peru[J].Thorax,2007,62(5):416-421.
[17]KIM H J,KANG C H,KIM Y T,et al.Prognostic factors for surgical resection in patients with multidrug-resistant tuberculosis[J].Eur Respir J,2006,28(3):576-580.
[18]TAKEDA S,MAEDA H,HAYAKAWA M,et al.Current surgical intervention for pulmonary tuberculosis[J].Ann Thorac Surg,2005,79(3):959-963.
[19]POMERANTZ B J,CLEVELAND J C Jr,OLSON H K,et al.Pulmonary resection for multi-drug resistant tuberculosis[J].J Thorac Cardiovasc Surg,2001,121:448-453.
[20]MA Y,PANG Y,DU J,et al.Clinical outcomes for multi- and extensively drug resistant tuberculosis patients with adjunctive resectional lung surgery in Beijing,China[J].J Thorac Dis,9(3):841-845.
[21]TAKEDA S,MAEDA H,HAYAKAWA M,et al.Current surgical intervention for pulmonary tuberculosis[J].Ann Thorac Surg,2005,79(3):959-963.
[22]PARK S K,LEE C M,HEU J P,et al.
A retrospective study for the outcome of pulmonary resection in 49 patients with multidrug-resistant tuberculosis[J].Int J Tuberc Lung Dis,2002,6(2):143-149.
[23]SHIRAISHI Y,NAKAJIMA Y,KATSURAGI N,et al.Resectional surgery combined with chemotherapy remains the treatment of choice for multidrug-resistant tuberculosis[J].J Thorac Cardiovasc Surg,2004,128(4):523-528.
[24]NAIDOO R,REDDI A.Lung resection for multidrug resistant tuberculosis[J].Asian Cardiovasc Thorac Ann,2005,13(2):172-174.
[25]WANG H,LIN H,JIANG G.Pulmonary resection in the treatment of multidrug-resistant tuberculosis:a retrospective study of 56 cases[J].Ann Thorac Surg,2008,86(5):1640-1645.
