化疗期间超声弹性成像指标对预测乳腺癌新辅助化疗疗效的评估模型及其效能
2018-07-05陈磊
陈磊
河北省唐山市开滦总医院超声医学科(河北唐山 063000)
新辅助化疗是乳腺癌治疗的重要组成部分,但20%患者难以从中获益[1]。早期评价新辅助化疗疗效,有助于及时发现对化疗无反应的肿瘤,并调整治疗方案,降低医疗资源的浪费并避免化疗毒副反应[2]。超声弹性成像能够定量反映组织弹性,目前已在乳腺癌的鉴别诊断方面发挥出重要作用[3],且有报道[4]指出化疗前后超声弹性成像指标的变化有助于明确疗效,但化疗完成后检测相关指标已欠缺预测性。本研究拟将该技术引入至乳腺癌新辅助化疗疗效的早期预测,构建能够定量分析患者疗效的评估模型,报告如下。
1 资料与方法
1.1 一般资料 以2014年6月至2017年6月于我院接受新辅助化疗后,行手术治疗的102例乳腺癌患者为对象,开展回顾性分析。患者均为女性,年龄(48.51±10.33)岁,临床分期ⅡB、ⅢA、ⅢB、ⅢC期分别48、28、16、10例;乳腺癌分型Luminal A型38例、Luminal B型32例、Erb-B2过表达型18例、基底样乳腺癌14例。
1.2 纳入标准 单发病灶;化疗前病理学确诊乳腺癌,临床分期ⅡB~ⅢC期;自主接受新辅助化疗后手术治疗;既往未接受放化疗;无化疗禁忌证。
1.3 排除标准 治疗依从性差,未能完成化疗方案者;中途调整化疗方案者。
1.4 治疗方案 所有患者根据病理和免疫组化放方案选择新辅助化疗方案,HER-2阴性患者采用以蒽环类联合紫衫类化疗;HER-2阳性患者在上诉基础上加用曲妥珠单抗。21 d为1个周期,88例接受4个化疗周期,14例接受6个化疗周期。化疗结束后14 d接受手术治疗。
1.5 超声诊断方案 分别于化疗前、化疗第2个周期结束、化疗全程结束后进行超声弹性成像检查。仪器为荷兰产Philips(飞利浦)iU22彩超。首先进行常规超声检查,记录肿瘤最大直径(diameter,D)、动脉收缩期血流峰值速度(peak systole velocity,PSV)、动脉血流阻力指数(resistance index,RI),PSV、RI均统计多条动脉的最大值。随后进入超声弹性成像检查模式,将取样框置于病灶内部及紧贴肿瘤边缘处,测量横向剪切波速度(shear wave velocity,SWV),再将取样框置于病灶镜像位置对侧腺体同等深度处,测量SWV,计算病变侧与对侧SWV比值(lesion side SWV to contralateral side SWV ratio,SWVr)。
1.6 疗效评价及分组方案 根据化疗疗效将患者划分为有效组及无效组,疗效评价方法:参考Miller&Payne分级[5],将患者划分为1~5级,1~2级为化疗无效,3~5级为化疗有效。同时统计患者病理完全缓解率及腋窝淋巴结的转移情况变化,病理完全缓解指乳腺癌原发灶无浸润性癌且区域淋巴结阴性。
1.7 统计学方法 采用SPSS 19.0处理数据,计量资料以±s表示,对比采用重复测量的方差分析、配对样本及独立样本t检验,计数资料计算构成比,采用卡方检验,疗效的影响因素采用Logistic回归分析确定,利用回归分析结果构建疗效的预测及评估模型,通过ROC曲线测评其适用价值。
2 结果
2.1 患者化疗效果 本研究无患者脱落。102个病灶中,82个有效,其中3级44个、4级26个、5级12个,有效率为80.39%;20个无效,其中1级6个、2级14个,无效率为19.61%。两组基线资料对比见表1,化疗前,2组乳腺癌分型、常规超声检测指标D差异有统计学意义(P<0.05)。102个病灶中,病理完全缓解12个,占总例数的11.76%;41例伴区域淋巴结转移患者,32例转阴,占伴区域淋巴结转移患者的78.05%。
表1 无效组与有效组基线资料对比Tab.1 Comparison of baseline data between ineffective group and effective group ±s

表1 无效组与有效组基线资料对比Tab.1 Comparison of baseline data between ineffective group and effective group ±s
指标年龄(岁)临床分期Ⅱ期Ⅲ期乳腺癌分型Luminal型Erb-B2基底样乳腺癌化疗时间4个周期6个周期D(mm)PSV(cm/s)RI SWVr有效组(n=82)48.87±11.85无效组(n=20)47.05±12.24 t/χ2值0.612 1.672 P值0.542 0.196 36(43.90)46(56.10)12(60.00)8(40.00)6.2980.043 52(63.41)18(21.95)12(14.63)18(90.00)0(0.00)2(10.00)0.8680.352 72(87.80)10(12.20)25.71±10.68 14.93±4.74 0.78±0.15 8.38±0.57 16(80.00)4(20.00)31.85±8.72 16.38±4.13 0.72±0.18 8.51±0.40 2.382 1.256 1.541 0.962 0.019 0.212 0.127 0.338
2.2 化疗前D预测疗效的效能 化疗前D对治疗有效的预测ROC曲线下面积为0.654(标准误=0.057,P=0.033,95%CI:0.542~0.766)。
2.3 化疗期间超声定量参数变化情况 总体对比:化疗前后D、PSV、RI、SWVr变化的时间效应、分组效应、交互效应差异均有统计学意义(P<0.05)。固定时点对比:有效组在化疗2个周期、化疗结束时D、PSV、RI、SWVr均明显低于无效组,差异有统计学意义(P<0.05)。同时,化疗有效组化疗结束时和化疗2个周期时D、PSV、RI、SWVr对比,差异均无统计学意义(P>0.05)。见表2。
表2 化疗期间超声定量参数变化情况Tab.2 Changes of ultrasonic quantitative parameters during chemotherapy ±s

表2 化疗期间超声定量参数变化情况Tab.2 Changes of ultrasonic quantitative parameters during chemotherapy ±s
注:与化疗前对比,*P<0.05;与无效组对比,#P<0.05
组别有效组(n=82)化疗前化疗2个周期化疗结束无效组(n=20)化疗前化疗2个周期化疗结束D(mm)PSV(cm/s)RI SWVr 25.71±10.68 23.22±6.24*#20.73±6.29*#14.93±4.74 11.75±3.53*#9.28±3.71*#0.78±0.15 0.65±0.08*#0.62±0.07*#8.38±0.57 5.33±2.68*#2.37±1.15*#31.85±8.72 32.04±11.38 31.92±10.93 16.38±4.13 18.22±4.05*18.35±3.16*0.72±0.18 0.73±0.14 0.73±0.09 8.51±0.40 8.38±0.58 8.41±0.42
2.4 化疗2个周期超声定量参数对患者疗效的预测截断值 利用ROC曲线获取化疗2周期时超声定量参数对疗效的最佳预测截断值,见图1及表3。
2.5 患者疗效影响因素的多因素回归分析 纳入化疗2周时D、PSV、RI、SWVr为自变量,按≥最佳截断值为1,<最佳截断值为0赋值,纳入患者疗效为因变量,按有效为1,无效为0赋值,经Logistic回归分析显示PSV、SWVr为患者预后的独立预测因素(P<0.05)。见表4。
2.6 患者疗效预测模型的建立及分析 疗效预测模型:当PSV<14.44 cm/s且SWVr<0.730时得分为0,当仅PSV≥14.44 cm/s或仅SWVr≥0.730时得分为1,当PSV≥14.44 cm/s且SWVr≥0.730时得分为2。不同得分患者疗效对比见表5。经ROC曲线分析,该模型对患者疗效有良好的预测效能,ROC曲线下面积为0.913(标准误=0.048,P<0.001,95%CI:0.820~1.000)。

图1 化疗2个周期时D、PSV、RI、SWVr对患者疗效的预测ROC曲线Fig.1 Predictive ROC curve of D,PSV,RI and SWVr at 2nd chemotherapy cycle for clinical efficacy
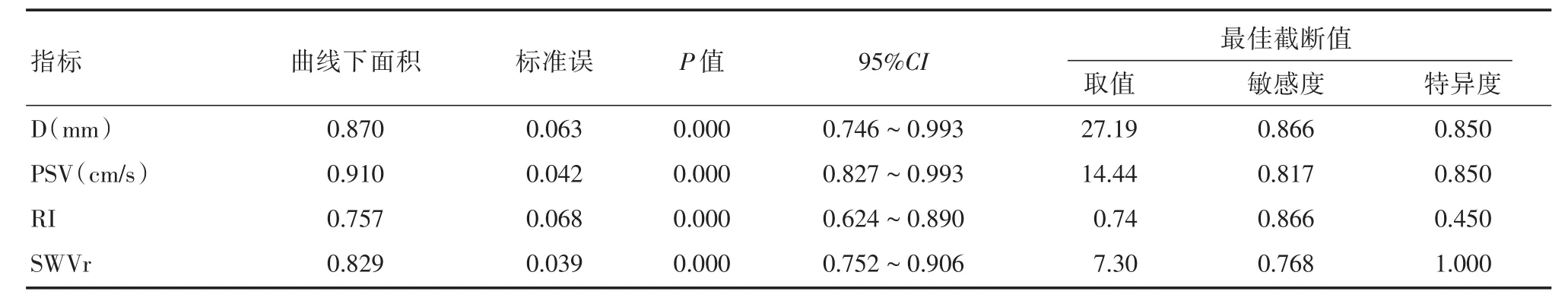
表3 化疗2个周期时D、PSV、RI、SWVr对患者疗效的预测ROC曲线分析Tab.3 Analysis of predictive ROC curve of D,PSV,RI and SWVr at 2nd chemotherapy cycle for clinical efficacy

表4 化疗2个周期时超声定量参数对患者疗效影响的Logistic回归分析Tab.4 Logistic regression analysis of the effect of ultrasonic quantitative parameters on patients′efficacy during 2 cycles of chemotherapy

表5 不同疗效预测模型得分患者疗效对比Tab.5 Comparison of curative effect of patients with different scores of curative effect prediction model 例(%)
3 讨论
乳腺癌病灶在新辅助化疗后变化情况对临床制定下一步治疗方案至关重要,但评价疗效最可靠的方案仍是病理诊断结果[6],需要在术后获得,此时已无法指导调整治疗方案。常规超声能够有效评价病灶的面积、内部血流情况,超声弹性成像则能够有效反映局部组织的组织硬度,上述技术均已广泛应用至乳腺癌的诊断[7-8],本研究发现化疗前后,无效组常规超声及超声弹性成像检测指标均未见明显变化或出现一定恶化,而有效组各检测指标均明显改善,与既往报道[9]一致,提示化疗前后超声弹性成像指标能有效反映患者化疗疗效。有效组D明显下降,说明肿瘤体积明显降低;PSV、RI下降说明肿瘤供血不足,表明肿瘤出现明显的变性坏死;弹性较软组织的剪切波传播速度较弹性较硬组织慢[10],这是有效组SWVr明显下降的声学基础。
然而以治疗前后超声定量参数的差异分析疗效,对指导早期调整治疗方案意义有限。本研究提示,化疗前超声定量参数难以预测疗效:有效组与无效组D差异明显,而D对疗效的预测ROC曲线下面积仅为0.654。张彦等[11]报道提示有效组与无效组在化疗前各检测参数并无明显差异,与本研究结论相似。但有效组在化疗第2周期时各超声定量参数即已发生明显变化,与JING等[12]报道结果相符,提示利用第2周期检测参数可能有助于预测化疗疗效。
既往研究超声对乳腺癌新辅助化疗疗效评估作用的报道均基于单因素分析[13-15],其结论难以指导定量预测患者预后。本研究通过Logistic回归分析,明确PSV与SWVr对患者疗效有直接预测作用,张紫杰等[16]报道则指出化疗第2周时PSV、RI及弹性应变率均与疗效有关,差异可能仅与样本量有关,但均证实化疗第2周常规超声联合超声弹性成像检测结果能够预测患者预后。本研究PSV与SWVr构建患者预后的预测模型:当PSV<14.44 cm/s且SWVr<0.730时得分为0,当仅PSV≥14.44 cm/s或仅SWVr≥0.730时得分为1,当PSV≥14.44 cm/s且SWVr≥0.730时得分为2,经单因素分析,显示得分为2分时患者治疗失败率明显高于其他得分,ROC曲线显示该模型对患者的疗效有良好预测价值,曲线下面积为0.913。
综上,检测化疗2周期时PSV、SWVr能够有效预测乳腺癌新辅助化疗患者疗效,当PSV≥14.44 cm/s且SWVr≥0.730时,患者化疗无效风险较高。
[1]REDDEN M H,FUHRMAN G M.Neoadjuvant chemotherapy in the treatment of breast cancer[J].Surg Clin North Am,2013,93(2):493-499.
[2]LEE M C,GONZALEZ S J,LIN H,et al.Prospective trial of breast MRI versus 2D and 3D ultrasound for evaluation of response to neoadjuvant chemotherapy [J].Ann Surg Oncol,2015,22(9):2888-2894.
[3]DENIS M,BAYAT M,MEHRMOHAMMADI M,et al.Update on breast cancer detection using comb-push ultrasound shear elastography[J].IEEE Trans Ultrason Ferroelectr Freq Control,2015,62(9):1644-1650.
[4]FALOU O,SADEGHI-NAINI A,PREMATILAKE S,et al.Evaluation of neoadjuvant chemotherapy response in women with locally advanced breast cancer using ultrasound elastography[J].Transl Oncol,2013,6(1):17-24.
[5]OGSTON K N,MILLER I D,PAYNE S,et al.A new histological grading system to assess response of breast cancers to primary chemotherapy:prognostic significance and survival[J].Breast,2003,12(5):320-327.
[6]FATAYER H,SHARMA N,MANUEL D,et al.Serial MRI scans help in assessing early response to neoadjuvant chemotherapy and tailoring breast cancer treatment[J].Eur J Surg Oncol,2016,42(7):965-972.
[7]MARISCOTTI G,HOUSSAMI N,DURANDO M,et al.Accuracy of mammography,digital breast tomosynthesis,ultrasound and MR imaging in preoperative assessment of breast cancer[J].Anticancer Res,2014,34(3):1219-1225.
[8]BARR R G,ZHANG Z.Shear-wave elastography of the breast:value of a quality measure and comparison with strain elastography[J].Radiology,2015,275(1):45-53.
[9]MA Y,ZHANG S,LI J,et al.Comparison of strain and shearwave ultrasounic elastography in predicting the pathological response to neoadjuvant chemotherapy in breast cancers[J].Eur Radiol,2017,27(6):2282-2291.
[10]TAMAKI K,TAMAKI N,KAMADA Y,et al.Non-invasive evaluation of axillary lymph node status in breast cancer patients using shear wave elastography[J].Tohoku J Exp Med,2013,231(3):211-216.
[11]张彦,陈翠京,史秀云,等.超声检查早期评价乳腺癌新辅助化疗疗效的临床研究[J].临床肿瘤学杂志,2015,20(10):926-929.
[12]JING H,CHENG W,LI Z Y,et al.Early evaluation of relative changes in tumor stiffness by shear wave elastography predicts the response to neoadjuvant chemotherapy in patients with breast cancer[J].J Ultrasound Med,2016,35(8):1619-1627.
[13]胡正明,孙德胜,钟洁愉,等.彩色多普勒超声评估乳腺癌新辅助化疗疗效[J].中国临床医学影像杂志,2013,24(8):548-550.
[14]EVANS A,ARMSTRONG S,WHELEHAN P,et al.Can shear-wave elastography predict response to neoadjuvant chemotherapy in women with invasive breast cancer?[J].Br J Cancer,2013,109(11):2798-2802.
[15]李妙珊,冯占武,刘娟娟,等.超声评价三阴性乳腺癌新辅助化疗疗效的价值[J].中国超声医学杂志,2015,31(12):1067-1070.
[16]张紫杰,郭凤娟,张彦,等.超声评估乳腺癌新辅助化疗早期疗效的多因素分析[J].中国现代医学杂志,2016,26(7):40-43.
