急性髓系白血病患者miR-372的表达水平及其临床意义
2018-07-05赵强强冯建明李文倩沈括陈绍斌解友邦赵长明侯艳
赵强强 冯建明 李文倩 沈括 陈绍斌 解友邦 赵长明 侯艳
1青海省人民医院血液科(西宁810007);2青海大学(西宁810016)
急性髓系白血病(AML)是一种以造血干细胞快速增殖为特征的造血干细胞恶性疾病。AML的主要特征是未成熟细胞异常积累以及正常造血细胞受到抑制[1-2]。急性髓系白血病的预后多变,从几周生存期到完全缓解期和治愈期[3]。在成人AML患者中,5年无病生存率与年龄密切相关,其中65岁以上的患者生存率最低[4]。根据世界卫生组织对AML的分类,细胞遗传学和分子生物学分析对于预测AML患者的缓解和生存率非常重要[5]。然而,由于AML发展的分子机制不同,AML患者的预后仍然难以准确估计。因此,鉴定新的生物标志物将有助于更好地治疗AML,并更好地预测这些患者的化疗反应。MicroRNAs(miRNAs)是一类非编码小RNA分子,长度为18~25个核苷酸。miRNA可以通过与靶基因的3′非翻译区结合导致靶mRNA的降解或抑制[6]。miRNAs参与多种生理和生物学功能,如增殖、分化、器官发生、胚胎发生和凋亡[7]。此外,各种疾病都表现出miRNAs的异常表达和失调,例如肺癌、肾癌和肝脏疾病[8]。在癌基因的异常激活和抑癌基因沉默的过程中,miRNAs的失调在肿瘤发生中起着重要的作用。因此,一些研究表明特异性靶向miRNAs可以成为肿瘤治疗的潜在靶点[10]。而且,血浆和血清中miRNAs的表达谱被证实可以作为非侵入性的生物标记物来区分特定类型的癌症[9]。最近的研究表明了AML患者不同组织,包括血浆中,各种miRNAs的表达谱发生异常。因此,血浆microRNA是诊断AML和评价AML患者预后的新的生物标记物[9-10]。在不同的肿瘤中,miR-372的异常表达被广泛报道[11-12]。但是miR-372是否在急性髓系白血病患者中发生改变尚未有相关研究。本次研究主要探讨miR-372在急性白血病患者的血浆中的表达情况及其参与AML发展的可能作用机制。
1 对象与方法
1.1 研究对象 选取2015年6月至2016年5月在青海省人民医院诊治的60例急性髓系白血病(AML)患者,以及20例正常对照组的血浆样本,诊断和分型依据法-美-英(FAB)分组和2008年WHO分组[13]。所有AML患者均为初治患者,无其他恶性肿瘤病史,未接受过抗肿瘤药物治疗。纳入标准:诊断AML的外周血或骨髓原始细胞≥ 20%;伴有特殊染色体类型 AML 如 t(8;21)(q22;q22)、inv(16)(p13;q22)和 t(16;16)(p13;q22)时,即使原始细胞数<20%,也应诊断为AML。排除标准:伴t(15;17)(q22;q12)的急性早幼粒细胞白血病;MDS或MPD转化而来的AML;治疗相关AML。60例AML患者均经过骨髓形态学、白血病免疫分型、细胞遗传学及分子生物学等检查确诊,分型:M0 2例、M1 20例、M2 23例、M4 9例、M5 5例、M7 1例。20例正常对照组来自健康志愿者,其标本采集均获得知情同意及医院伦理委员会批准。AML患者及正常对照组临床资料见表1。

表1 AML患者及正常对照临床资料Tab.1 Clinical data of AML patients and normal controls
1.2 血浆miRNA检测 500 μL血浆中的总RNA通过miRNeasy提取试剂盒(Cat No.217184,Qiagen,CA,USA)进行分离,然后用50 μL的DEPC水进行溶解。提取的RNA用Nano-Drop ND-1000吸光光度计(Thermo Fisher scientific,Waltham,USA)进行纯度检测。
之后,RNA进一步用miScriptⅡ反转录试剂盒(Cat No.218161,Qiagen,CA,USA)进行反转录。实时定量PCR被用来进一步确定血浆中miR-372的相对含量。具体反应体系及程序如下:cDNA模板(2 μL),SYBER Green Master Mix(5 μL,Cat No.218073,Qiagen,CA,USA),前向引物(1 μL),反向引物(1 μL),ddH2O(1 μL);95 ℃ 15 min,94 ℃15 s,55 ℃ 30 s,70 ℃ 34 s(40 ×)。U6做为内源性对照,使用 2-ΔΔ(Ct)方法检测 miR-372 的相对含量。
1.3 293 T细胞培养 HL-60细胞及293T细胞(购自中国医学科学院基础医学研究所细胞中心)用含10%胎牛血清的L-DMEM培养基、于37℃、含5%CO2的培养箱中孵育。每2天更换培养液1次,细胞达70%~80%丰度时,传代或用于实验。
1.4 靶基因预测 使用生物信息学软件Target Scan(http://www.targetscan.org/vert_71/)预测 miR-372的靶基因。
1.5 293 T细胞中pmirGLO-PTEN重组质粒的转染 将包含结合位点的PTEN的3′UTR区域克隆到双荧光素酶报告基因质粒pmirGLO中。将293T细胞种于6孔板中,待细胞80%融合后,按说明书分别稀释pmirGLO-PTEN以及empty-pmirGLO,按HiPerFect(QIAGEN)转染试剂试剂盒说明书进行转染。
1.6 双荧光素酶报告系统检测 将培养基倒掉,并用1×PBS冲洗细胞3次,弃掉PBS,在6孔板的毎孔中加入1×被动细胞裂解液(PLB),在室温中震荡15 min,并将裂解液转入1个EP管中。取100 μL荧光素酶分析底物(LARⅡ)加入反应管中,然后加入20 μL细胞裂解液,待荧光分光光度计读数结束后,再加入100 μL Stop&Glo Buffer。计算相对荧光强度,并与空载对照比较。
1.7 划痕实验 将HL-60细胞以106cells/well接种于6孔板,24 h后,用枪头在孔中均匀划出2条距离相同的横线,并刮掉中间的所有细胞。用PBS清洗3次,加入新鲜培养基。之后,将miR-372 inhibitor或者对照NC转染进入HL-60细胞,48 h后,观察细胞迁移情况。转染方法按HiPerFect(QIAGEN)转染试剂试剂盒说明书进行转染。
1.8 克隆形成能力检测 取对数生长期的HL-60细胞,用0.25%的胰蛋白酶吹打成单细胞,以50细胞/孔的密度接种于6孔板。在孵箱中轻轻转动使细胞分散,2周后,当培养皿中出现肉眼可见的克隆时,弃去上清,PBS洗2次。之后将细胞用4%多聚甲醛固定15 min。然后用1 mL GIMSA染色液染20 min,然后用流水缓慢洗去染色液,空气干燥。肉眼直接计数,克隆形成率=(克隆数/接种细胞数)×100%。
1.9 统计学方法 应用SPSS 13.0统计软件进行数据处理。计量资料以±s表示。连续性计量资料采用单因素方差分析进行多组比较,非连续性计量资料采用秩和检验进行多组间比较。ROC曲线分析miR-372是否可以区分AML患者与健康对照。95%可信区间,P<0.05为差异有统计学意义。
2 结果
2.1 miR-372在急性髓系白血病患者外周血中水平明显升高 本研究对健康对照组和急性髓系白血病患者外周血中的miR-372水平进行了Real time PCR检测。与健康对照组相比,急性髓系白血病患者外周血中miR-372水平显著升高。

图1 急性髓系白血病患者外周血中miR-372水平明显升高Fig.1 MiR-372 levels in peripheral blood of patients with acute myeloid leukemia are significantly elevated
2.2 ROC曲线分析 受试者工作特征曲线(ROC曲线)分析表明miR-372可以区分急性髓系白血病患者与健康对照组,曲线下面积为0.912(95%置信区间:0.819~1.000;P<0.000 1)。
2.3 PTEN是miR-372的靶基因 TargetScan(http://www.targetscan.org/vert_71/)生物信息学软件预测结果发现在PTEN的3′非翻译区有6个保守的结合位点(图3A)。双荧光素酶报告基因表明,过表达miR-372可以显著抑制pmirGLO-PTEN-3′UTR-1,pmirGLO-PTEN-3′UTR-2,pmirGLO-PTEN-3′UTR-3(包含结合位点3和4),pmirGLO-PTEN-3′UTR-4(包含结合位点5和6)(图3B)。蛋白质免疫印迹检测表明,过表达miR-372可以抑制PTEN的表达,而抑制miR-372可以促进PTEN的表达(图3C和3D)。
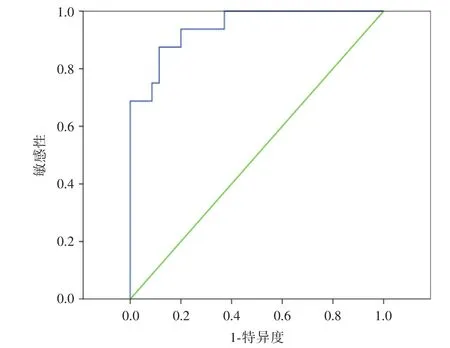
图2 ROC曲线分析表明miR-372可以区分急性髓系白血病患者与健康对照Fig.2 ROC curve analysis shows that miR-372 can distinguish patients with acute myeloid leukemia from healthy controls
2.4 敲低miR-372抑制HL-60细胞迁移 本研究在HL-60细胞中转染了miR-372 inhibitor。结果表明,在HL-60细胞中敲低miR-372可以显著降低HL-60的细胞迁移率(图4)。
2.5 敲低miR-372抑制HL-60细胞克隆形成能力 本研究还证实在HL-60细胞中敲低miR-372可以显著抑制HL-60细胞的克隆形成能力(图5)。
3 讨论
在早期急性髓系白血病患者中,早期诊断和及时治疗可以有效提高患者的生存率[14-15]。因此,积极寻找诊断和治疗急性髓系白血病的新的生物学标志物对于有效诊断和治疗具有十分重要的意义[16]。在不同的肿瘤和组织,miRNA表达谱的改变被广泛发现。活检样本中,进一步分析miRNA的表达,发现这些miRNA表达的异常改变与肿瘤的浸润和转移密切相关[17]。在循环系统中,如血浆、血清、尿液中,miRNA可以稳定存在[17]。因此,越来越多的研究致力于探讨miRNA是否可以成为肿瘤发生发展的非侵入性生物学标志物。
本研究重点探讨了外周血中的miR-372是否与急性髓系白血病的发展密切相关。与健康对照组相比,急性髓系白血病患者血浆中miR-372的水平明显增加。ROC曲线分析表明miR-372可以区分急性髓系白血病患者与健康对照。这些结果初步表明,血浆miR-372在急性髓系白血病的发展中以致癌基因的形式发挥作用。

图3 PTEN是miR-372的靶基因Fig.3 PTEN is the target gene for miR-372

图4 在HL-60细胞中敲低miR-372可以显著降低HL-60的细胞迁移率Fig.4 Knockdown of miR-372 in HL-60 cells can significantly reduce the cell migration of HL-60
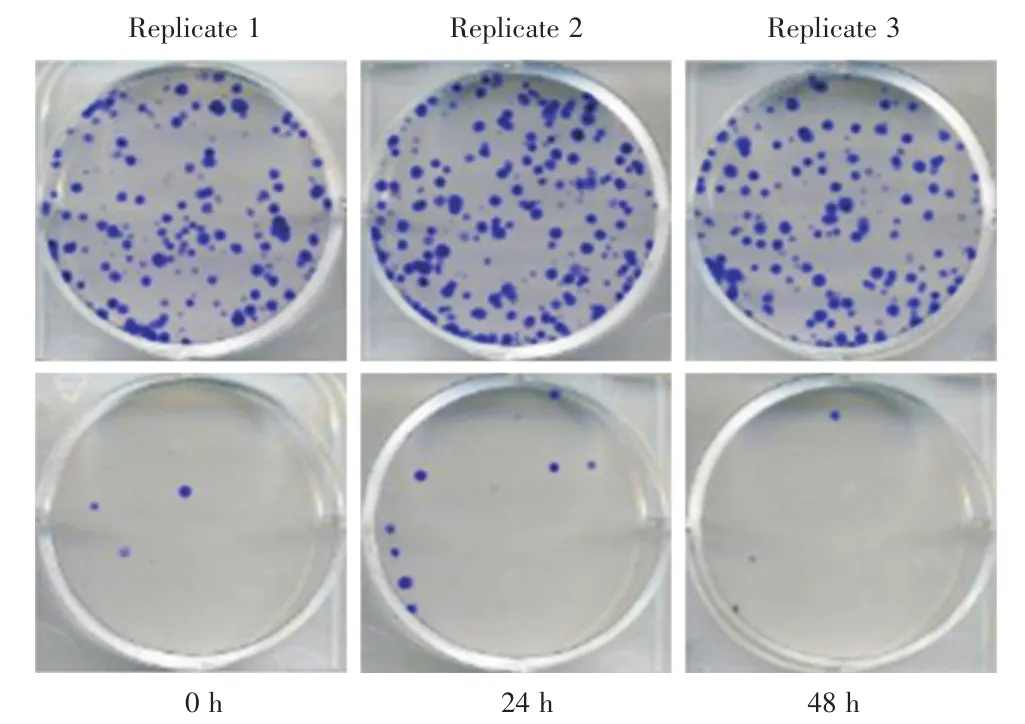
图5 在HL-60细胞中敲低miR-372可以显著抑制HL-60细胞的克隆形成能力。Fig.5 Knockdown of miR-372 in HL-60 cells significantly inhibited the colony forming ability of HL-60 cells
在不同的肿瘤中,miR-372的异常表达被广泛报道[11-12]。例如,miR-372表达上调与口腔癌的淋巴结转移正相关[11]。而在肝癌肿瘤转移中,miR-372的水平显著降低[12]。考虑到miR-372可能的致癌作用,笔者进一步分析了其相关靶基因。Tar-getScan预测分析的结果表明,PTEN的3′非翻译区存在4个可能的保守结合位点。众所周知,PTEN是一个十分重要的抑癌基因。因此,我们将这几个不同位点的3′UTR区克隆到双荧光素酶报告基因载体pmirGLO中。双荧光素酶报告基因及Western blot的结果均表明,PTEN是miR-372的靶基因。因此,我们推测,急性髓系白血病患者血浆中miR-372的升高,可以通过抑制PTEN的表达,进而导致肿瘤的恶性侵袭和转移。
基于以上推测,笔者进一步在急性髓系白血病细胞HL-60中敲低了miR-372的表达,从而观察其对HL-60细胞迁移和克隆形成能力的影响。本研究结果表明,在HL-60细胞中抑制miR-372可以有效抑制细胞的迁移和克隆形成能力。提示miR-372可能成为急性髓系白血病治疗的一个新的潜在靶点。
但是,本研究仍然存在一些缺陷。首先,本研究中所采用的样本数目相对较少。其次,在恶性程度不同的急性髓系白血病患者血浆中,miR-372的水平如何变化仍然需要进一步的探讨。
综上,本研究首次发现,在急性髓系白血病患者血浆中,miR-372水平显著升高。通过靶向抑癌基因PTEN,miR-372可能成为一个潜在的筛查和诊断急性髓系白血病的非侵入性生物学标志物。
[1]KROWIORZ K,RUSCHMANN J,LAI C,et al.MiR-139-5p is a potent tumor suppressor in adult acute myeloid leukemia[J].Blood Cancer J,2016,6(12):e508.
[2]XIAO Y,SU C,DENG T.MiR-223 decreases cell proliferation and enhances cell apoptosis in acute myeloid leukemia via targeting FBXW7[J].Oncol Lett,2016;12(5):3531-3536.
[3]FAVREAU A J,MCGLAUFLIN R E,DUARTE C W,et al.MiR-199b,a novel tumor suppressor miRNA in acute myeloid leukemia with prognostic implications[J].Exp Hematol Oncol,2016,5(1):4.
[4]HUA J Y,FENG Y,PANG Y,et al.MiR-181a promotes proliferation of human acute myeloid leukemia cells by targeting ATM[J].Zhongguo Shi Yan Xue Ye Xue Za Zhi,2016,24(2):347-351.
[5]HUANG X,SCHWIND S,SANTHANAM R,et al.Targeting the RAS/MAPK pathway with miR-181a in acute myeloid leukemia[J].Oncotarget,2016,7(37):59273-59286.
[6]JIANG X,BUGNO J,HU C,et al.Eradication of acute myeloid leukemia with FLT3 ligand-targeted miR-150 nanoparticles[J].Cancer Res,2016,76(15):4470-4480.
[7]LIU X,LIAO W,PENG H,et al.MiR-181a promotes G1/S transition and cell proliferation in pediatric acute myeloid leukemia by targeting ATM[J].J Cancer Res Clin Oncol,2016,142(1):77-87.
[8]MAHARRY S E,WALKER C J,LIYANARACHCHI S,et al.Dissection of the major hematopoietic quantitative trait locus in chromosome 6q23.3 identifies miR-3662 as a novel player in hematopoiesis and acute myeloid leukemia[J].Cancer Discov,2016,6(9):1036-1051.
[9]ZHI Y,XIE X,WANG R,et al.Serum level of miR-10-5p as a prognostic biomarker for acute myeloid leukemia[J].Int J Hematol,2015,102(3):296-303.
[10]SUN X,LIU D,XUE Y,et al.Enforced miR-144-3p expression as a non-invasive biomarker for the acute myeloid leukemia patients mainly by targeting NRF2[J].Clin Lab ,2017,63(4):679-687.
[11]TU H F,CHANG K W,CHENG H W,et al.Upregulation of miR-372 and-373 associates with lymph node metastasis and poor prognosis of oral carcinomas[J].Laryngoscope,2015,125(11):E365-370.
[12]WU G,WANG Y,LU X,et al.Low mir-372 expression correlates with poor prognosis and tumor metastasis in hepatocellular carcinoma[J].Bmc Cancer,2015,15(1):1-12.
[13]BENNETT J,ORAZI A.Diagnostic criteria to distinguish hypocellular acute myeloid leukemia from hypocellular myelodysplastic syndromes and aplastic anemia:recommendations for a standardized approach[J].Haematologica ,2009,94(2):264-268.
[14]SHI J,LIN F,LI Y,et al.Identification of let-7a-2-3p or/and miR-188-5p as prognostic biomarkers in cytogenetically normal acute myeloid leukemia[J].PloS One,2015,10(2):e0118099.
[15]SU R,LIN H S,ZHANG X H,et al.MiR-181 family:regulators of myeloid differentiation and acute myeloid leukemia as well as potential therapeutic targets[J].Oncogene,2015,34(25):3226-3239.
[16]NANBAKHSH A,VISENTIN G,OLIVE D,et al.MiR-181a modulates acute myeloid leukemia susceptibility to natural killer cells[J].Oncoimmunology,2015,4(12):e996475.
[17]ELHAMAMSY A R,SHARKAWY M S E,ZANATY A F,et al.Circulating miR-92a,miR-143 and miR-342 in plasma are novel potential biomarkers for acute myeloid leukemia[J].Int J Mol Cell Med,2017,6(2):77-86.
