颗粒细胞端粒长度预测胚胎发育潜能及妊娠率的临床研究
2018-07-05李楠唐妮韦立红李忻琳林忠
李楠 唐妮 韦立红 李忻琳 林忠
柳州市妇幼保健院生殖医学中心(广西柳州545001)
人类辅助生育技术(assisted reproductive technology,ART)已经历了30多年的发展,获得了一系列的突破性进展,成为不孕不育夫妇治疗的首选[1]。移植高质量的胚胎将可以决定临床妊娠率,因此胚胎质量是决定胚胎移植成功的关键因素。目前临床上主要应用形态学方法筛选胚胎,形态学评估由于其无创,操作简便等优点,成为目前实验室胚胎选择的常规方法[2]。该方法是指在倒置显微镜下,对不同发育时期的胚胎进行形态学评分,将评分结果好的胚胎用于移植[3]。但是该方法存在缺陷,如胚胎形态学评分并不能全面地反映胚胎的发育潜能,过多依赖于实验室技术人员的主观判断标准,观察时间过短,数据之间缺乏联系,同时缺少客观可量化的指标等[4],都有可能影响最终临床妊娠率(pregnancy rate,PR)。因此如何提高预测早期胚胎发育潜能的能力和临床妊娠率成为ART面临的巨大问题,发现新的胚胎发育潜能标记物成为胚胎学家的研究热点[5]。
卵母细胞颗粒细胞作为卵母细胞生存的主要内环境,对卵母细胞的营养和成熟起到非常重要的作用[6]。卵丘颗粒细胞和卵母细胞形成卵丘-卵母细胞复合体,与卵母细胞间存在着广泛的细胞间连接,参与卵泡的募集、发育和优势化,保证卵母细胞正常的成熟分裂过程。相互交换物质、促进卵母细胞发育、成熟[7]。端粒(telomere)是线状染色体末端的DNA重复序列(TTAGGG),随着细胞分裂而逐渐缩短到一定程度后细胞会发生凋亡。端粒的功能包括维持染色体结构的完整性,防止染色体被核酸酶降解及染色体间相互融合,防止染色体结构基因在复制时丢失,细胞的凋亡也受到端粒和端粒酶调控[8]。随着细胞分裂,端粒不断缩短,当端粒缩短至其阈值时细胞凋亡。研究卵母细胞周围的颗粒细胞端粒,将为成熟卵母细胞、优质胚胎选择提供客观、准确且无创的方法,从而提高妊娠率[9]。LIU等[10]建立了敲除小鼠端粒酶基因的模型,研究其代数与繁殖力的关系,结果发现随着代数增加,获卵数、受精率、优胚率和种植率逐渐降低。YAMADA等[11]研究认为高龄小鼠卵母细胞质量下降的原因与胞质内活性氧基团的积累有关。随着年龄增加,端粒逐渐缩短,活性氧基团累积越多,会破坏染色体的稳定而影响繁殖能力。国内有文章显示卵丘颗粒细胞端粒长度与卵母细胞的成熟度和妊娠结局密切相关,具有较高的临床研究价值[12]。但是仍然需要大样本多中心的研究数据。
本研究选择2015年1月至2017年6月在柳州市妇幼保健院生殖健康助孕中心行ICSI-ET的患者,通过测定患者颗粒细胞端粒的相对长度,研究不同年龄组的端粒长度与临床妊娠结局的关系,为临床胚胎移植时选择最具发育潜能的胚胎提供参考。
1 对象与方法
1.1 研究对象 选取2015年10月至2017年6月在柳州市妇幼保健院生殖健康助孕中心行ICSI-ET的患者纳入本研究。所选患者之间女方年龄、不孕年限、内膜准备方案等方面比较,差异均无显著性(P>0.05),见表1。

表1 入选患者基本信息Tab.1 Demographic data for couples undergoing ARTs
1.2 控制性超促排卵 所有患者均采用柳州市妇幼保健院生殖健康助孕中心常规的促排卵方案。在月经周期的第4天开始促排,根据B超监测和血清雌二醇(Estradiol,E2)水平调整药物剂量,当优势卵泡直径达18 mm时肌肉注射人绒毛膜促性腺激素(HCG)(Serono,德国)10 000 U,34~36 h后在B超引导下取卵[13]。
1.3 ICSI与胚胎培养 精液收集及处理方法按照我中心常规处理方法简述如下,男方通过手淫法取精,液化后使用Isolate密度梯度离心法(Irvine,America)对精液进行梯度离心,G-IVF授精液(Vitro Life,Sweden)上游法处理精液。
卵子放入G-IVF中2~5 h后,经过酶消化后去除颗粒细胞,行ICSI授精,转入序贯培养液Cook,观察受精情况并进行原核评分。第3天观察胚胎分裂情况即常规评估胚胎。根据患者签署知情同意书的情况将剩余胚胎进行继续囊胚培养或冷冻。培养至第5天或第6天观察囊胚形成情况进行将囊胚移植或者冷冻。
胚胎培养及受精所用液体均在CO2培养箱(6.0%CO2、37℃、100%湿度环境)中平衡过夜[14]。
1.4 胚胎移植及妊娠判断 将胚胎转移至移植导管在B超引导下移植入患者子宫。胚胎移植后D15检测血hCG,D35超声检查见妊娠囊和心血管波动判定为临床妊娠。
1.5 颗粒细胞的采集与保存 经阴道超声引导下穿刺取卵,将卵母细胞及颗粒细胞放入G-IVF中2~5 h后,经过酶消化后去除颗粒细胞,将颗粒细胞混合,在PBS缓冲液中1 500 r/s×5 min,反复离心洗涤3次后将所收集的颗粒细胞转移至EP管中,将收集颗粒细胞的EP管置于-80℃冰箱中冷冻保存备用。
1.6 提取颗粒细胞的DNA和检测端粒长度
1.6.1 DNA提取 DNA提取试剂盒(DNeasy Tissue Kit,Qiagen,Inc.Mississauga,Ontario,Canada)用于提取颗粒细胞中的DNA。简述如下,将颗粒细胞沉淀中加入Protease K 20 μL、Buffer AL 200 μL,混匀后56℃水浴10 min。加入无水乙醇200 μL/管,混匀后转移入Spin Colunm,室温下以13 200 r/min离心2.5 min。弃滤液,将Spin Column移入清洁收集管中,加 AWl液 600 μL,室温下以 13 200 r/min离心2.5 min。弃滤液,将Spin Column移入另一清洁收集管中加AW2液600 μL,室温下以13 200 r/min离心2.5 min。弃滤液,将Spin Column转移入已标患者姓名的新1.5 mL离心管中,加Buffer AE 300 μL,室温下以13 200 r/min离心2.5 min。核对标本姓名及编码,收集离心管内液体(即提出的DNA),用超微量分光光度计测定OD260和OD280,-20℃保存备用。取DNA溶液1 μL分别测260、280 nm波长下的光密度(OD)值,然后计算OD260nm/OD280nm的比值。
1.6.2 引物的设计、合成与端粒长度检测 引物设计参照文献,由广州艾基生物技术有限公司合成,PCR反应引物序列见表2。

表2 引物序列Tab.2 Primers sequences
1.6.3 QRT-PCR反应体系及条件 QRT-PCR购买北京康为世纪公司试剂盒,PCR仪为ABI7500。按照表3的反应体系进行试验。具体反应条件及步骤如下,(1)第一步:(预变性)94℃ 5 min,1个循环;(2)第二步:(PCR反应)94℃ 15 s、58℃ 30 s、72℃30 s、83 ℃ 20 s(测定荧光),40个循环;(3)第三步:(溶解曲线分析)95℃ 20 s、65℃ 15 s、95℃ 0 s,1个循环。每次qRT-PCR反应均重复3次,根据CAWTHON等[15]的公式计算端粒长度:T/S相对比值=2-(△Cts-Ctc)=2-△△Ct。注:△Cts=Ct(telomeres)sample-Ct(36B4)sample,△Cts=Ct(telomeres)calibrator-Ct(36B4)calibrator。

表3 反应体系Tab.3 Reaction system
1.7 统计学方法 采用Excel 2007进行数据录入,使用SPSS 19.0进行统计分析,定量资料两组之间比较采用独立样本t检验,将卵母细胞颗粒细胞端粒长度与临床妊娠率之间进行单因素Logistic回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 不同年龄组别颗粒细胞端粒长度差异的研究 低龄组颗粒细胞端粒长度与高龄组比较差异有统计学意义(4.69±0.88vs.3.78±0.69,P<0.05)。随着年龄增加,颗粒细胞端粒长度呈现逐渐降低的趋势。
2.2 低龄组和高龄组患者妊娠者与未妊娠者端粒长度比较 见表4,低龄组高发育潜能胚胎的卵母细胞颗粒细胞的端粒长度大于低发育潜能胚胎(P<0.05)。见表5,高龄组高发育潜能胚胎的卵母细胞颗粒细胞的端粒长度大于低发育潜能胚胎(P<0.05)。
表4 低龄组(≤35岁组)卵母细胞颗粒细胞端粒长度及胚胎发育情况比较Tab.4 Effects of telomere length in granulosa cells of patients with different age on ICSI treatment ±s
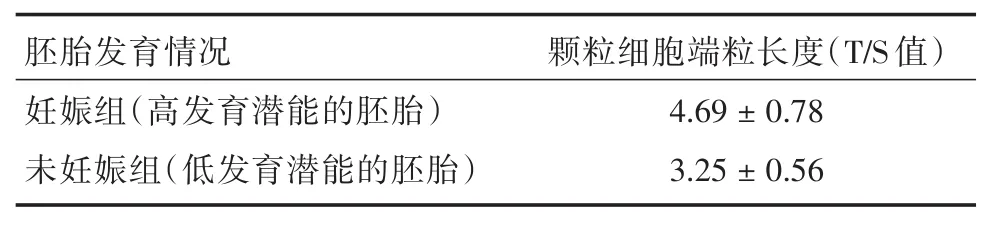
表4 低龄组(≤35岁组)卵母细胞颗粒细胞端粒长度及胚胎发育情况比较Tab.4 Effects of telomere length in granulosa cells of patients with different age on ICSI treatment ±s
胚胎发育情况妊娠组(高发育潜能的胚胎)未妊娠组(低发育潜能的胚胎)颗粒细胞端粒长度(T/S值)4.69±0.78 3.25±0.56
表5 高龄组(>35岁组)卵母细胞颗粒细胞端粒长度及胚胎发育情况比较Tab.5 Effects of telomere length in granulosa cells of patients with different age on ICSI treatment ±s

表5 高龄组(>35岁组)卵母细胞颗粒细胞端粒长度及胚胎发育情况比较Tab.5 Effects of telomere length in granulosa cells of patients with different age on ICSI treatment ±s
胚胎发育情况妊娠组(高发育潜能的胚胎)未妊娠组(低发育潜能的胚胎)颗粒细胞端粒长度(T/S值)4.09±0.93 2.92±0.84
2.3 端粒长度与临床妊娠率的相关性分析 见表6,Logistic回归显示端粒长度与临床妊娠率(≤35岁组和>35岁组)有关。

表6 Logistic逻辑回归分析端粒长度与临床妊娠率的关系Tab.6 Logistic analysis of pregnancy rate according to different age
3 讨论
端粒是染色体末端一种特殊的帽状结构,由重复串联的TTAGGG序列和酶构成[9],在维持染色体结构的完整性,防止染色体被核酸酶降解及染色体间相互融合,防止基因在复制时丢失等方面起到重要作用。端粒是细胞的“生命时钟”,细胞每分裂一次,端粒DNA就会减少一定的数目,当端粒长度缩短到极限时细胞就会停止分裂,失去保护染色体末端的能力,进而出现染色体变性、溶解,引起细胞衰老或死亡。端粒除了受年龄影响外,还受如端粒酶活性、环境因素等因素的影响。
卵泡的发育及成熟是一个高度复杂而有序的过程。卵泡发育的过程是卵母细胞和颗粒细胞相互作用、共同成熟的过程。颗粒细胞作为卵母细胞生存的内环境,参与卵泡的募集、发育,在卵母细胞成熟过程中互相作用,提供营养,保证卵母细胞正常的成熟。GUO等[16]研究证明端粒越长其所对应的卵母细胞发育潜力越强,而端粒长度较短的卵母细胞发育的胚胎质量较差,同时颗粒细胞凋亡较多则不利于卵母细胞的成熟。FESAHAT等[17]研究显示,通过利用模式生物大鼠研究发现,颗粒细胞端粒酶长度缩短可能导致卵泡发生闭锁。颗粒细胞中特定的基因与卵母细胞减数分裂和胞核成熟密切相关。若颗粒细胞的端粒因缺乏端粒酶而不断缩短,最终会阻碍卵母细胞成熟。在细胞分裂过程中会产生大量的氧自由基(ROX),ROX对鸟嘌呤特别敏感,ROX会结合到染色体末端的端粒上,大量的氧化反应会引起颗粒细胞染色体结构受损,引起颗粒细胞染色体断裂,细胞衰老、凋亡。颗粒细胞的凋亡信号经过缝隙连接进入卵母细胞而影响卵母细胞的成熟。
端粒与女性生殖能力密切相关。随着女性年龄得增加,卵巢功能呈现下降的趋势。细胞复制次数随着年龄而增多,所获得卵母细胞的质量也呈现下降的趋势,染色体异常率增加,女性的生殖能力显著下降。本研究发现,颗粒细胞端粒长度与年龄呈负相关,与其他研究结果相似。其原因为颗粒细胞凋亡率增加,导致卵母细胞质量下降,胚胎发育能力下降,胚胎移植后妊娠率降低[18]。也有学者研究了大鼠卵泡闭锁与端粒酶之间关系,结果发现端粒酶活性降低导致端粒缩短,进而引起卵泡闭锁,卵母细胞成熟率下降[19],提示颗粒细胞的凋亡与卵母细胞的成熟、受精能力及早期胚胎质量密切相关。在2000年HOST等[20]的研究也得到相似的结果。CHENG等[21]对颗粒细胞与胚胎发育能力的研究结果发现,较长端粒的颗粒细胞有利于形成优质成熟的卵母细胞和高质量胚胎。
高质量的胚胎的颗粒细胞端粒长度要大于低质量胚胎的颗粒细胞端粒长度,且具有较高的妊娠率。因此颗粒细胞中端粒长度可以在某种程度上反映卵母细胞和胚胎中的受精及发育潜能。BUTTS等[22]研究发现,卵巢储备不好的女性其端粒长度要明显小于较储备正常的女性。在卵巢功能减弱的患者也得到相似规律。因此,端粒与生殖能力存在密切的相关性。KEEFE等[23]通过追踪IVF妊娠结局的研究发现,妊娠组较高龄者的端粒长度要大于未妊娠组。国内学者也有进行相关的研究,对不同年龄段患者妊娠和未妊娠者颗粒细胞端粒进行比较发现,高龄组妊娠者颗粒细胞端粒较长,但是在低龄组妊娠和未妊娠患者中无此差异[24],与本研究结果相似。本研究首次在临床应用中使用颗粒细胞端粒长度与形态学评分法相结合,在一定程度上提高了预测早期胚胎发育的能力,改善了临床妊娠率。
综上所述,端粒在女性的生殖与卵巢功能中起重要作用,与生殖能力存在密切的相关性。颗粒细胞的凋亡程度直接影响卵泡发育和胚胎质量,调控颗粒细胞端粒缩短的信息通过某种作用机制影响卵母细胞,从而对胚胎质量及最终临床妊娠结局产生影响。如何加深对颗粒细胞与胚胎质量之间分子机制的研究,延缓端粒缩短,改善卵母细胞和胚胎质量,还有待进一步研究。
[1]MALEKI-SAGHOONI N,AMIRIAN M,SADEGHI R,et al.Effectiveness of infertility counseling on pregnancy rate in infertile patients undergoing assisted reproductive technologies:A systematic review and meta-analysis[J].Int J Reprod Biomed(Yazd),2017,15(7):391-402.
[2]DIEAMANT F,PETERSEN C G,MAURI A L,et al.Single versus sequential culture medium:which is better at improving ongoing pregnancy rates?A systematic review and meta-analysis[J].JBRA Assist Reprod,2017,21(3):240-246.
[3]邓爱民,郭江华,陈晓燕,等.卵子形态与胚胎质量及临床妊娠的关系[J].实用医学杂志,2009,25(9):1409-1411.
[4]SCHOOLCRAFT W,MESEGUER M,GLOBAL FERTILITY ALLIANCE.ELECTRONIC ADDRESS A T I C,Paving the way for a gold standard of care for infertility treatment:improving outcomes through standardization of laboratory procedures[J].Reprod Biomed Online,2017,35(4):391-399.
[5]黄国宁,孙莹璞,孙海翔,等.辅助生殖实验室技术[M].北京:人民卫生出版社,2014:169.
[6]WANG W,CHEN H,LI R,et al.Telomerase activity is more significant for predicting the outcome of IVF treatment than telomere length in granulosa cells[J].Reproduction,2014,147(5):649-657.
[7]TREFF N R,SU J,TAYLOR D,et al.Telomere DNA deficiency is associated with development of human embryonic aneuploidy[J].PLoS Genet,2011,7(6):e1002161.
[8]KIM S,SANDLER D P,CARSWELL G,et al.Reliability and short-term intra-individual variability of telomere length measurement using monochrome multiplexing quantitative PCR[J].PLoS One,2011,6(9):e25774.
[9]CHILTON W,O′BRIEN B,CHARCHAR F.Telomeres,aging and exercise:Guilty by association?[J].Int J Mol Sci,2017,18(12).
[10]LIU L,FRANCO S,SPYROPOULOS B,et al.Irregular telo-meres impair meiotic synapsis and recombination in mice[J].Proc Natl Acad Sci U S A,2004,101(17):6496-6501.
[11]YAMADA-FUKUNAGA T,YAMADA M,HAMATANI T,et al.,Age-associated telomere shortening in mouse oocytes[J].Reprod Biol Endocrinol,2013,11(1):108.
[12]曹文丽,夏邦世,张艳普,等.卵丘颗粒细胞的端粒长度与体外受精-胚胎移植妊娠结局的关系[J].中华全科医学,2017,15(12):2096-2099.
[13]李楠,韦继红,唐永梅,等.胚胎累计评分法选择胚胎对妊娠率及流产率的预测[J].实用医学杂志,2015,20(4):625-627.
[14]李楠,牟联俊,李忻琳,等.不同胚胎冷冻保存时间和方法对FET周期临床结局的影响[J].实用医学杂志,2017,33(10):1638-1641.
[15]CAWTHON R M.Telomere length measurement by a novel monochrome multiplex quantitative PCR method[J].Nucleic Acids Res,2009,37(3):e21.
[16]GUO N,YANG F,LIU Q,et al.Effects of cumulus cell removal time during in vitro fertilization on embryo quality and pregnancy outcomes:a prospective randomized sibling-oocyte study[J].Reprod Biol Endocrinol,2016(1):14:18.
[17]FESAHAT F,SHEIKHHA M H,RASTI A,et al.An investigation on mitochondrial DNA deletions and telomere shortening during multiple passages of adult stem cells[J].Avicenna J Med Biotechnol,2014,6(3):156-162.
[18]GREENSEID K,JINDAL S,HURWITZ J,et al.,Differential granulosa cell gene expression in young women with diminished ovarian reserve[J].Reprod Sci,2011,18(9):892-899.
[19]BULEU O G,JETYBAYEV I Y,BUGROV A G.Comparative analysis of chromosomal localization of ribosomal and telomeric DNA markers in three species of Pyrgomorphidae grasshoppers[J].Comp Cytogenet,2017,11(4):601-611.
[20]HOST E,MIKKELSEN A L,LINDENBERG S,et al.Apoptosis in human cumulus cells in relation to maturation stage and cleavage of the corresponding oocyte[J].Acta Obstet Gynecol Scand,2000,79(11):936-940.
[21]CHENG E H,CHEN S U,LEE T H,et al.Evaluation of telomere length in cumulus cells as a potential biomarker of oocyte and embryo quality[J].Hum Reprod,2013,28(4):929-936.
[22]BUTTS S,RIETHMAN H,RATCLIFFE S,et al.Correlation of telomere length and telomerase activity with occult ovarian insufficiency[J].J Clin Endocrinol Metab,2009,94(12):4835-4843.
[23]KEEFE D L,LIU L.Telomeres and reproductive aging[J].Reprod Fertil Dev,2009,21(1):10-14.
[24]王兴玲,蔡鹏飞,张文娟,等.不同年龄IVF-ET患者卵丘颗粒细胞端粒长度与卵母细胞成熟度及妊娠结局的关系[J].郑州大学学报(医学版),2016,51(2):233-236.
