3D腹腔镜Glisson蒂横断式肝切除术治疗肝癌对机体细胞免疫功能的影响
2018-07-05方兆山杨剑庞珏刘文瑛张智阮婕黄海
方兆山 杨剑 庞珏 刘文瑛 张智 阮婕 黄海
1南宁市第一人民医院暨广西医科大学第五附属医院(南宁530022);2南方医科大学珠江医院(广州510282)
在我国肝癌(hepatocellular carcinoma,HCC)是第4位的常见恶性肿瘤及第3位的肿瘤致死病因[1]。我国每年约有30万~40万人死于HCC,占全球HCC病死率的51%[2]。已严重威胁我国人民的生命和健康。尽管腹腔镜技术具有微创的诸多优点,但作为一种有创操作,手术的创伤可导致不同程度的免疫功能抑制,而这可能是术后感染率升高、肿瘤转移发生率增加的重要因素之一[3]。HCC患者免疫功能明显受到抑制,手术创伤对术后免疫功能的进一步抑制可能影响对肿瘤细胞的清除[4],HCC的发生、转移等均与患者的免疫功能受抑制有一定关系。因此,减少手术对患者免疫功能的影响将有助于改善患者的远期预后。小样本动物实验研究显示,相比于开腹肝切除术,腹腔镜肝切除术对免疫功能具有保护作用,术后免疫恢复更快[5]。3D腹腔镜肝切除术具备传统2D腹腔镜肝切除术的优点:更快的恢复、术后疼痛少,并发症较少,粘连少,美容效果良好[6]。但对3D腹腔镜Glisson蒂横断式肝切除治疗HCC患者对机体细胞免疫功能影响研究鲜有报道,本研究拟通过观察比较3D腹腔镜与开腹Glisson蒂横断式肝切除治疗HCC手术前后细胞免疫功能的变化,评估3D腹腔镜肝切除术对机体免疫功能的影响。
1 资料与方法
1.1 一般资料 纳入标准:(1)诊断符合《原发性肝癌诊疗规范》[7]。(2)临床确诊为HCC且术前未接受过任何治疗。排除标准:(1)伴免疫系统疾病史;(2)合并糖尿病,近期或长期使用糖皮质激素史。(3)腹腔镜中转开腹手术患者。(4)拒绝配合研究的患者。根据上述标准,选取了2014年1月至2017年12月收治的HCC患者共60例,随机分为3D腔镜组(3D-LH)和开腹组(OH)。
1.2 手术方法 所有患者均采用气管内插管全麻麻醉,由同一组手术医生完成。3D-LH手术步骤:(1)采用美国VIKING高清3D腹腔镜系统,术中佩戴无源偏振眼镜。(2)采用Glisson蒂横断肝切除术的方法,具体手术操作参照文献[8-9],解剖出拟切除肝段的Glisson蒂,阻断后肝段缺血,确定肝切除平面,进行大块肝切除术或小块肝切除术。OH手术步骤:采用Glisson蒂横断肝切除术的方法,具体手术步骤参照文献[10-11]。
1.3 观察指标 (1)免疫指标:采用流式细胞仪检测CD4+T、CD8+T细胞。早晨抽取患者外周静脉血3 mL,检测术前及术后1、7 d血清中CD4+,CD8+T细胞,比较两组患者细胞免疫功能变化。(2)临床指标:比较两组患者术式、手术时间、术中出血量、术后住院时间、术后并发症。
1.4 统计学方法 采用SPSS 19.0软件分析。计量资料以均数±标准差表示,比较采用t检验;计数资料采用频数(%)表示,计数资料组间采用χ2检验;P<0.05表示差异具有统计学意义。
2 结果
2.1 两组术前基线资料比较 两组患者在年龄、性别、体质指数(BMI)、肿瘤直径等比较,差异均无统计学意义(P>0.05),具有可比性。见表1。
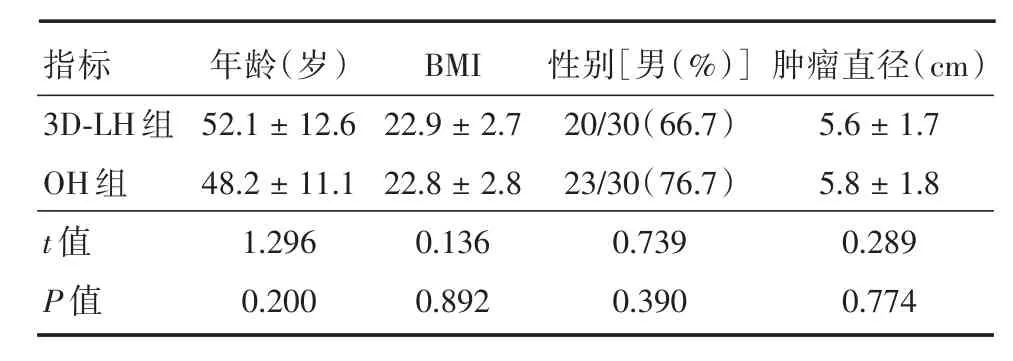
表1 两组患者术前基线资料比较Tab.1 Comparison of baseline data in pre-operation between 2 groups
2.2 两组患者围手术期临床指标资料比较 3DLH组手术时间、术后住院时间少于OH组,差异均具有统计学意义(P<0.05);两组患者术式、术中失血量、并发症等比较差异无统计学意义(P>0.05)。见表2。
表2 两组患者围手术期临床资料比较Tab.2 Comparison of clinical data between 2 groups in perioperative period ±s

表2 两组患者围手术期临床资料比较Tab.2 Comparison of clinical data between 2 groups in perioperative period ±s
观察指标大块/小块肝切除术(术式)手术时间(min)术中出血量(mL)术后并发症[例(%)]术后住院时间(d)3D-LH组9/21 181±70 245±210 4/30(13.3)9.3±2.4 OH组10/20 223±79 302±245 6/30(20)13.1±2.4 t值0.077-2.162-0.970 0.488-6.208 P值0.781 0.035 0.336 0.480 0.000
2.3 两组患者CD4+、CD8+T细胞免疫功能变化比较 术后1 d,3D-LH组的CD4+T、CD8+T细胞免疫指标下降少于OH组;术后7 d,3D-LH组的CD4+T、CD8+T恢复快于OH组,组间比较差异均具有统计学意义(P<0.05)。3D-LH组术前的CD4+、CD8+与术后1 d的比较差异均有统计学意义(P<0.05),与术后7 d的比较差异均无统计学意义(P>0.05)。OH组术前的CD4+、CD8+与术后1 d的比较差异有统计学意义(P<0.05),术前的CD8+与术后7 d的比较差异有统计学意义(P<0.05)。OH组术后1、7 d CD4+、CD8+与3D-LH组间比较差异均具有统计学意义(P< 0.05)。见图1、2、表3、4。

图1 两组CD4+T细胞免疫功能变化Fig.1 Variations of CD4+T cellular immune function between two groups
3 讨论
3.1 3 D腹腔镜Glisson蒂横断式肝切除术的意义 随着腹腔镜技术的成熟,现腹腔镜可进行CouinaudⅠ~Ⅷ的肝段切除术、半肝切除,甚至超半肝的肝切除术[12-13],且具有比开腹肝切除术出血少、术后恢复快等特点[14]。本研究结果显示,3D-LH组手术时间[(181±70)minvs.(223 ± 79)min,P=0.035]、术后住院时间[(9.3 ± 2.4)dvs.(13.1 ± 2.4)d,P<0.001]均少于OH组,说明3D腹腔镜Glisson蒂横断式肝切除术患者的手术创伤小,术后康复快。3D腹腔镜良好的景深感,使解剖层次更加清晰,有助于肝切除术精细操作,缩短手术时间[15],减少手术副损伤[16]。另外,3D腹腔镜Glisson蒂横断式肝切除术还具有以下优势:(1)缩短Glisson蒂的分离时间,减少血管和对侧胆管损伤的风险;(2)手术操作简单、安全、高效,且微创和解剖精准的优势[8]。

图2 两组CD8+T细胞免疫功能变化Fig.2 Variations of CD8+T cellular immune function between two groups
表3 两组患者围手术期CD4+、CD8+T细胞免疫功能比较Tab.3 ComparisonofCD4+T、CD8+Tcellularimmunefunction between 2 groups in perioperative period ± s,%
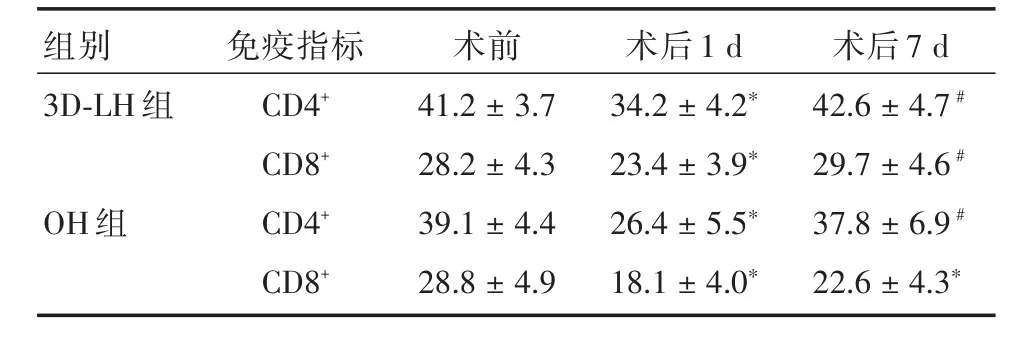
表3 两组患者围手术期CD4+、CD8+T细胞免疫功能比较Tab.3 ComparisonofCD4+T、CD8+Tcellularimmunefunction between 2 groups in perioperative period ± s,%
注:与术前相比,*P<0.05,#P>0.05
组别3D-LH组OH组免疫指标CD4+CD8+CD4+CD8+术前41.2±3.7 28.2±4.3 39.1±4.4 28.8±4.9术后1 d 34.2±4.2*23.4±3.9*26.4±5.5*18.1±4.0*术后7 d 42.6±4.7#29.7±4.6#37.8±6.9#22.6±4.3*
表4 两组患者CD4+T,CD8+T免疫功能比较Tab.4 Comparison of CD4+T、CD8+T cellular immune function between 2 groups in perioperative period ±s

表4 两组患者CD4+T,CD8+T免疫功能比较Tab.4 Comparison of CD4+T、CD8+T cellular immune function between 2 groups in perioperative period ±s
时间术前术后1 d术后7 d指标CD4+CD8+CD4+CD8+CD4+CD8+3D-LH组41.2±3.7 28.2±4.3 34.2±4.2 23.4±3.9 42.6±4.7 29.7±4.6 OH组39.1±4.4 28.8±4.9 26.4±5.5 18.1±4.0 37.8±6.9 22.6±4.3 t值1.952-0.475 6.085 5.166 3.170 6.098 P值0.056 0.637 0.000 0.000 0.002 0.000
3.2 3 D腹腔镜Glisson蒂横断式肝切除术对机体细胞免疫功能的影响 CD4+、CD8+T细胞是人体免疫系统中的重要T淋巴细胞的细胞亚群,它与肿瘤的形成、扩展、转移具有相关性。CD4+T细胞主要亚群是辅助T细胞,通过释放多种细胞因子起着辅助诱导等免疫调节作用,进而产生抗肿瘤免疫效应;CD8+T细胞主要是细胞毒性T细胞,通过释放穿孔素、颗粒酶介导肿瘤细胞裂解和与肿瘤细胞表面某些位点结合介导细胞凋亡这两种途径直接杀伤肿瘤细胞。
本研究显示两组患者术后1 d,CD4+、CD8+T细胞的比例(数)同术前相比均明显降低,差异均具有统计学意义(P<0.05),说明这两种术式的创伤、应激对免疫系统均产生抑制作用。即无论是3D腹腔镜下,还是开腹的Glisson蒂横断式肝切除术,均影响了患者的细胞免疫功能。从图1、图2看两组患者的细胞免疫功能变化,术后7 d 3D-LH组的CD4+、CD8+细胞的比例和OH组均呈上升趋势(P<0.05),且术后第7天3D-LH组与术前比较差异已经无统计学意义(P>0.05),即CD4+、CD8+细胞免疫功能已经基本恢复至术前水平。但OH组的CD8+T细胞术后7 d仍未恢复正常,且与术前比较差异有统计学意义(P<0.05)。说明OH组患者机体细胞免疫受抑制比3D-LH组明显。两组患者术后7 d内均经历了免疫功能受抑制,而后逐步恢复,3D-LH组恢复比OH组快。
通过以上的分析比较,可以得出3D-LH手术对患者的CD4+、CD8+T淋巴细胞免疫功能影响比OH的小。这与肿瘤微创外科治疗、腹腔镜在胃癌手术等研究得出相似结论[17-18]。研究显示,手术创伤所引起的细胞免疫功能抑制,将增加患者术后感染、肿瘤转移的风险[19]。以上的分析显示,3D腹腔镜Glisson蒂横断式肝切除术作为微创手术,简化了手术操作,缩短了手术时间,对机体创伤小,免疫影响小,术后机体细胞免疫恢复更快。因此,3D腹腔镜Glisson蒂横断式肝切除术治疗HCC有可能获得更好的预后。
相对于开腹Glisson蒂肝切除术手术,3D腹腔镜Glisson蒂横断式肝切除术对肝癌患者机体损伤较小,对其免疫功能的影响小,恢复更快。
3D腹腔镜Glisson蒂横断式肝切除术对机体细胞免疫影响小,具有潜在的优势,但本研究研究时间较短,样本量偏小,研究结果仍有待于大样本多中心的前瞻性随机对照研究进一步验证。
[1]CHEN W,ZHENG R,BAADE P D,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[2]WANG F S,FAN J G,ZHANG Z,et al.The global burden of liver disease:the major impact of China[J].Hepatology,2014,60(6):2099-2108.
[3]LEE S,WHELAN R.Immunologic and oncologic implications of laparoscopic surgery:what is the latest?[J].Clin Colon Rectal Surg,2006,19(1):5-12.
[4]TAYLOR G W,JAYNE D G,BROWN S R,et al.Adhesions and incisional hernias following laparoscopic versus open surgery for colorectal cancer in the CLASICC trial[J].Br J Surg,2010,97(1):70-78.
[5]CHOPRA S S,HAACKE N,MEISEL C,et al.Postoperative immunosuppression after open and laparoscopic liver resection:assessment of cellular immune function and monocytic HLA-DR expression[J].JSLS,2013,17(4):615-621.
[6]TRANCHART H,DAGHER I.Laparoscopic liver resection:a review[J].J Visc Surg,2014,151(2):107-115.
[7]中华人民共和国卫生和计划生育委员会医政医管局.原发性肝癌诊疗规范(2017年版)[J].中华消化外科杂志,2017,16(7):705-720.
[8]CHO A,YAMAMOTO H,KAINUMA O,et al.Safe and feasible extrahepatic Glissonean access in laparoscopic anatomical liver resection[J].Surg Endosc,2011,25(4):1333-1336.
[9]黄海,彭健,莫世发,等.腹腔镜下Glisson蒂横断式解剖性肝切除临床研究[J].中国内镜杂志,2015,21(7):714-717.
[10]YAMAMOTO M,KATAGIRI S,ARIIZUMI S,et al.Glissonean pedicle transection method for liver surgery(with video)[J].J Hepatobiliary Pancreat Sci,2012,19(1):3-8.
[11]黄海,谭新华,韦杨年,等.Glisson蒂横断式精准肝切除与美蓝染色法在肝癌患者中的联合应用[J].中国癌症防治杂志,2010,2(4):303-305.
[12]ISHIZAWA T,GUMBS A A,KOKUDO N,et al.Laparoscopic Segmentectomy of the Liver:From Segment I to VIII[J].Ann Surg ,2012,256(6):959-964.
[13]GUMBS A A,GAYET B.Totally laparoscopic extended right hepatectomy[J].Surg Endosc ,2008,22(9):2076-2077.
[14]张浩,董科,俞小炯,等.完全腹腔镜和开腹肝切除手术治疗原发性肝细胞肝癌的近期和远期疗效比较[J].实用医学杂志,2017,33(12):1943-1948.
[15]VELAYUTHAM V,FUKS D,NOMI T,et al.3D visualization reduces operating time when compared to high-definition 2D in laparoscopic liver resection:a case-matched study[J].Surg Endosc ,2016,30(1):147-153.
[16]WILHELM D,REISER S,KOHN N,et al.Comparative evaluation of HD 2D/3D laparoscopic monitors and benchmarking to a theoretically ideal 3D pseudodisplay:even well-experienced laparoscopists perform better with 3D[J].Surg Endosc,2014,28(8):2387-2397.
[17]HUANG C,HUANG R,JIANG T,et al.Laparoscopic and open resection for colorectal cancer:an evaluation of cellular immunity[J].BMC Gastroenterol,2010,10(1):1-8.
[18]BOBOCEA A C,TRANDAFIR B,BOLCA C,et al.Minimally invasive surgery in cancer.Immunological response[J].Chirurgia(Bucur),2012,107(2):154-157.
[19]NEEMAN E,BEN-ELIYAHU S.Surgery and stress promote cancer metastasis:New outlooks on perioperative mediating mechanisms and immune involvement[J].Brain Behav Immun ,2013,30(Suppl):S32-S40.
