间充质干细胞源性外泌体提取鉴定方法研究
2018-07-05甘国胜袁紫林闫德祺
杨 前 甘国胜 袁紫林 王 刚 陈 力 闫德祺 张 宜 刁 波
(中国人民解放军武汉总医院医学实验科 武汉 430000)
干细胞外泌体是MSCs在病理或者生理状态下分泌的直径约30~100 nm的膜性小囊泡,含有蛋白质、mRNA等活性成分,有研究表明干细胞外泌体能一定程度上模拟MSC的生物学功能,具有广阔的应用前景[1~2]。本课题将应用二次提取法提高外泌体的纯度,为准确的开展其他实验提供依据。
1 材料与方法
1.1 仪器及试剂
CD31、CD73、CD29、CD81、CD63(BD); 外泌体提取试剂盒(invitrogen);高速离心机(Sigma); FACsAria流式细胞仪 (BD);透射电镜(Philips)。
1.2 脐带间充质干细胞培养及鉴定
无菌操作将脐带剪碎,分离出沃顿胶,接种至培养皿中,加入干细胞培养基,待细胞集落长满后,消化传代;取状态良好的P3代细胞悬液50μl,加入10μlCD31、CD73、DRPerCP及5μlCD29,避光孵育15min,1000r/min,离心5min,沉淀500μlPBS重悬,流式检测。
1.3 干细胞外泌体提取
将MSCs无血清空培养24h,取5ml上清,2000G离心30min,取上清,加入1/2体积外泌体提取液,4 ℃过夜,第2天10000G,4 ℃离心60min,取部分沉淀,凝胶电泳及BCA检测;剩余沉淀重悬PBS中,再次加入1/2体积外泌体提取液,4℃静置12H及24H,10000G,4 ℃离心60min,弃上清,再次取出部分沉淀凝胶电泳及BCA检测,其余-80℃冻存。
1.4 凝胶电泳法及BCA蛋白定量法检测外泌体纯度及浓度
分别将两次提取的蛋白样品用上样缓冲液稀释,沸水浴5min,灌胶,上样,并加入20μl蛋白Marker对照,电泳(2~3H);染色4~6h;脱色;凝胶摄像分析;同时将适量两次次提取的样品液加入96孔板中,标准品稀释至20μl;各孔加入200μl BCA工作液,37℃避光20min;562nm,测OD值;计算蛋白浓度。
1.5 电镜观察外泌体形态
取外泌体悬液20μl,滴于载样铜网上,室温静置1min,自然干燥,滴加20g/L磷钨酸负染1min,滤纸吸干残留液,白炽灯下烤10min,电镜观察拍照。
1.6 流式检测外泌体
将20 μl CD63和5μlCD81加入100μl外泌体悬液中,混匀,4 ℃避光孵育30min,用同型不加抗体的外泌体悬液作阴性对照,流式检测。
2 结果
2.1 huc-MSCs流式检测
脐带干细胞呈现CD73(+)、CD29(+)、CD31(-)、HLA-DR-Per-CP(-)纯度和活性都比较高的特征(图1)。
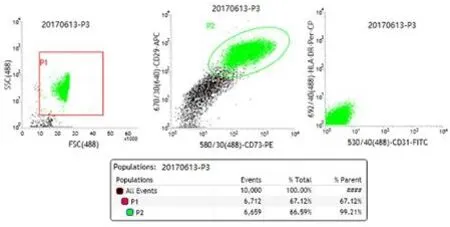
图1 huc-MSCs表面标志物流式检测
2.2 凝胶电泳法及BCA蛋白定量法检测蛋白纯度及浓度
外泌体经一次提取后,杂蛋白条带非常多,纯度低,而二次提取后杂蛋白少了很多,纯度提高(图2);QuantityOne软件分析得出蛋白条带灰度值(图2-C);GraphPad Prism 7 软件分析数值并计算得出一次提取与二次提取12H及24H(P<0.01),均存在显著性差异(图2-D);BCA蛋白定量法得出,一次提取后外泌体蛋白含量为15.49ug/ml;二次提取后平均含量为3.48ug/ml;杂蛋白去除,外泌体纯度提高。
2.3 间充质干细胞外泌体电镜观察
MSCs外泌体呈圆形或椭圆形的小囊泡,囊泡外周可见膜性结构,大小具有较明显的异质性,直径为30~100nm,腔内部显示低电子密度成分(图3)。
2.4 间充质干细胞外泌体流式检测
MSCs外泌体空白对照组没有检测出CD63、CD81蛋白,实验组则高表达CD63、CD81蛋白(图4)。

A

B

C
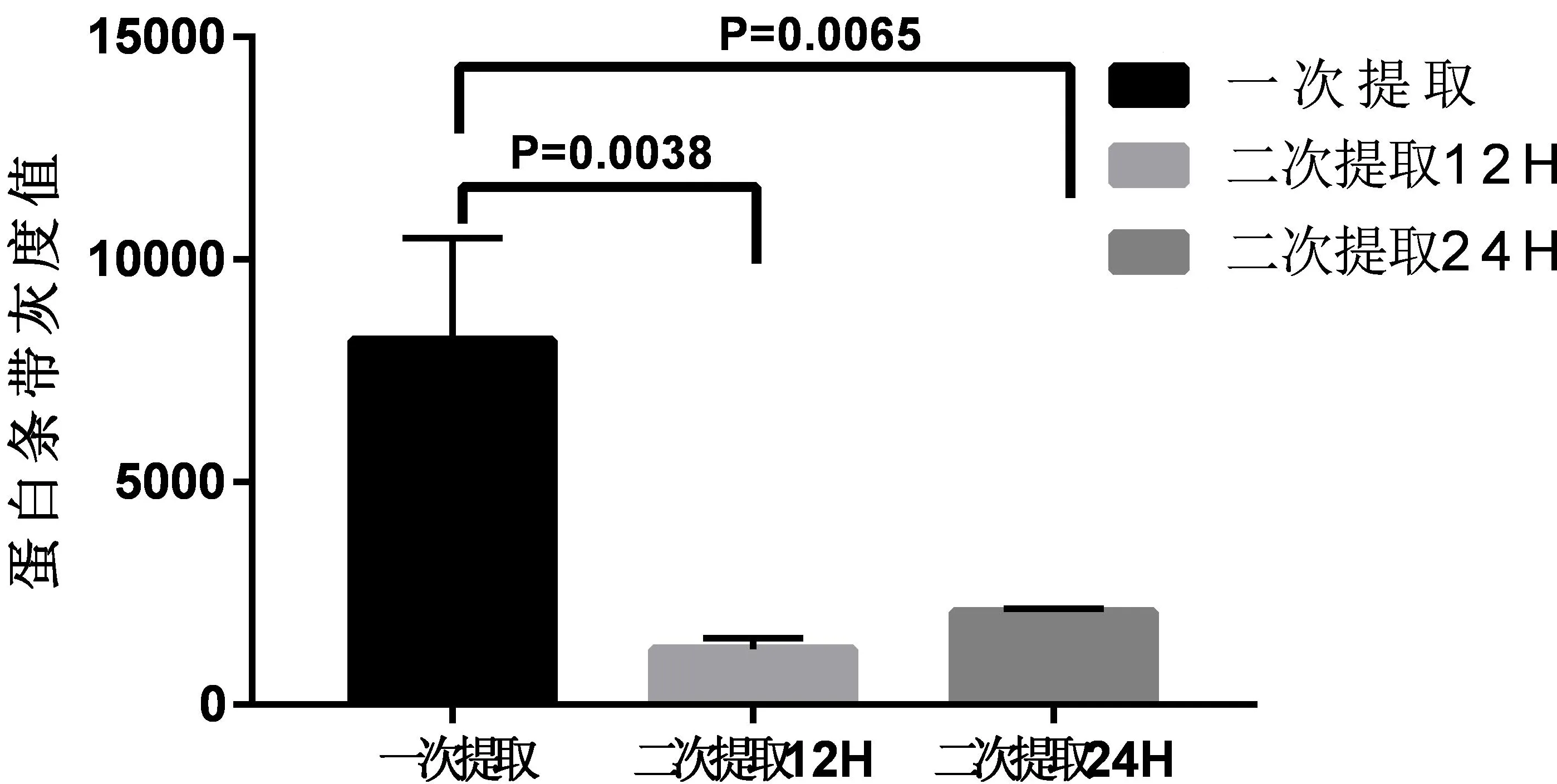
D
注:A图表示一次提取后,1、2、3、4四个重复样本杂蛋白条带都非常多;B图二次提取电泳图,1、2、3图是加入提取液静置12H, 4、5、6是静置24H,杂蛋白条带明显降低。

图3 外泌体电镜形态
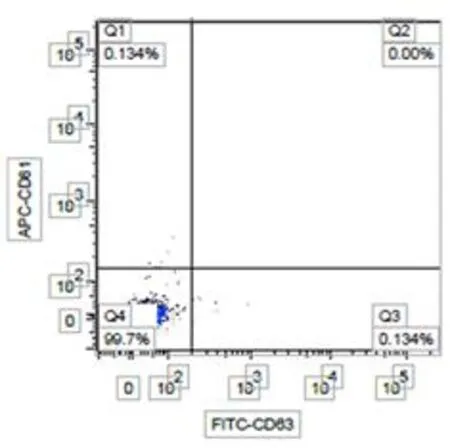
A 空白对照

B huc-MSC外泌体
3 讨论
MSCs是一类具有自我复制及多向分化潜能的祖细胞,具有组织修复、免疫调节等作用,为当今自然科学领域研究的热点问题。以往总认为其治疗潜能是由于MSC归巢分化、替代原来的损伤组织,直至2010年Lai等[3]通过分离MSC以内分泌和旁分泌的方式分泌的起修复作用的营养因子,首次证实为MSCs外泌体。有研究证实外泌体参与一系列生物过程,如免疫应答、血管生成、炎症反应、抗原提呈等[4],在减少心肌损伤、促进心血管再生、调节免疫系统、促进神经再生等方面有重要作用[5]。由此可见准确的提取鉴定外泌体的方法尤为重要,本课题应用试剂盒二次提取纯化外泌体,大大提高外泌体的纯度,为准确开展后续实验研究提供有力科学依据。
1 Ailawadi S,Wang X,Gu H,et al. Pathologic Function and Therapeutic Potential of Exosomes in Cardiovascular Disease.Biochim Biophys Acta,2015,1852(1):1~11.
2 Huang L,Ma W,Ma Y,et al.Exosomes in Mesenchymal Stem Cells,a New Therapeutic Strategy for Cardiovascular Diseases.Int J Bid Sci,2015,11(2):238~245.
3 Lai RC,ArsIan F,Lee MM,et al.Exosome Secreted by MSC Reduces Myocardial Ischemia Reperfusion Injury.Stem Cell Res,2010,4(3):214~222.
4 Sun L,Xu R,Sun X,et al.Safety Evaluation of Exosomes Derived from Human Umbilical Cord Mesenchymal Stromal Cell.Cytotherapy,2016,18(3):413~422.
5 Kariminekoo S,Movassaghpour A,et al.Implications of Mesenchymal Stem Cells in Regenerative Medicine.Artif Cells Nanomed Biotechnol,2016,44(3):749~757.
