正中神经剪切波弹性成像的可重复性评价
2018-07-05黄点点陈路增邢海英黄一宁
黄点点,陈路增,邢海英,黄一宁*
1.北京大学第一医院神经内科,北京 100034;2.北京大学第一医院超声诊断中心,北京 100034;
弹性成像是运用生物组织的弹性信息反映组织间的硬度差异的一种成像方式,由Ophir等[1]首次提出,是一种非侵入性评估组织机械性能(弹性)的方式。由于不同组织的硬度不同,对受压后的形态变化也不同。弹性成像通过对二维灰阶图像叠加不同颜色反映不同组织对施加应力的抗变形能力,在甲状腺[2]、乳腺[3]、肝脏[4]等器官的研究中广泛应用。但传统弹性成像技术受检查者对组织施加压力及耦合剂涂抹不均匀的影响,可重复性差[5]。剪切波弹性成像(shear wave elastography,SWE)通过测量超声声束产生的声辐射力对目标组织的扰动引起的剪切波在组织内的传播速度计算弹性模量值,其无需人为手动施加压力,理论上具有较好的重复性。腕管综合征(carpel tunnel syndrome,CTS)可引起相应神经弹性的变化[6-7],但目前对外周神经弹性测值的可重复性鲜有报道。本研究拟评估正常成人SWE测量正中神经杨氏模量的可重复性。
1 资料与方法
1.1 研究对象 收集2016年1月10日-2017年2月12日北京大学第一医院接受正中神经SWE检查的正常受试者31例,其中男17例,女14例;年龄26~45岁,平均(32.6±5.2)岁,同时记录受试者的身高及体重。纳入标准:①无已知的明显周围神经相关疾病家族史;②神经超声声像图未见明显异常。排除标准:①CTS诊断史;②任何涉及前臂、上臂和手腕的手术或骨折史;③任何可能导致CTS发展的药物史或基础疾病史;④正中神经横截面积增粗(超过10 mm2)或解剖变异。1例受试者因1型糖尿病、1例因前臂骨折史被排除。
1.2 仪器与方法 采用 Supersonic Imagine Aixplorer型全数字化彩色多普勒超声诊断仪,具有实时SWE分析软件及功能,采用4~15 MHz高频探头,肌骨超声工作条件,受试者取仰卧位。标记预先设定好的4个位点,分别是腕部折痕中点(P1)、腕部折痕和手肘之间(P2)、肘部(P3)及肘部以上8 cm(P4)。先行横截面扫查二维灰阶及彩色多普勒超声检查,定位正中神经,然后切换至SWE模式(图1)。待图像稳定后冻结,启动仪器提供的Q-BOX功能分别测量正中神经的 4个固定位点,系统自动计算出杨氏模量值,连续2次测量,取平均值。由2名检查者对受试者进行测量,检查者1具有中级职称、检查者2具有2年工作经验。检查分2次完成,间隔时间15 d。第1次检查当日上午先由1号检查者连续测量2次,取平均值,每次间隔30 min。然后由2号检查者连续测量2次,取平均值。下午及15 d后上午均由1号检查者进行测量,方法同上。对1号检查者第1次检查的上午、下午两组数值进行组内分析,观察检查者内(同一天不同时间)的可重复性。对检查者1第1次检查上午、间隔15 d后上午的两组测值进行组内分析,观察检查者内(不同日)的可重复性。对第1次检查上午2名检查者的测量值进行组间分析,观察检查者间的可重复性。

图1 男,35岁,正常成人。箭示正中神经,虚线范围为感兴趣区。灰阶超声示腕部折痕中点(A);SWE测量腕部折痕中点正中神经杨氏模量值(B)
1.3 统计学方法 采用SPSS 19.0软件,计量资料以±s表示,采用配对t检验,组内相关系数(intra-class correlation coefficient,ICC)、Pearson相关分析及Bland-Altman分析组间及组内的可重复性,其中ICC<0.4为可重复性差,ICC 0.4~0.75为重复性好,ICC>0.75为重复性很好,P<0.05表示差异有统计学意义。
2 结果
健康志愿者弹性成像杨氏模量测量见图1。正中神经杨氏模量值在男性与女性、左手与右手间差异无统计学意义(P>0.05)。
2.1 组内重复性 检查者1第1天上午与下午测得的正中神经各部位杨氏模量值差异无统计学意义(P>0.05),ICC均显示出良好的可重复性,Pearson分析显示呈正相关(P<0.05),见表 1~3;Bland-Altman分析显示检查者1上、下午测量的正中神经各部位杨氏模量值差值与均值呈一致性变化趋势(图2)。检查者1第1天上午与间隔15 d测得的正中神经各部位杨氏模量值差异无统计学意义(P>0.05),ICC均显示出良好的可重复性,Pearson分析显示呈正相关(P<0.05),见表1~3;Bland-Altman分析显示不同日测量的正中神经各部位杨氏模量值差值与均值呈一致性变化趋势(图2)。
表1 2名检查者测量的正中神经杨氏模量值组内及组间比较( ±s,kPa)

表1 2名检查者测量的正中神经杨氏模量值组内及组间比较( ±s,kPa)
注:P1表示腕部折痕中点,P2表示腕部折痕和手肘之间,P3表示肘部,P4表示在肘部以上8 cm
检查者P1 P2 P3 P4检查者1第1天上午26.07±3.36 7.99±1.64 28.12±4.38 16.79±2.61第 1 天下午 25.72±3.42 8.82±1.87 28.07±4.54 16.77±2.57间隔15 d上午26.55±3.19 8.29±1.35 28.28±4.06 17.11±2.46检查者 2 25.62±4.20 8.45±2.18 27.24±4.51 16.39±2.86

表2 正中神经杨氏模量值检查者组内及组间可重复性测量的ICC值
2.2 组间可重复性 检查者1与检查者2测得的正中神经各部位杨氏模量值差异无统计学意义(P>0.05),ICC值均显示出良好的可重复性,Pearson相关分析显示呈正相关(P<0.05),见表1~3;Bland-Altman分析显示2名检查者重复测量正中神经的杨氏模量差值与均值呈一致性变化趋势(图2)。
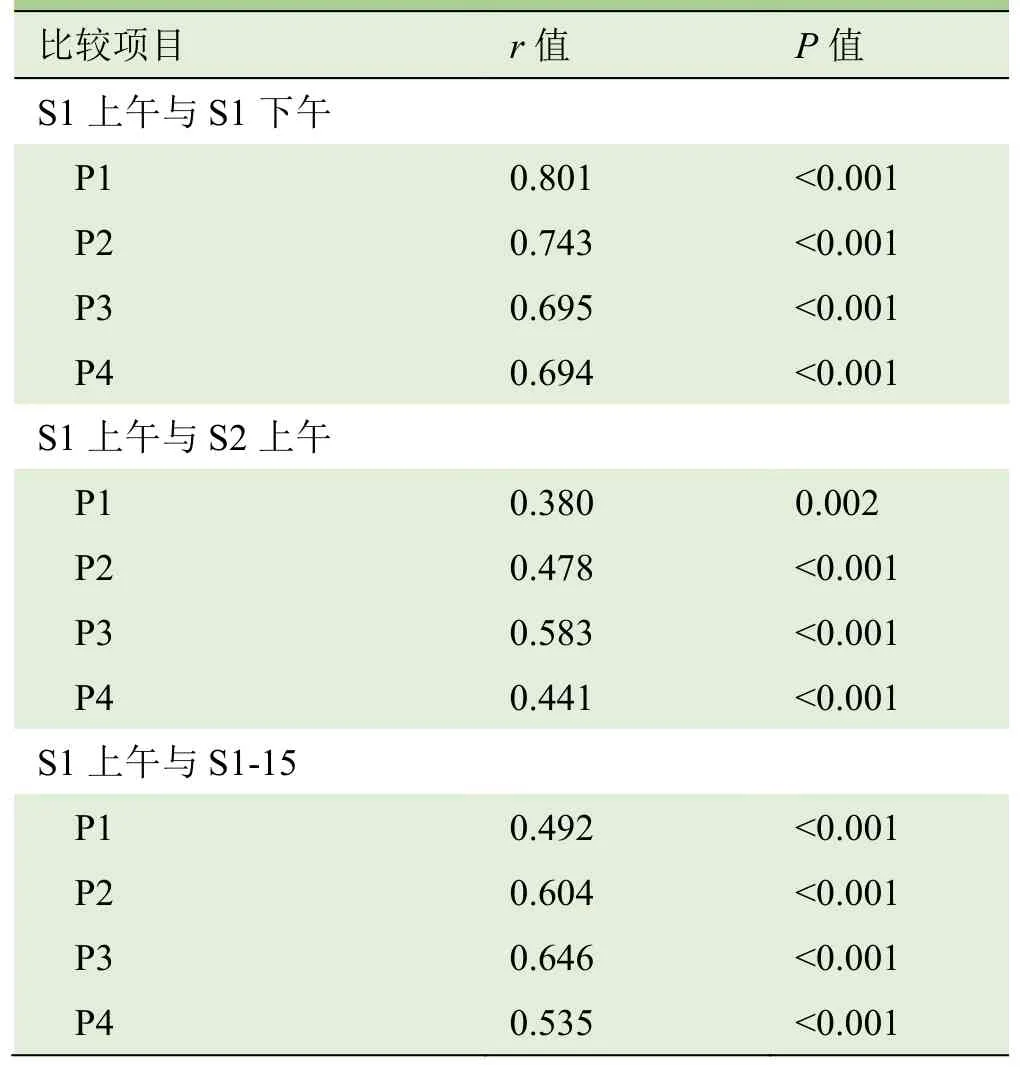
表3 正中神经杨氏模量值检查者内与检查者间的相关性分析

图2 正中神经杨氏模量测值检查者组内及组间一致性的Bland-Altman分析。A~D为同一检查者同日上午、下午正中神经P1~P4位点依次杨氏模量测值的Bland-Altman分析图;E~H为不同检查者同日正中神经P1~P4位点依次杨氏模量测值的Bland-Altman分析图;I~L为同一检查者相隔15 d P1~P4位点依次杨氏模量测值的Bland-Altman分析
3 讨论
在灰阶超声图像中,神经通常表现为一种特征性的筛孔状影像。在解剖学的引导下,可以对外周神经进行超声扫查并评估其形态变化,以期对神经的病理变化提供影像学解释。超声对神经病理学的诊断具有很高的灵敏度,并且与 MRI和肌电图有良好的相关性,在评估周围神经卡压障碍,包括CTS、肘管综合征、跗骨综合征及腓骨神经疾病等中均有重要作用[8-10]。由于神经特定的解剖位置及其与骨表面复杂的关系,对神经的探查通常不是单侧的。对于正中神经,当患者的 CTS是非双侧时,对侧正中神经通常会提供重要的信息。
Lalitha等[11]应用SWE评估外周神经疾病,发炎的神经主要表现为红色,伴随着正常硬度的丧失,这可能继发于水肿;同时骨密度可能对正中神经的测量产生一定的影响,腕部等部位因受骨性密度影响,其杨氏模量值高于前臂段,正中神经的硬度在其远心端部分逐渐增加。观察者间的一致性总体较好(从好到很好)[12]。Kantarci等[13]在长轴上测量了近端水平正中神经的杨氏模量值,与对照组相比,CTS组随着应变力和应变率的增加,正中神经的硬度也在增加(66.7 kPa比32.0 kPa,P<0.001),提示SWE可定量评价神经的硬度,为判断外周神经的生理及病理状态提供更多的影像学诊断依据。
对于弹性成像的可重复性测量,Kennedy等[14]研究显示,3名放射科医师对 79例肝脏疾病患者进行测量,比较实时SWE和二维SWE的可靠性[15],2种方法的失败率均很低,二维SWE为5%,实时SWE为 1%。同一天由同一检查者进行的正常成人肝脏二维SWE测量的可重复性较好,对于有工作经验的超声医师和新入院的超声医师,ICC分别为0.95和0.93;然而,在不同日期对同一受试者进行的观察者间重复性测量分别显示专家和经验不足的操作者的 ICC值分别为0.84和0.65[16]。检查者的经验对实时SWE测量有影响[17],因此建议检查者接受适当培训。本研究中,对于相同检查者或不同日期之间,同一天不同检查者之间,同一受试者弹性成像杨氏模量值的测量,ICC数据均显示其具有良好的可重复性,特别是同一检查者在同一天进行的检查中,ICC表现出更高的数值。
本研究的不足之处:①本研究未评估外周神经疾病患者弹性成像的可重复性,对外周神经疾病所致正中神经变化的可重复性无确定的研究。因为在外周神经相关疾病患者中,其神经容易发生水肿、纤维化、钙化等表现,故杨氏模量测值的可重复性有可能被过度估计,而本研究则降低了疾病相关杨氏模量的多变性,对外周神经疾病可重复性的研究可能作为本研究下一阶段的重点开展。②正常成人外周神经的杨氏模量值并不是完全恒定的,而是在一定小范围内波动。骨性密度有可能对其周围的神经杨氏模量的测量有一定影响,本研究并不能完全排除这种波动,但是这种影响是可接受的[12]。
总之,相同或不同检查者同一日或不同日期采用SWE所获得的正中神经杨氏模量值有较好的可重复性,且同一检查者当天重复测量时,其可重复性更好。以SWE技术为基础的超声弹性成像技术能够用于进行多中心研究及长期的外周神经相关疾病临床诊断及疗效观察,以期为外周神经相关疾病的临床诊断及病理学研究提供更为精确的影像学数据。
[1] Ophir J, Céspedes I, Ponnekanti H, et al. Elastography: a quantitative method for imaging the elasticity of biological tissues. Ultrason Imaging, 1991, 13(2): 111-134.
[2] Azizi G, Piper K, Keller JM, et al. Shear wave elastography and parathyroid adenoma: a new tool for diagnosing parathyroid adenomas. Eur J Radiol, 2016, 85(9): 1586-1593.
[3] Hong S, Woo OH, Shin HS, et al. Repeatability and diagnostic performance of shear wave elastography in evaluating breast solid mass. Clin Imaging, 2017, 44: 42-45.
[4] Mulabecirovic A, Mjelle AB, Gilja OH, et al. Repeatability of shear wave elastography in liver fibrosis phantomsevaluation of five different systems. PLoS One, 2018, 13(1):e0189671.
[5] Garra BS, Cespedes EI, Ophir J, et al. Elastography of breast lesions: initial clinical results. Radiology, 1997, 202(1): 79-86.
[6] Härtig F, Ross M, Dammeier NM, et al. Nerve ultrasound predicts treatment response in chronic inflammatory demyelinating polyradiculoneuropathy: a prospective follow-up. Neurotherapeutics, 2018, 15(2): 439-451.
[7] Yoshii Y, Tung WL, Ishii T. Measurement of median nerve strain and applied pressure for the diagnosis of carpal tunnel syndrome. Ultrasound Med Biol, 2017, 43(6): 1205-1209.
[8] Yablon CM, Hammer MR, Morag Y, et al. US of the peripheral nerves of the lower extremity: a landmark approach. Radiographics,2016, 36(2): 464-478.
[9] Hong JP, Lew HL, Lee CH, et al. Ultrasound-guided injection for the treatment of carpal tunnel syndrome. Am J Phys Med Rehabil, 2015, 94(12): e119-e120.
[10] Martinoli C, Bianchi S, Gandolfo N, et al. US of nerve entrapments in osteofibrous tunnels of the upper and lower limbs. Radiographics, 2000, 20: S199-S217.
[11] Lalitha P, Reddy MCh, Reddy KJ. Musculoskeletal applications of elastography: a pictorial essay of our initial experience. Korean J Radiol, 2011, 12(3): 365-375.
[12] Bortolotto C, Turpini E, Felisaz P, et al. Median nerve evaluation by shear wave elastosonography: impact of“bone-proximity” hardening artifacts and inter-observer agreement. J Ultrasound, 2017, 20(4): 293-299.
[13] Kantarci F, Ustabasioglu FE, Delil S, et al. Median nerve stiffness measurement by shear wave elastography: a potential sonographic method in the diagnosis of carpal tunnel syndrome. Eur Radiol, 2014, 24(2): 434-440.
[14] Kennedy P, Wagner M, Castéra L, et al. Quantitative elastography methods in liver disease: current evidence and future directions. Radiology, 2018, 286(3): 738-763.
[15] Woo H, Lee JY, Yoon JH, et al. Comparison of the reliability of acoustic radiation force impulse imaging and supersonic shear imaging in measurement of liver stiffness. Radiology,2015, 277(3): 881-886.
[16] Ferraioli G, Tinelli C, Zicchetti M, et al. Repeatability of real-time shear wave elastography in the evaluation of liver elasticity. Eur J Radiol, 2012, 81(11): 3102-3106.
[17] Ferraioli G, Tinelli C, Lissandrin R, et al. Ultrasound point shear wave elastography assessment of liver and spleen stiffness: effect of training on repeatability of measurements.Eur Radiol, 2014, 24(6): 1283-1289.
